大戟属二萜(±)Pepluanol A的首次全合成
大戟属植物可用作中药,具有清热解毒、清淤散结等多种功效,人们已从中发现多种具有抗肿瘤和抗病毒等活性或可作为多耐药逆转剂的二萜类化合物。Pepluanol A于2016年从大戟属植物Euphorbia peplus 中分离得到,该分子主体结构为[5,6,7,3]四环骨架,且含有7个手性中心,其中6个连续分布、1个为季碳中心,在全合成时具有较大的挑战性。最近,浙江大学化学系的丁寒锋教授(点击查看介绍)课题组首次报道了(±)Pepluanol A的全合成工作(图1)。
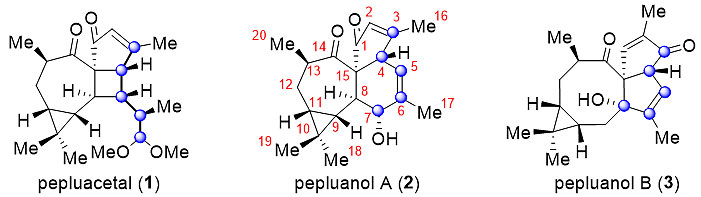
图1. Pepluanol A及其同源天然产物的结构。图片来源:Angew. Chem. Int. Ed.
作者对Pepluanol A及其同源天然产物进行结构分析后发现,该类化合物均具有高度官能化的双环1,5-二醇-2-烯或其等价结构。受Molander小组和Aurrecoechea小组工作的启发,他们推测该类结构可由相应的乙烯基环氧醛前体经还原环化反应构建。因此,他们选取简单的模板底物4a作为对象进行研究。如图2所示,在SmI2/HMPA的条件下反应以52%的收率(> 20 : 1 d.r.)得到预期产物5a,而常规的基于n-Bu3SnH/自由基引发剂的kety-olefin环化条件也仅能以较低的收率得到目标产物(entries 2–3);此外,作者分别对烯丙基钐、铬、锡等物种参与的分子内加成反应进行考察,反应均不理想(entries 4–6);令人高兴的是,在Cp2TiCl的催化下,反应具有非常好的结果(entries 8-11)。最终,作者发现向Cp2TiCl2/Zn/collidine•HCl的混合液中慢慢滴加4a,能以高达95%的收率(1.5 : 1 d.r.)得到目标产物(entry 12)。
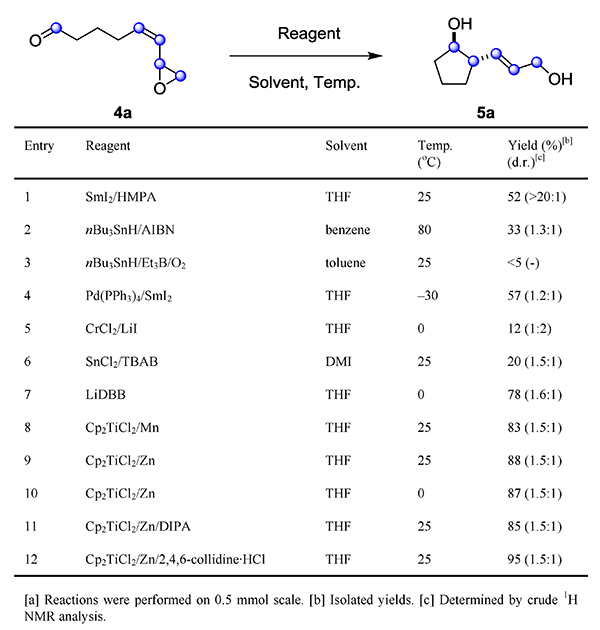
图2. 分子内烯丙基环氧醛还原环化反应的条件筛选。图片来源:Angew. Chem. Int. Ed.
接下来,作者对底物的普适性进行了考察。区别于Molander课题组所研究的五元环体系,该反应不受环系限制,在最优条件下能以88%的收率(1.9 : 1 d.r.)得到六元环化的产物5b;与此同时,双键的顺反构型对该反应也没有影响,(E )-4c以及(Z )-4c均能以相同的收率和非对应选择性得到环化产物5c;此外,他们通过该方法也能高效地实现一系列官能化的[5,6]以及[6,6]双环1,5-二醇-2-烯结构(5d–g)的构建。最后,作者还对产物结构中不同的环系进行考察,并发现随着环系的增大,其收率和d.r.值呈逐步降低的趋势(图3)。
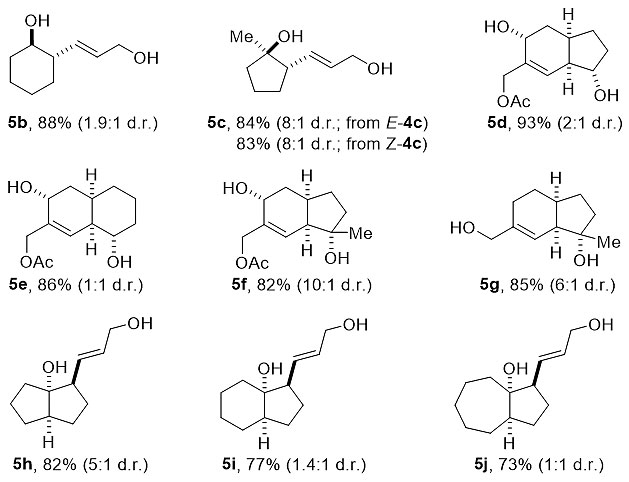
图3. 底物范围的扩展。图片来源:Angew. Chem. Int. Ed.
有了以上基础,作者对(±)Pepluanol A进行了逆合成分析。他们认为,该天然产物可由四环中间体6经区域选择性的1,2-加成反应以及Dauben–Michno氧化得到,而6则可由[5,6,7]三环中间体7经环丙烷化构建。该关键中间体可由烯丙基环氧醛8经上述发展的还原环化反应转化得到。最后,8可由亲双烯体10与Rawal双烯11经Diels–Alder反应以及多步官能化实现(图4)。
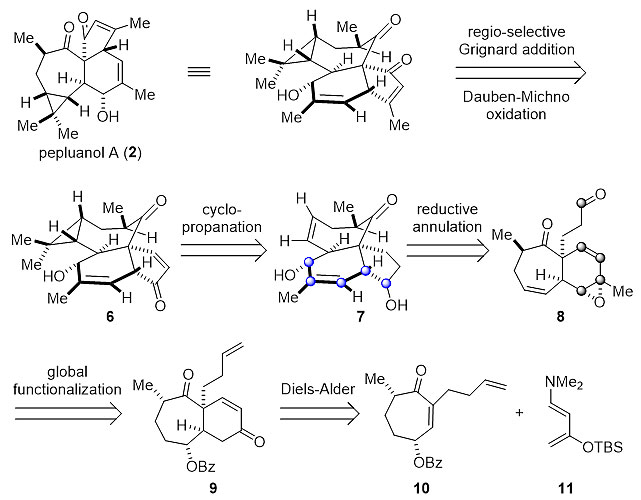
图4. (±)Pepluanol A的逆合成分析。图片来源:Angew. Chem. Int. Ed.
具体合成过程如图5所示,作者从已知的易得原料12出发,在Danishefsky改良条件下以88%的收率得到碘代产物13,随后,经Negishi偶联构建亲双烯体10。该中间体与Rawal双烯在40 ℃条件下以83%的收率得到单一构型的顺式[6,7]并环9,并实现了C15位季碳的构建。接着,所得到的中间体可区域选择性地在C6位羰基进行烯醇-三氟甲磺酸酯的构建,再经碘化亚铜催化的交叉偶联反应得到15。在甲醇钠的作用下,15可一步消除苯甲酰基并实现C13位构型的翻转,再通过区域选择性环氧化转化为半缩酮16。经消除C9位的羟基后,所得到的产物发生末端烯烃的选择性氧化切断,以70%的收率得到乙烯基环氧醛8。最后,该前体经Cp2TiCl催化的还原环化反应能以91%的收率(1 : 1 d.r.)得到目标产物三环二醇中间体7。该结构可通过C3α-OH异构体的单晶结构确认。此外,作者还同时尝试了Molander小组发展的方法,发现收率仅为15%(1 : 1 d.r.)。
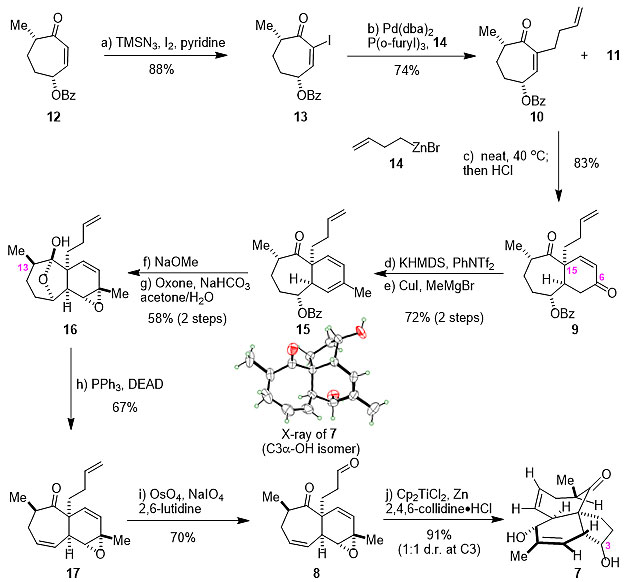
图5. [5,6,7]三环二醇中间体7的构建。图片来源:Angew. Chem. Int. Ed.
成功得到关键中间体7后,作者开始进行环丙烷的构建。由于反应过程中7采取较为稳定的船式构象,二溴卡宾从空间位阻较小的convex面靠近,因此环丙烷的相对构型得以保证。所得到的中间体再经还原双甲基化成功实现了四环产物18的构建。值得注意的是,该中间体仅在TEMPO氧化的条件下以较高的收率选择性氧化C3位的羟基;接着,通过Saegusa氧化可一步实现五元环烯酮的构建以及C7位羟基的硅醚保护;20经甲基格氏试剂的作用,可区域选择性地对C3位的羰基进行1,2加成;最后,通过Dauben–Michno氧化以及后续的酸化消除硅保护基实现了天然产物(±)Pepluanol A的首次全合成(图6)。该策略为此类天然产物及其类似物的快速高效制备提供了一种新的思路。

图6. (±)Pepluanol A的全合成。图片来源:Angew. Chem. Int. Ed.
这一研究成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是浙江大学的博士研究生宣军。
该论文作者为:Jun Xuan, Zhaobo Liu, An Zhu, Peirong Rao, Lei Yu, Hanfeng Ding
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Diastereoselective Total Synthesis of the Euphorbia Diterpenoid Pepluanol A: A Reductive Annulation Approach
Angew. Chem. Int. Ed., 2017, 56, 8898, DOI: 10.1002/anie.201704929
导师介绍
丁寒锋
http://www.x-mol.com/university/faculty/26768
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号