“冷冻电镜”胜出,三位生物物理学家分享2017年诺贝尔化学奖
10月4日,2017年诺贝尔化学奖揭晓,在“冷冻电镜(cryo-electron microscopy)”领域做出卓越贡献的三位生物物理学家分享了这项殊荣,他们是瑞士洛桑大学的Jacques Dubochet教授、美国哥伦比亚大学的Joachim Frank教授、英国剑桥MRC分子生物学实验室Richard Henderson教授。


Jacques Dubochet教授、Joachim Frank教授、Richard Henderson教授
Jacques Dubochet,1942年出生于瑞士Aigle,1973年于日内瓦大学和瑞士巴塞尔大学获得博士学位,后任教于瑞士洛桑大学。
Joachim Frank,1940年出生于德国锡根,1970年于德国慕尼黑工业大学获得博士学位,现任教于美国哥伦比亚大学。
Richard Henderson,1945年出生于苏格兰爱丁堡,1969年于剑桥大学获得博士学位,现任职于剑桥MRC分子生物学实验室。
冷冻电镜为什么会获得诺奖?
诺奖委员会给出的获奖理由原话是“for developing cryo-electron microscopy for the high-resolution structure determination of biomolecules in solution”,这句话已经概括了冷冻电镜(通常缩写为Cryo-EM)的意义,让科学家们能高效率地以原子级分辨率获得生物分子的三维结构。
俗话说的好,“一图胜千言”,可视化的生物分子结构一方面帮助科学家更好地理解这些分子的生物学功能,另一方面对于药物研发具有重要的指导意义。
下面是近些年几个依靠冷冻电镜获得的生物大分子结构,包括获得今年诺贝尔生理学或医学奖的控制“昼夜节律”的蛋白质复合物(下图a),与听觉相关的压力变化传感器(下图b),以及寨卡病毒(下图c)。这些结构,依靠之前的结构生物学研究技术根本不可能获得。
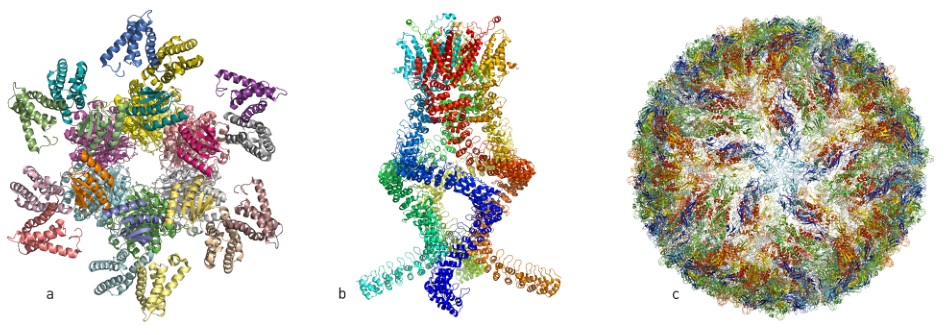
近些年几个依靠冷冻电镜获得的生物大分子结构
什么是冷冻电镜?
说到分子结构,大部分化学和材料学研究者都会想起X-射线晶体学和核磁共振(NMR)。的确,过去的相当长一段时间,蛋白质结构的解析也一样需要依靠X-射线晶体学和核磁共振。在已解析的一千多种膜蛋白结构当中,90%以上都采用的是X射线晶体学方法,核磁共振在小分子量的蛋白质结构解析中也发挥了重要的作用。
然而,这两种方法都面临不少限制。NMR仅适用于相对较小的蛋白质;X射线晶体学需要目标分子能形成高质量的晶体,就算这样也只能得到结晶态分子的结构,而无法反映生物分子的动态变化。郁闷的是,相当数量的生物分子无法形成良好的晶体,这让很多结构生物学研究者欲哭无泪。
电镜在被发明之后的很长一段时间之内,都无法用于生物材料的结构表征,电镜的电子束能量高,而且操作要求真空和脱水,这些让脆弱的生物分子无法承受。
1968年,英国剑桥MRC分子生物学实验室的Aaron Klug博士等人利用电子显微镜照片重构噬菌体三维结构,提出了电镜三维重构技术。Klug博士也因发展晶体电子显微镜方法而获1982年诺贝尔化学奖。1974年,加州大学伯克利分校的Robert Glaeser教授和他学生Kenneth A. Taylor首次提出了冷冻电镜技术,成功实现了冷冻含水生物样品的电镜成像,在超低温条件下可有效降低电子辐射对冰冻样品的结构破坏并可维持高真空度。
冷冻电镜的基本原理就是先把样品冰冻,然后保持超低温进入电子显微镜,高度相干的电子照射样品,电子穿透样品和附近的冰层并被散射,探测器和透镜系统将散射信号转换为放大的图像并记录下来,最后进行三维重构,从二维图像通过计算得到样品的三维结构。尽管在超低温的条件下,电子带来的辐射损伤被有效地控制到一定程度,但由于脆弱的生物分子样品所能承受的辐射剂量有限,导致检测的信噪比很低。另外,随着观测的进行,额外的电子会累积而造成分子的移动,导致获得的图像变得模糊。简单点说,最初冷冻电镜的分辨率比较低,只能用来分析相对较大的样品结构,比如病毒颗粒。
1975年,Richard Henderson教授等人在Klug博士工作基础上通过电子显微镜获得膜蛋白细菌视紫红质(bacteriorhodopsin)的三维结构,分辨率达到了7 Å(下图a),这在当时已经是很了不起的成就,但与X射线晶体学能提供的3 Å分辨率相比,还是显得相当粗糙。Henderson教授显然并不满足,随着电子显微镜技术以及样品冷冻技术的发展,15年后的1990年,他终于通过冷冻电镜技术获得了第一张分辨率在原子级别的蛋白质结构图像(下图b)。这一工作证明冷冻电镜一样可以像X-射线晶体学那样提供高分辨率的生物分子结构信息。
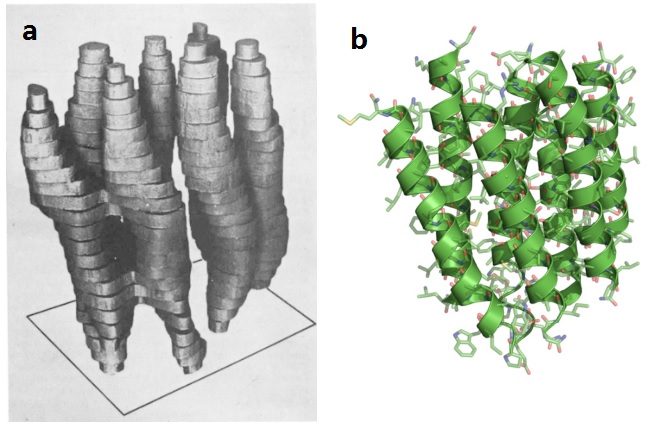
细菌视紫红质结构的对比
但结构规整的细菌视紫红质的成功在某种程度上只能算是一个例外,如何才能将这一技术推广到种类繁多的其他生物分子并获得高分辨率的三维结构呢?Joachim Frank教授也在思考这个问题,他在1975到1986年间发展了一种图像处理方法,通过算法可以对电镜下模糊的二维图像进行分析和合并,从而获得相对清晰的三维结构。Frank教授提出的单颗粒三维重构算法对于实现无需结晶的蛋白质三维结构解析至关重要,也是冷冻电镜技术发展的基石。
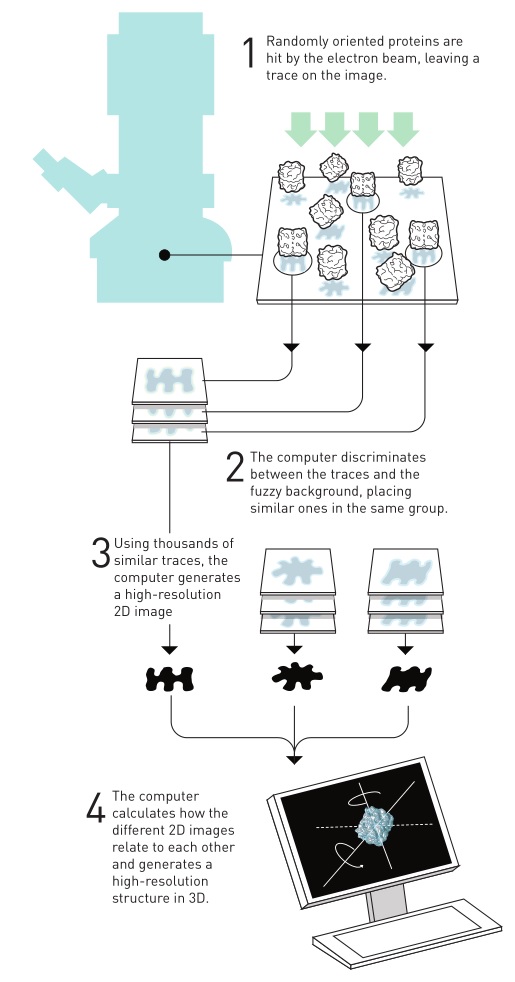
Joachim Frank的图像分析方法
Henderson教授1975年获得细菌视紫红质三维结构时,用的是葡萄糖溶液来保护他的膜蛋白不会发生脱水。这一招对于很多水溶性蛋白来说派不上用场。而将样品直接冰冻,冰晶体会干扰电子束使得最后得到的图像一团糟。有没有办法既能让分子处于水环境又不形成冰晶体呢?Jacques Dubochet教授在1982年找到了一个完美的解决方案——让水“玻璃化”。通过快速降温,在生物分子周围的水以液态形式被固化,形成无定形的冰。这样一来,生物分子即使在真空中也能维持天然形态,而且玻璃态冰在电镜下几乎透明,不会形成干扰。这一突破使得快速制备高质量冷冻电镜样品成为可能,冷冻电镜技术也开始推广开来。

Jacques Dubochet的玻璃化方法
在这些奠基者的工作之后,冷冻电镜技术不断地得到优化,最近两三年里发生了很重要的技术突破,包括直接电子探测器(Direct Electron Detectors)的发明和高分辨率图像处理算法的改进,使得冷冻电镜的分辨率终于达到了梦寐以求的原子级。以谷氨酸脱氢酶为例(下图),通过冷冻电镜能拿到的最高分辨率已经达到1.8 Å。
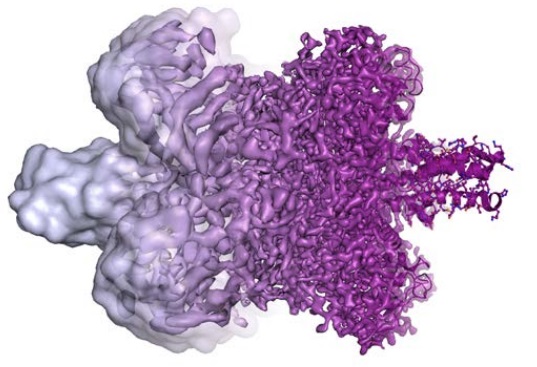
冷冻电镜解析的谷氨酸脱氢酶结构分辨率逐渐提高(从左到右)
冷冻电镜技术的优势可总结为:
不需要结晶,很多难以结晶的大分子复合物也能成为研究对象,范围大大扩展;
样品量小制备快,可重复性高;
可解析天然、动态的结构,非常适合生物分子。
冷冻电镜技术的突破给结构生物学领域带来了一场大风暴,大量高分辨率的分子机器、膜蛋白、蛋白质复合物结构被报道,相关领域的研究也迈进了一个崭新的时代。
PS:冷冻电镜的意义毋庸置疑,但三位“生物物理学家”分享2017年诺贝尔“化学”奖,这让身为化学汪的笔者只能长叹一声,唉……
注:以上内容编译自诺贝尔奖官方网站,图片等内容版权归属于Nobelprize.org
相关阅读:
2017年诺贝尔生理学或医学奖揭晓,发现控制“昼夜节律”分子机制的三位美国科学家获奖
众望所归:2017年诺贝尔物理学奖归属“发现引力波”的LIGO三科学家
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
深度解读2016化学诺奖成果:超分子化学以及分子机器 2016-10-13
-
2015诺贝尔化学奖:DNA修复机制的分子机理 2015-10-13
-
众望所归:2017年诺贝尔物理学奖归属“发现引力波”的LIGO三科学家 2017-10-03
-
2017年诺贝尔生理学或医学奖揭晓,发现控制“昼夜节律”分子机制的三位美国科学家获奖 2017-10-02



































 京公网安备 11010802027423号
京公网安备 11010802027423号