新的串联反应合成2H-色烯(2H-Chromene)
2H-色烯是许多药物和具有生理活性天然产物的重要结构单元,含有这类骨架的化合物在消炎、抗真菌的研究中表现出良好的活性。因此,有机化学家一直致力于发展合成该结构单元的新方法高效快速地构建多官能化的2H-色烯(图1)。然而,目前的方法很难在C8位引入含碳的取代基,而同时在C2和C3位引入取代基也十分具有挑战性。目前已发展的合成方法限制了2H-色烯天然产物的全合成及药物化学的研究。因此,发展新的方法解决相关的合成问题具有重要的研究意义。
最近,福建农林大学的宋立彦(点击查看介绍)课题组和香港科技大学的童荣标教授(点击查看介绍)课题组合作发展了一种通过串联克莱森重排、邻亚甲基醌(o-QM)中间体的生成、6π电环化反应快速构建多种取代2H-色烯的方法(图1),从而很好地弥补了以往合成方法的缺陷。作者对底物的适用范围进行了深入的考察,发现可以合成具有多种取代基的2H-色烯,甚至能以良好的立体选择性得到稠环的2H-色烯。芳香环上取代基的电子效应对反应影响并不明显,可以良好至优秀的收率得到目标产物。克莱森重排后C8位的不同取代基也具有良好的兼容性,并可得到良好的顺反及立体选择性。为了展示该方法学的实用性,作者以合成的底物2e作为中间体,通过3至4步经典的反应,集合式地完成了3种2H-色烯类天然产物(7-9)的全合成。
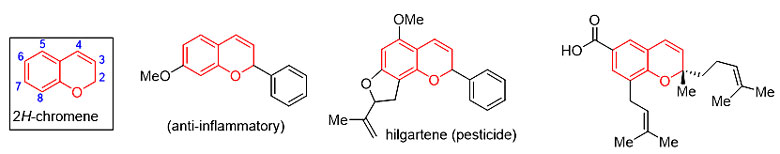
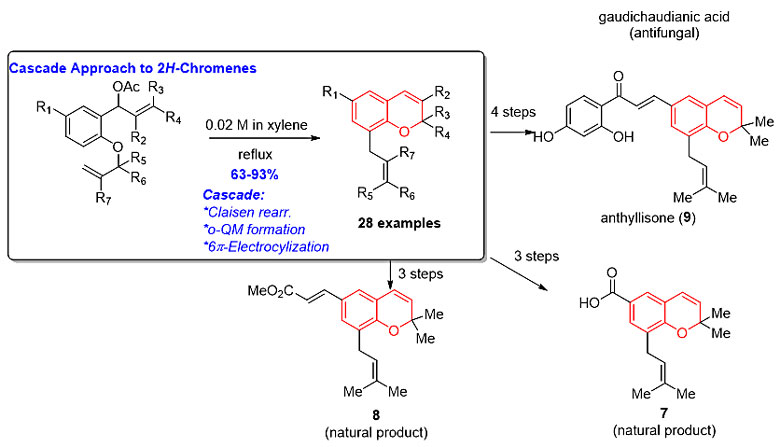
图1. 具有生物活性的2H-色烯化合物和新型串联反应的合成方法及其在全合成中的应用。
为了进一步拓展底物的适用范围,作者基于对反应机理的认识,设想如果在C8位引入取代基,对位克莱森重排反应会使烯丙基重排至C6位,得到C6、C8双取代的2H-色烯。实验发现,C8位取代基的性质对反应结果具有很大的影响,非碳取代基会使反应的产率降低(2t-2u),而碳基取代基的底物则具有较好的反应效率。该反应不仅表现出优异的化学选择性(2x)和立体选择性(2y-2z, 2za-2zb)(图2),而且解决了长久以来无法在C6位引入官能团的问题。
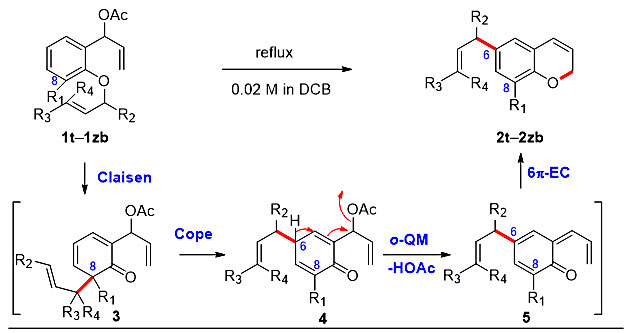
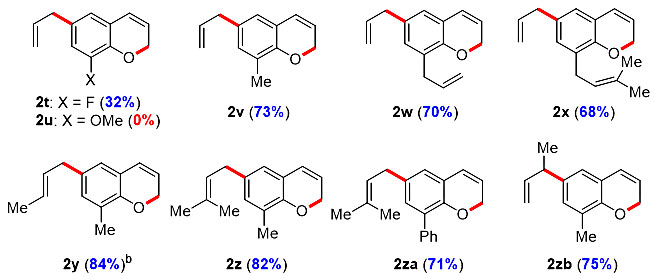
图2. 对位克莱森重排/邻亚甲基醌(o-QM)的生成/6π电环化串联反应的底物拓展。
小结
作者发展了一种新型的构建2H-色烯结构的串联反应,能够简单地在2H-色烯的C2、C3、C6、C8位引入取代基,得到多种取代基修饰的2H-色烯结构,并成功将该方法应用于天然产物的全合成中。该方法有望用于合成更多结构新颖的2H-色烯化合物,从而为药物的筛选、新药研发提供有力的支持保障。相关工作发表在Chemical Communications 上,作者为黄芳、郭立文、欧阳明安,通讯作者为宋立彦、童荣标。
该论文作者为:Liyan Song, Fang Huang, Liwen Guo, Ming-An Ouyang and Rongbiao Tong
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A cascade Claisen rearrangement/o-quinone methide formation/electrocyclization approach to 2H-chromenes
Chem. Commun., 2017, 53, 6021, DOI: 10.1039/C7CC03037A
宋立彦博士简介

宋立彦,福建农林大学制药工程系副教授,2006年于厦门大学化学系获得学士学位,2012年于中国科学院上海有机化学研究所获得博士学位,在李超忠研究员课题组从事自由基环化反应的研究;2012-2014年在香港科技大学童荣标教授课题组从事博士后研究期间,致力于天然产物全合成的研究;2014年8月起任福建农林大学制药工程系副教授,从事天然产物导向的有机合成方法学研究,在有机化学领域发表SCI论文十余篇,包括J. Am. Chem. Soc.、Org. Lett.、J. Org. Chem.、Chem. Commun. 等;目前的研究兴趣主要集中于(1)邻亚甲基醌(o-QM)有机合成方法学及其在天然产物全合成中的应用研究,(2)天然产物导向的有机合成方法学研究,(3)生物活性分子的设计、合成及其药物化学的研究。
宋立彦
http://www.x-mol.com/university/faculty/45887
童荣标
http://www.x-mol.com/university/faculty/7074
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号