Science:重氮+硫叶立德“2合1”试剂,轻松实现C(sp³)原子转移
副标题:Spiro-C(sp3)原子转移——用Ph2SCN2创建刚性三维结构
三维(3D)分子骨架在有机合成和药物化学领域具有重要意义。近年来化学家努力探索如何高效且简洁地构建3D分子骨架,如:立方烷、螺桨烷、双环丁烷、螺[2.2]戊烷等,这些努力也推动了合成方法学的发展。最近几年,以原子插入、删除、替换为代表的分子骨架编辑(skeletal editing)策略发展迅速,有希望大大加速药物发现并彻底改变有机化学家设计分子的思维反噬。其中,碳原子插入通常涉及将“C-R”片段插入C(sp2)-C(sp2)键并产生平面芳香(杂)环。如图1A所示,传统的碳原子转移反应(如:Seyferth-Gilbert同系化反应(I)、Corey-Fuchs反应(IV)、Doering-LaFlamme丙二烯合成法)均通过不饱和卡宾或亚乙烯基中间体(VI)进行以生成sp杂化的碳原子,进而无法生成三维结构。相比之下,有关C(sp3)原子转移的反应却鲜有报道,这可能是因为碳原子前体(如:二氧化三碳、重氮四唑)或碳化铬配合物参与的碳弧放电反应是非选择性的,并且碳原子转移产物的产率极低。2010年,Kato、Baceiredo等人合成了双叶立德化合物VIII(图1B),显示出良好的活性,但应用方面的进一步研究却尚未开展。2023年,Tobisu等人利用N-杂环卡宾(X)作为碳原子转移试剂,通过形成新的C-C键成功地将丙烯酰胺(IX)环化为γ-内酰胺(XI)(Science, 2023, 379, 484,点击阅读详细)。然而,要想开发一种通用、精准且高效的方法来引入C(sp3)原子以构建四个新的C-C单键仍然极具挑战性。
近日,德国多特蒙德工业大学的Max M. Hansmann教授研究团队合成并分离了一种重氮硫叶立德试剂——Ph2S=C=N2(图1C),使用这种结合了重氮化合物和硫叶立德反应性的试剂,可轻松通过顺序或单步安装C(sp3)原子构建螺碳中心。C(sp3)原子周围可容易地生成新的C-C键和C-X键(X = O或N),无需过渡金属催化最终可以实现单步构建多达四个C-C键。该试剂还可用于构建高张力3D刚性螺环骨架,包括(氧杂)螺[2.2]戊烷以及螺三环化合物。相关成果发表在Science 上。
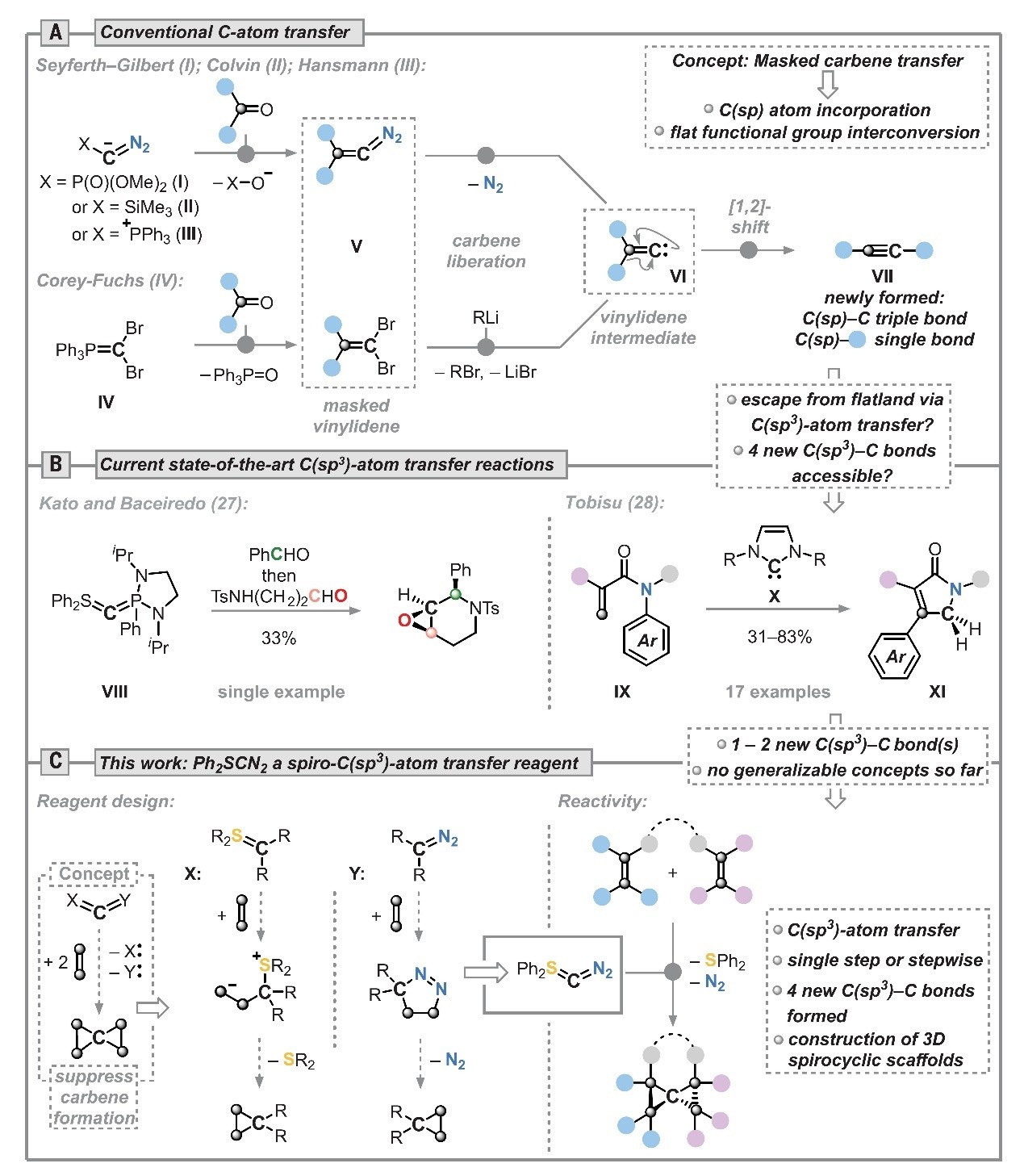
图1. C(sp3)原子转移试剂的研究进展。图片来源:Science
首先,作者将鏻盐1a置于双(三甲基硅烷基)氨基钾(KHMDS)下发生去质子化并得到Ph2S=C=PPh3(2a,产率:57%),再与N2O(-78℃→室温)反应1 h后完全转化(图2A),31P NMR谱显示生成了Ph3P=O(4a),同时原位红外光谱观察到1960 cm-1处重氮N=N键伸缩振动的特征峰。值得注意的是,此过程没有生成二苯基亚砜(Ph2S=O),但由于从Ph3P=O中分离所需的重氮硫叶立德Ph2S=C=N2(3)极具挑战性,因此作者改用Kato-Baceiredo叶立德2b,其氧化膦4b可通过洗涤简单分离并以84%的产率获得淡黄色固体3(-40°C的惰性条件下储存>6个月),X-射线单晶衍射分析显示S1-C1键长(1.727(2) Å)比其前体2b(1.684(3) Å)长(图2B),但仍在硫叶立德的S=C键长范围内。另外,自然布局分析表明3的中心碳原子带部分负电荷(-0.62 e)、硫原子几乎完全带正电荷(+0.90 e)、中间N原子是中性的(+0.01 e)、末端N原子略带负电荷(-0.16 e);Wiberg键指数(WBI)显示出明显的C-S单键(WBI=1.25)和N=N双键(WBI=2.01)特征,而C-N键介于单键和双键之间(WBI=1.43)。如图2C所示,作者利用密度泛函理论(DFT)计算研究了Ph3P/N2 vs Ph2S/N2的交换选择性,结果显示高HOMO-1和HOMO能级使得2a成为明显的碳亲核试剂,从而引发对N2O末端N原子的亲核进攻。两个相互竞争的过渡态(TS1和TS2)最终导致Ph3P/N2或Ph2S/N2交换,其中TS1通过高度异步的协同(3+2)环加成不可逆地生成P-O加合物Int1,而TS2则生成两性离子Int2,并且沿新形成C-N键的低旋转势垒使得Int2快速相互转化为Int1。然而,两个环消除过程都具有较高的热力学驱动力,而且消除亚砜的势垒明显更高,其主要是由于硫的固有性质以避免四价物种。
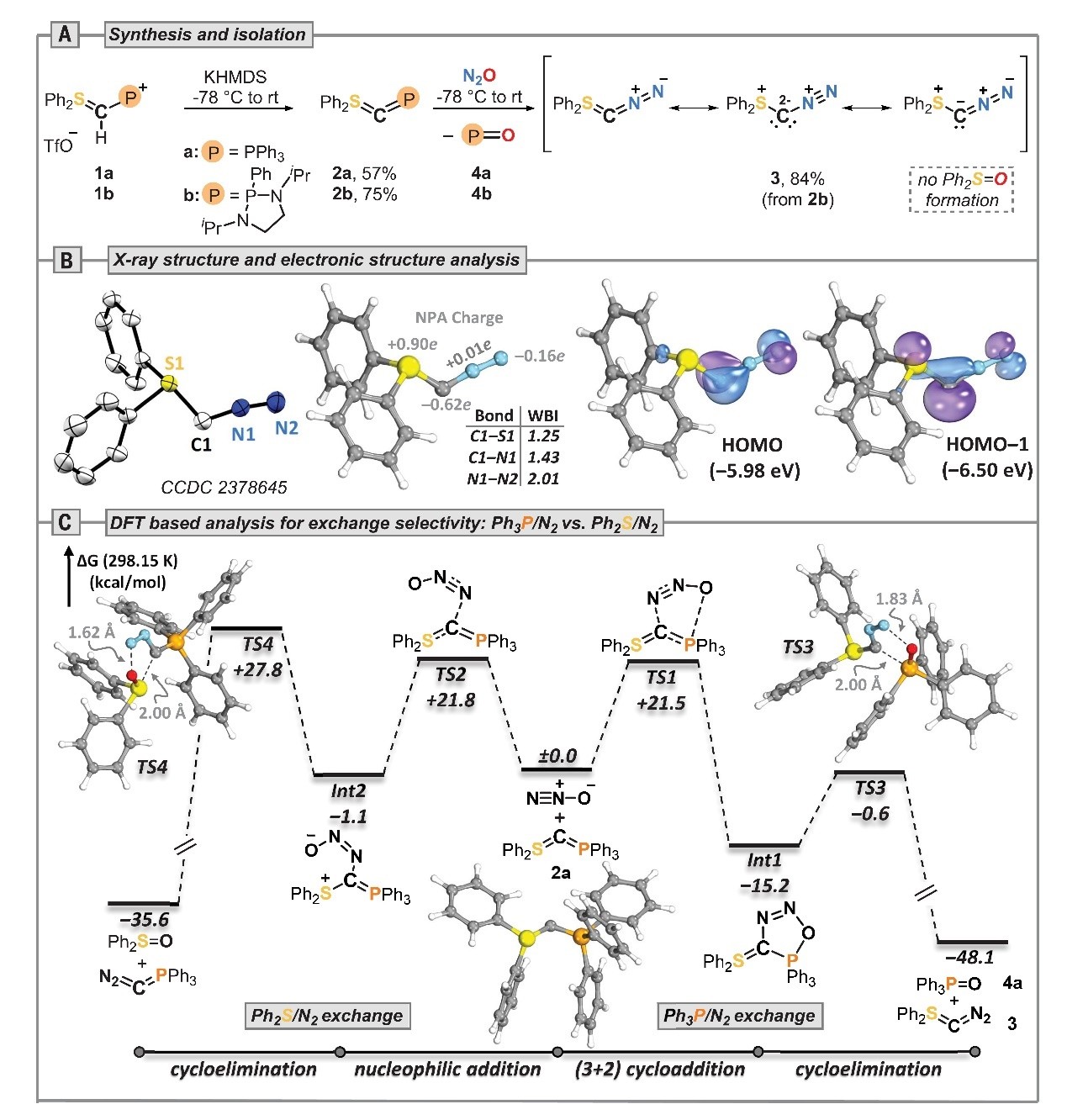
图2. 重氮硫叶立德 3 的制备、结构和计算研究。图片来源:Science
随后,作者对3参与连续C(sp3)原子转移的反应性进行了研究。在室温下用π-受体取代的烯烃处理3,几分钟内便可观察到起始原料的完全消耗(图3,step A),例如:含有N-甲基马来酰亚胺的烯烃(5a)、1,1-二取代烯烃(5b-5d)、三取代和四取代烯烃(5e、5f)、未被π-受体取代的烯烃(如:降冰片烯(5g)、环戊烯(5h))、未活化苯乙烯衍生物(5i-5k)以及杂芳族烯烃(5l-5n)均能兼容该反应,以中等至较好的产率(31-93%)获得相应产物,尽管未活化苯乙烯衍生物的反应时间较长(5i和5j:48 h;5k:15 min)。值得注意的是,若3与单取代烯烃或1,2-二取代烯烃经历较长的反应时间后,可以49-99%的产率获得官能团化吡唑(6a-6f)而非预期的环加合物5,这是由于在快速(3+2)环加成后发生了较慢的1,3-质子迁移和Ph2S消除,进而获得吡唑环(图3,step B)。另外,富马酸二甲酯和丙二酸二甲酯的低温NMR研究证实了逐步(3+2)环加成机制,两者均提供相同的trans-立体化学结果(5o)。
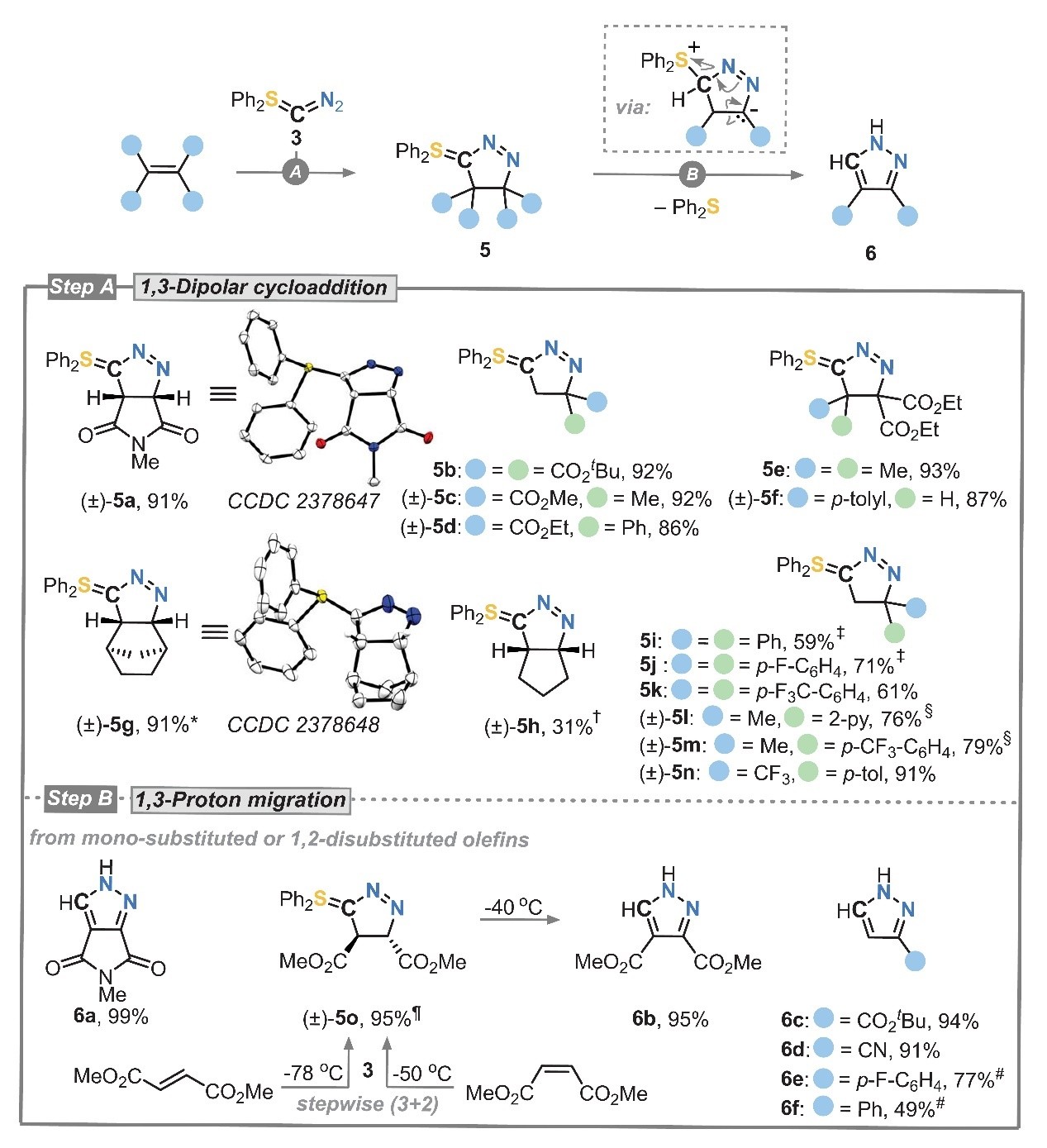
图3. (3+2) 环加成生成硫叶立德 5 (步骤 A) 和吡唑 6 (步骤 B)。图片来源:Science
接下来,作者探索了吡唑啉叶立德5中S-叶立德部分的环丙烷化反应活性(图4,step B1),即用1 equiv N-甲基马来酰亚胺处理硫叶立德5a后,能以67%的产率获得环丙烷化产物7a;或者直接用3.0 equiv N-甲基马来酰亚胺处理3,从而以67%的产率一锅法获得7a,这说明3在单步反应中能够形成三个新的C-C键。类似地,吡唑啉硫叶立德5b和5c与N-甲基马来酰亚胺进行反应时以较好的产率获得了相应的环丙烷7b和7c;而吡唑啉硫叶立德5与富马酸酯和马来酸酯进行反应时生成了具有相同相对构型的螺环化合物7d,这符合逐步Corey-Chaykovsky型机制。此外,二酯S-叶立德(5b)、酯基/烷基S-叶立德(5c)、二芳基S-叶立德(5i-5k)、杂芳基/烷基S-叶立德(5l)和氟化S-叶立德(5m和5n)均能与富马酸二甲酯顺利进行反应并获得相应的环丙烷化产物(7e-7l),同时其它缺电子烯烃(如:丙烯腈、1,1-二酯基烯烃)也能以94-95%的产率转化为相应的环丙烷化产物7n和7o。其次,作者对连续的C(sp3)-原子转移(step C1)进行了研究,发现15种含螺环丙烷的1-吡唑啉(7a-7o)可在130 ℃下释放N2并以良好至优异的产率得到高度取代的螺[2.2]戊烷(8a、8c和8e-8o),特别是作者还利用一锅法实现了连续的C(sp3)-原子转移,即从室温稳定的S/P盐1a出发原位生成3,在不分离2a或3的情况下连续加成两种不同的烯烃并以97%的产率获得环丙烷化产物7e(561 mg),随后释放N2并以85%的产率获得碳原子转移产物8e(413 mg)。另一方面,吡唑啉叶立德5i和5k与甲醛或(杂)芳基醛进行反应时能以69-95%的产率生成螺杂环(9a-9e,step B2)。同样地,未取代环氧化合物9a和9b也可释放N2并以91%的产率获得氧杂螺[2.2]戊烷10a和10b(step C2),而芳基取代的环氧化物(9c-9e)发生N2释放时以90-94%的产率获得取代环丁酮(11a-11c),而且无需分离螺环即可一步获得11d(产率:45%)。
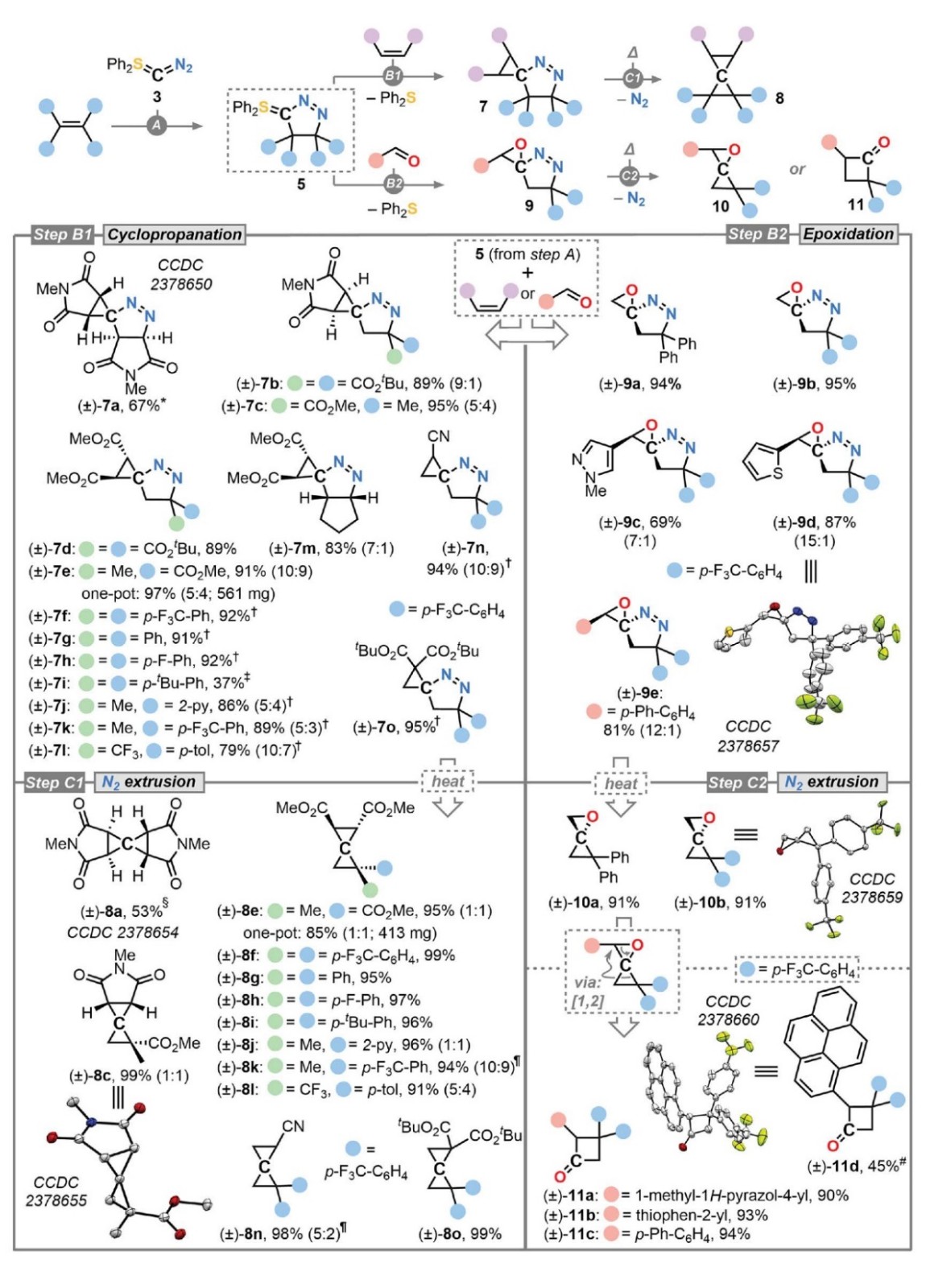
图4. C(sp3)原子逐步转移得到螺[2.2]戊烷和氧杂螺[2.2]戊烷。图片来源:Science
如图5所示,作者尝试一步法实现螺-C(sp3)-原子转移反应,即3与二甲基或二乙基2,5-二亚甲基己二酸酯在室温下反应30 min后,以69-72%的产率一步法获得复杂的三环螺戊烷(13a和13b),同时13C标记实验证明插入的碳原子来自3。值得一提的是,原位生成的3进行分子内C(sp3)原子转移,并在不分离任何空气敏感中间体的情况下以81%的产率一锅法获得三环[4.1.0.01,3]庚烷13a(862 mg),再经还原得到二醇13aI(产率:91%),或者经选择性单皂化反应得到稳定的酯/酸构建砌块13aII(产率:98%),其进一步缩合获得酰胺13aIII(产率:81%)。此外,邻苯基桥联的二烯与3反应时可以85%的产率获得四环体系(13c),此过程新引入的螺碳原子包含四个新的C-C键并高度扭曲成跷跷板双锥体几何结构,其中环状C-C键(1.412(2) Å)被拉长以降低张力;同时不对称双原子连接的起始原料也能顺利转化为酯基/腈官能团化三环[4.1.0.01,3]庚烷13d。最后,作者对环尺寸的变化和杂原子插入反应进行了研究,较长三原子连接(CH2、O和S部分)的底物可以56-83%的产率获得杂原子取代的三环[5.1.0.01,3]辛烷(15e-15g),并引入了三个新的立体中心;不对称二烯也可转化为三环产物15i,其中(3+2)环加成发生在酯基取代烯烃一侧,而环丙烷化发生在氰基取代烯烃一侧。另外,杂原子(O、S)取代的1,6-庚二烯在加热后以中等产率得到了所需的桥联螺三环(13e-13g),同时还生成了氮杂双环[3.2.0]庚烷14e和14f副产物。需要指出的是,N-Ts桥联底物15h在光照条件下可以81%的产率获得cis-三环[5.1.0.01,3]辛烷13h(cis:trans=9:1),进一步添加三重态光敏剂(如:二苯甲酮)可降低cis:trans选择性(3:1),而且cis-13h在室温下会缓慢重排为烯烃14h。
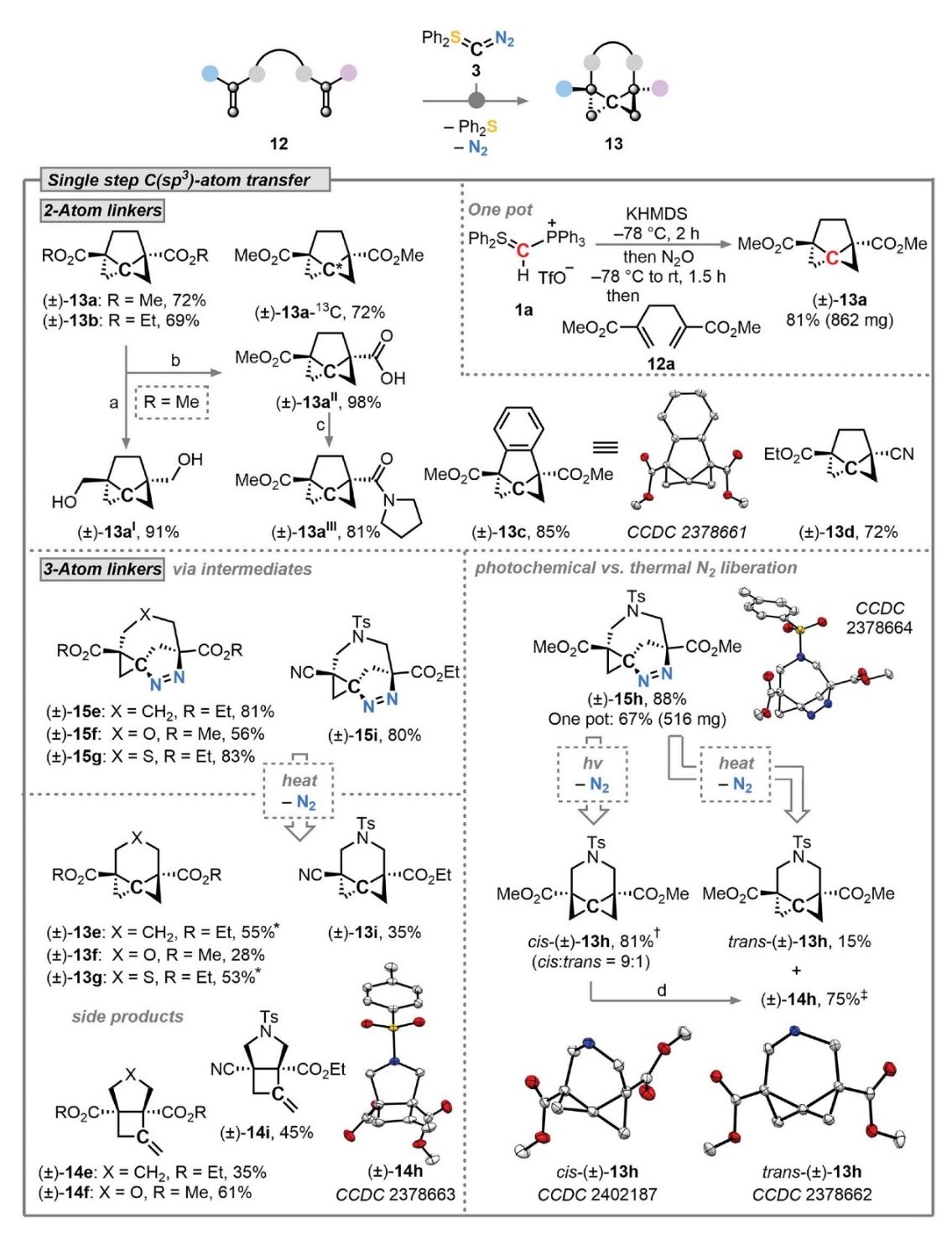
图5. 单步螺C(sp3)原子转移制备桥接螺戊烷。图片来源:Science
总结
Max M. Hansmann教授团队报道了一种重氮硫叶立德试剂Ph2S=C=N2,成功地实现了C(sp3)原子的精准插入并构建了一系列高张力的3D刚性螺环支架。Ph2S=C=N2是一种广泛适用的C(sp3)原子转移试剂,可在C(sp3)原子周围逐步或单步构建多达四个新的C-C键。该成果将促进对更多C(sp3)原子转移反应的探索,使人们能够获得先进的3D分子骨架,并将碳原子转移扩展到主族和过渡金属化学等其他领域。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

spiro-(sp3)-atom transfer: Creating rigid three-dimensional structures with Ph2SCN2
Qiu Sun, Jan-Niklas Belting, Julian Hauda, David Tymann, Patrick W. Antoni, Richard Goddard, Max M. Hansmann
Science, 2025, 387, 885-892. DOI: 10.1126/science.ads5974
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
“驯服”三氟甲基重氮甲烷(CF3CHN2) 2019-01-29
-
意外发现的Science:N-杂环卡宾还能这么用? 2023-02-09
-
Science:真正转移“单原子碳”的试剂,还挺稳定 2024-07-31


































 京公网安备 11010802027423号
京公网安备 11010802027423号