Science:氮原子直接插入碳碳双键,这个廉价试剂很关键
含氮化合物在药品、农用化学品及材料领域中占据着至关重要的地位,因此C-N键的构建已成为有机合成化学领域的核心研究方向之一。烯烃一方面具有石化产品和天然萜烯中的丰富原料来源,一方面又作为合成中间体被广泛应用,因而被视为重要的含氮化合物的前体。基于烯烃C(sp2)-C(sp2) π键的独特反应活性,化学家开发了一系列高效且多样的引入含氮官能团的方法,如氮杂环丙烷化、氢胺化与氨基官能团化等。完全裂解C(sp2)-C(sp2)双键并构建C-N键在解锁全新合成策略方面颇有意义,不过相关报道仍然不多见(图1A)。相比之下,臭氧分解的应用较多,已成为实验室及工业生成条件下裂解C(sp2)-C(sp2)双键的最重要方法之一(图1B)。在该领域及其相关的氧化裂解反应中,近期取得的进展引人注目。例如,Daniele Leonori等人利用光激发的硝基芳烃作为活性氧化剂与烯烃发生自由基[3+2]环加成,生成安全、稳定的“N-doped”臭氧化物,在温和的水解条件下便可生成相应的羰基产物(Nature, 2022, 610, 81,点击阅读详细)。Ohyun Kwon等人通过O3、亚铁盐以及氢原子供体PhSH实现了一系列复杂含烯基分子(例如可从植物大量获得的廉价萜烯类分子)的C(sp3)-C(sp2)键的断裂,以高收率得到了光学纯的氢化脱烯产物(Science, 2019, 364, 681,点击阅读详细);后来,他们又利用臭氧分解和铜催化策略,在温和条件下实现了烯烃C(sp3)-C(sp2) σ键断键交叉偶联反应,成功地构建了一系列C(sp3)-N键(Science, 2023, 381, 877, 点击阅读详细)。在这些工作里,能看到一些含氮化合物被合成,这意味着直接通过烯烃裂解形成C-N键是有希望的。不过,也要看到,此前关于此类反应的报道十分有限,通常仅涉及使用特定的烯烃(如苯乙烯)生成苯甲腈和苯胺,或使用共轭二烯生成肉桂腈。特别的是,上述产物大多可通过其他方法更容易地获得,进而限制了这些方法在合成化学中的应用。值得一提的,数月前Mark Gandelman等人报道了“氮杂”版的烯烃臭氧分解反应(Nat. Chem., 2025, 17, 101,点击阅读详细),他们将其称为烯烃“三氮烯解”(triazenolysis),通过C=C键断裂将烯烃转化为有价值的胺。该反应机制涉及triazadienium阳离子与烯烃的(3+2)环加成反应形成相应的三唑啉中间体。尽管该方法设计精巧,但其应用仍受到可用烯烃种类和氮取代基选择的限制。
近日,瑞士苏黎世联邦理工学院(ETH Zürich)的Bill Morandi教授团队在Science 上报道了一种烯烃的氧化胺化反应——将氮原子直接插入未活化碳碳双键获得氮杂联烯正离子中间体,再转化为腈或脒产物(取决于烯烃的初始取代模式)。该反应的关键是一种市售可得且廉价的高价碘试剂——PIFA(双(三氟乙酰氧基)碘苯)。此反应操作简便且功能兼容性高,并适用于广泛的未活化烯烃,还可作为合成酰胺和胺类化合物以及15N标记分子的一般策略。
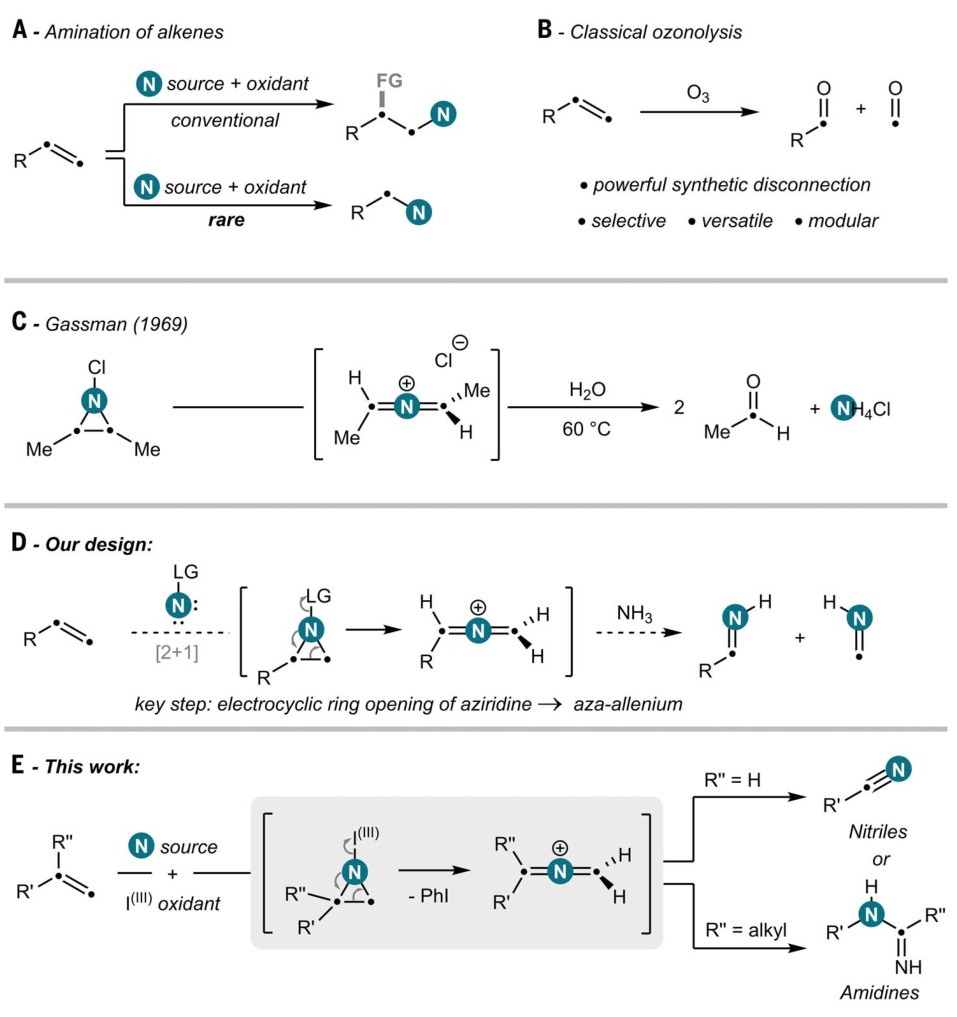
图1. 背景介绍及本文工作。图片来源:Science
首先,作者确定了反应设计相关的几个关键挑战:(i)非活化烯烃的固有反应性较低低;(ii)溶剂可能会过早淬灭氮杂联烯正离子中间体;(iii)协调和控制复杂的多步反应序列存在较大难度。前期研究发现,氨和高价碘试剂合成的碘氮宾已是氮原子插入反应中的关键中间体。基于此,作者将注意力集中在合成碘氮宾等价物方面。与假设一致,商业可得的高价碘源PIFA与氨基甲酸铵(作为氨的替代物和氮源)在甲醇中与1-癸烯混合时,未观察到任何反应性。作者将溶剂更换为三氟乙醇(TFE)和六氟异丙醇(HFIP),发现TFE和HFIP使原料完全转化为预期的腈产品以及作为PIFA副产物的碘苯。进一步优化发现,使用过量高价碘试剂和氨基甲酸铵反应30 min以定量的产率获得壬腈(1a)。
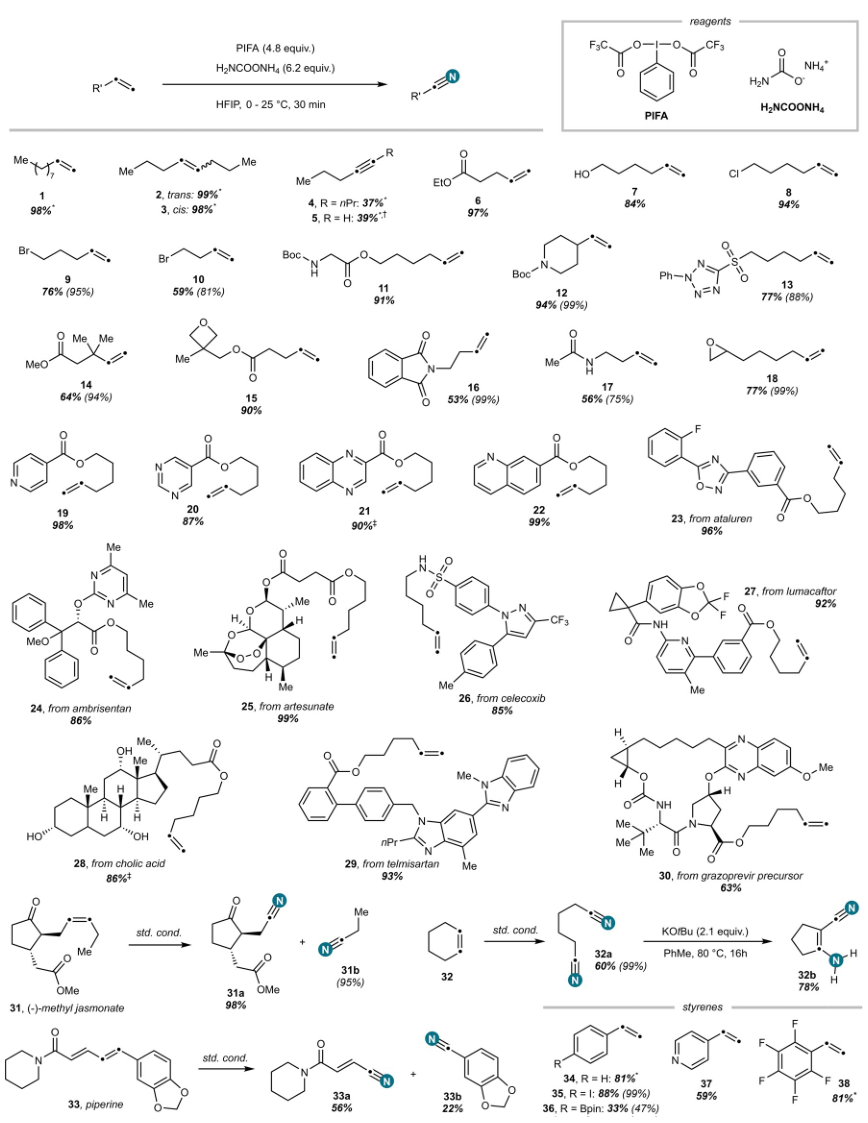
图2. 线性烯烃氧化裂解的底物范围。图片来源:Science
在最优条件下,作者对底物兼容性进行了研究,如图2所示。研究结果表明:1)无论烯烃的立体化学性质如何,对称的内烯烃2和3均能以定量的产率生成氧化裂解产物的两个等价物;2)炔4和炔5也可兼容,以37~39%的产率获得腈产物;3)一系列含有不同官能团的烯烃,如酯基6、羟基7、卤素8-10、Boc保护的胺11和12、缺电子杂环13以及大位阻烯烃等均可反应;4)含有氧乙烷环15、邻苯二甲酸亚胺16、乙酰胺17和环氧化物18的底物均能顺利反应;5)含吡啶19、嘧啶20、喹喔啉21和喹啉22的烯烃都能顺利反应;6)药物相关分子,如阿塔鲁伦(ataluren 23)、安贝生坦(ambrisentan 24)、青蒿琥酯(artesunate 25)、塞来西布(celecoxib 26)、鲁玛卡托(lumacaftor 27)、胆酸(cholic acid 28)、替米沙坦(telmisartan 29)和格拉瑞韦(grazoprevir)前体(30)等衍生的己烯酯,也能顺利反应;7)二维核磁证实(-)-茉莉酮酸甲酯31在完全保留立体化学的情况下反应,得到作为单一非对映异构体的31a;8)胡椒碱33也可反应,以中等产率产生氧化裂解片段,并且对电子含量较低的双键具有完全的区域选择性。其中,由于易于升华,33b的分离产量明显低于33a;9)环己烯32也可兼容,并以定量产率获得工业上相关的己二腈;随后进一步使用化学计量的KOt-Bu作为碱进行Thorpe-Ziegler反应,可在两步内实现环己烯的胺环收缩;10)苯乙烯衍生物,包括苯乙烯34、4-碘苯乙烯35、4-乙烯基频哪醇硼酸酯36、4-乙烯基吡啶37和全氟苯乙烯衍生物38等均可反应。
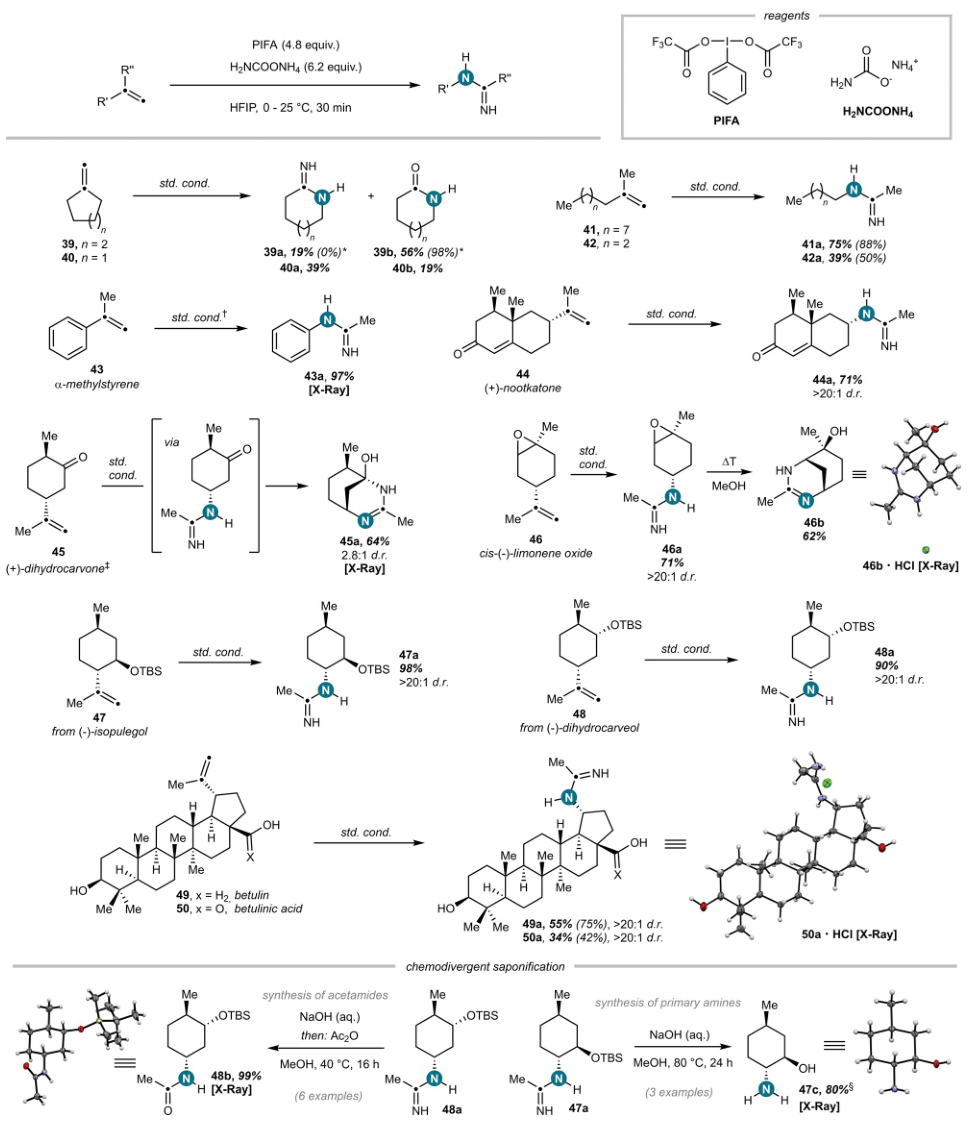
图3. 支链烯烃氧化裂解的底物范围。图片来源:Science
随后,作者在最优条件下对支链烯烃的反应性进行了研究,即以2-甲基十一碳烯41在最佳反应条件下,以88%的NMR产率(0.10 mmol规模)获得N-壬基乙脒,并且未检测到结构异构体,进而表明是完全区域选择性的C-N成键过程(图3)。进一步研究发现:1)亚甲基环己烷39在反应条件下用NMR分析显示完全转化为环脒类物质39a。然而,在水处理和快速柱色谱后以98%的产率获得唯一产物己内酰胺(作者假设环脒在处理和柱色谱过程中完全水解(固定相:SiO2)转化为相应的内酰胺)。然而,通过使用不同的纯化条件(固定相:中性Al2O3),可以部分防止水解,纯化后得到环脒和内酰胺的混合物。亚甲基环戊烷40应用上述相同的方式反应获得2-亚氨基哌啶和戊内酰胺的混合物;2)廉价易得的α-甲基苯乙烯43的反应性,以TFE作为溶剂阻止聚合副反应,从而以高产率获得所需的N-苯基乙脒产物;3)天然来源的萜烯也可反应获得一系列含有萜烯的支链烯烃的脱烯基脒。C(sp3)-C(sp2) σ键的活化具有独特的区域选择性,并且对所有手性底物具有优异的立体保留,可通过X射线衍射和1D或2D NMR光谱的组合来确定。特别的是,该方法在所有的情况下均观察到最小或不可检测的差向异构化,进而表明该过程是有效且立体选择性的C-N成键过程,如(+)-圆柚酮44、(+)-二氢香芹酮45、cis-(-)-柠檬烯氧化物46、硅基保护的(-)-异胡薄荷醇47、(-)-二氢香芹醇48、桦木醇49和桦木酸50等均可反应。与环脒相反,在后处理或柱条件下未观察到叔丁基衍生的脒产物的水解。在温和的皂化条件下,作者通过控制水解相应的脒来获得乙酰胺或伯胺。
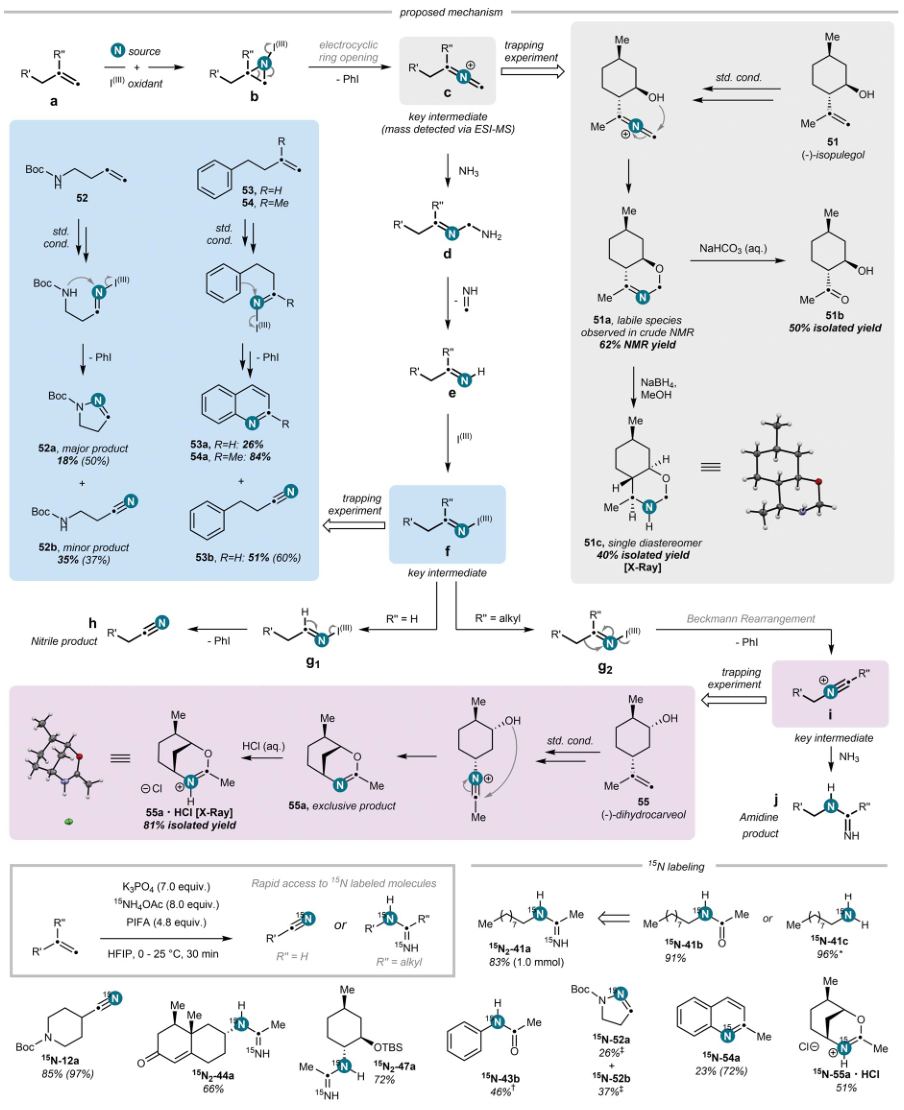
图4. 机理研究和15N标记。图片来源:Science
经过研究,作者提出了初步的反应机理。原位形成的亲电氮物种与未活化烯烃a经形式[2+1]-环加成获得活化的氮杂环丙烷物种b;b经协同的电环化开环和碘苯的解离,将氮原子直接插入底物C(sp2)-C(sp2)双键获得关键的中间氮杂联烯正离子中间体c;c氨解生成半缩醛胺d,d可在质子转移和甲亚胺挤出之后形成亚胺物种e;亚胺e与另一当量的I(III)配位,在R'' = H的情况下逐步氧化成相应的腈h;而在R'' = alkyl的情况下发生贝克曼重排获得阳离子i,i被过量的氨捕获从而得到脒j。其中,作者通过一系列实验对上述过程进行了证明:1)(-)-异胡薄荷醇51的捕获实验证实了氮杂联烯正离子中间体的存在,并得到不稳定的亚胺物种51a(粗混合物的NMR光谱研究)。51a可以成功地水解成51b或还原成51c;2)N-Boc-保护的氨基丁-3-烯(52)反应中分离作为主产物的二氢吡唑52a,进而证实了亲电亚胺中间体f的存在;3)4-苯基丁烯53置于在反应条件下,以60%的NMR产率获得腈产物53b,同时以26%的分离产氯获得喹啉53a,进而表明该过程在形式上遵循分子内亲电芳香取代和氧化顺序;4)α-甲基化类似物54反应时,以优异的产率获得2-甲基喹啉54a。上述结果表明N-亲电亚胺物种可能是反应中的关键中间体。总体而言,贝克曼重排反应具有良好的立体化学信息保留和完全的区域选择性。除了其在机理研究价值外,捕获实验共同表明,该方法也可以用于直接合成相关的N-杂环,如1,3-恶嗪烷、N-取代的4,5-二氢1H-吡唑或喹啉。
最后,作者发现氨基甲酸铵可以被乙酸铵和磷酸钾的组合取代。基于此,作者利用该组合合成各种15N标记的腈(15N-12a、15N-52b)、脒(15N241a、15N2-44a、15N2-47a)及其皂化产物(15N-41b、15N-41c)。同样,利用该方法可以获得各种15N标记的捕获产物(15N-52a、15N-54a、15N-55a•HCl)。
小结
Bill Morandi教授团队通过将氮原子直接插入未活化碳碳双键获得氮杂联烯正离子中间体实现了烯烃的氧化胺化反应,成功构建了一系列腈或脒的产物。此反应操作简便且功能兼容性高,并适用于广泛的未活化烯烃。作为关键试剂,市售且廉价的高价碘氧化剂PIFA在此反应中发挥了重要作用。此外,该方法还可作为合成酰胺和胺类化合物以及15N标记分子的一般策略。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Oxidative amination by nitrogen atom insertion into carbon-carbon double bonds
Yannick Brägger, Ann-Sophie K. Paschke, Nima Nasiri, Bence B. Botlik, Francesco Felician, Bill Morandi*
Science, 2025, 387, 1108-1114. DOI: 10.1126/science.adq4980
导师介绍
Bill Morandi
https://www.x-mol.com/university/faculty/347502
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号