Nano Res.[生物]│宏观至微观–动态水凝胶在眼表弥漫性恶性肿瘤无创滴眼缓释治疗中的应用
本篇文章版权为贾仁兵教授团队 所有,未经授权禁止转载。

背景介绍
结膜黑色素瘤(CoM)是一种广泛影响眼表的高度恶性肿瘤,很难通过手术切尽并可能造成生命危险。滴眼治疗是一种无创辅助治疗,但由于药物利用率低,限制了其在CoM治疗中的临床应用。使用BRAF/MEK抑制剂(BRAF/MEKi)作为模型药物,本研究提出了基于 BRAF/MEK 双靶向脂质体联合动态水凝胶与药物(B/MLDDH)的缓慢释药眼药水,其可以克服泪液冲洗的影响、成功有效地通过眼表递送药物。B/MLDDH将药物包裹在脂双层中,提高药物的生物利用度和生物相容性。乙醛右旋糖酐和质子化壳聚糖为基础的可注射水凝胶体系促进药物在眼表的滞留,发挥持续的脂质体释放,从而显著提高药物的生物利用度。在治疗方面,研究结果显示在CoM的原位小鼠模型上,治疗效果显著增强。鉴于其能够实现疏水性药物的渗透性和长期释放,B/MLDDH可以作为各种药物分子的非侵入性递送平台,从而改善CoM的治疗结果。
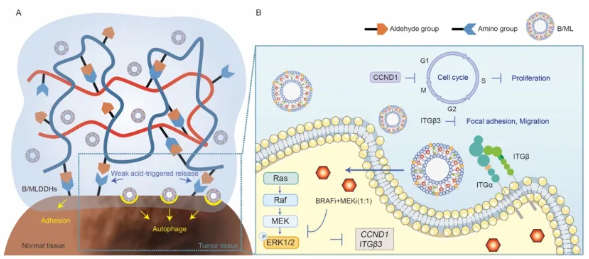
成果简介
BRAF/MEK 抑制剂(BRAF/MEKi)在 CoM 中发挥治疗潜力
在开发纳米药物递送系统之前,我们以BRAF/MEK靶向治疗为例,研究了BRAF/MEKi(Dabrafenib和Trametinib,简称D&T)对眼睑肿瘤的治疗效果。将BRAF/MEKi用于正常黑色素细胞系PIG1后,结果表明,BRAF/MEKi对肿瘤细胞的有效浓度未对正常细胞的增殖产生不良影响,显示出良好的安全性(图1A)。CCK8实验结果显示,D&T在浓度高于5 nM时对眼睑黏膜黑色素瘤(CoM)和皮肤黑色素瘤细胞系均具有治疗性细胞毒作用(图1B,S1A)。集落形成实验进一步表明,5 nM浓度下,D&T显著抑制了CoM细胞系CM2005.1和A375的增殖(图1C,S1B)。此外,两种药物联合使用的治疗效果更优(图1B-C,S1A-B)。伤口愈合实验显示,D&T均可抑制眼睑肿瘤细胞的迁移能力,并且联合应用时疗效更强(图1D-E,S1C-D)。综上所述,BRAF/MEKi对眼睑肿瘤细胞具有细胞毒性作用,能够抑制其生长和迁移,表明其作为辅助靶向治疗的潜力。
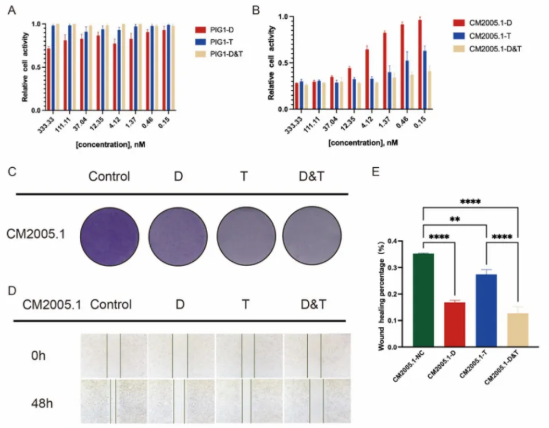
为了进一步探讨BRAF/MEKi抑制CoM和皮肤黑色素瘤增殖及迁移的复杂分子机制,对二甲基亚砜(DMSO)和BRAF/MEKi处理的CM2005.1细胞进行了RNA测序(RNA-seq)。对差异表达基因进行基因本体(GO)分析和京都基因与基因组百科全书(KEGG)分析,结果表明BRAF/MEKi通过阻断细胞周期和细胞黏附(图2A-C),从而抑制肿瘤细胞的增殖和迁移。进一步的基因集富集分析(GSEA)表明,细胞周期和局部黏附途径在BRAF/MEKi处理后显著下调(图2D-E)。
通过对这两条途径中差异基因生成的聚类热图,选择了代表性下调基因Cyclin D1(CCND1)和Integrin β3(ITGβ3)进行验证。CCND1是一种细胞周期调节蛋白,在细胞分裂中发挥关键作用,调控细胞周期转换并促进肿瘤细胞增殖。ITGβ3是一种细胞膜受体,在细胞外基质与细胞内环境之间传递信号,是促进肿瘤黏附、迁移和增殖的癌基因。高通量转录组测序进一步验证了BRAF/MEKi处理的CoM细胞系中CCND1和ITGβ3的表达下降(图2F-G)。
上述研究结果表明,除传统的丝裂原活化蛋白激酶(MAPK)途径外,BRAF/MEKi通过下调CCND1和ITGβ3,协调细胞周期停滞并抑制细胞黏附,从而实现其治疗效果。
BRAF/MEKi的疏水性导致其生物相容性差、生物利用度不足且封装困难,从而限制了其在CoM治疗中的临床应用。为实现BRAFi和MEKi的联合递送并改善其生物相容性和生物利用度,我们采用经典的薄膜水化法设计并合成了脂质体,将BRAF/MEKi封装于脂质双层中,并通过肿瘤细胞靶向的DSPE-PEG2k-cRGD肽对脂质体表面进行修饰,最终获得了名为BRAF/MEKi双靶向脂质体(B/ML)的载药系统(图S2A)。
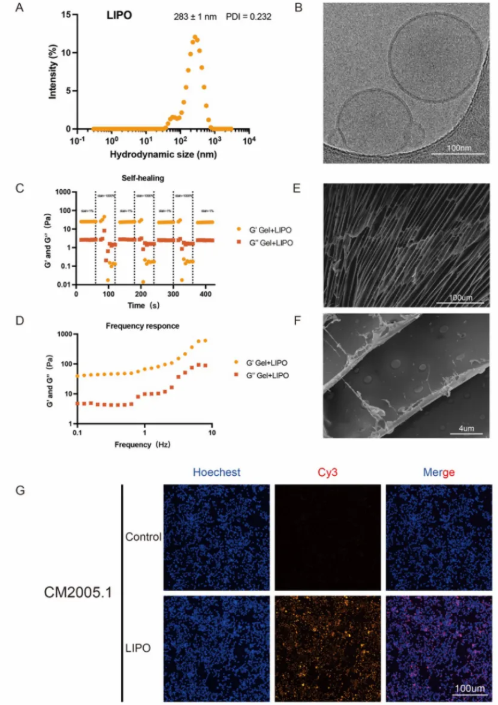
动态光散射(DLS)测试显示,B/ML的水动力学直径为283 ± 1 nm(图3A),且多分散指数(PDI)表明其在PBS中的单分散性良好。冷冻透射电子显微镜(Cryo-TEM)观察发现,B/ML呈均一的球形结构,且粒径与DLS测试结果一致(图3B)。此外,带有和不带RGD修饰的B/ML zeta电位分别为约-3.5 mV和约-6 mV,RGD上的特征基团可能导致了zeta电位的升高,这也间接证明了RGD成功组装到脂质体上(图S2)。
为了验证脂质体是否可以提高跨膜效率和生物利用度,我们使用不含BRAF/MEKi的脂质体(LIPO)封装荧光染料Cy3以监测药物递送过程。将LIPO和等荧光强度的Cy3 PBS溶液分别处理CM2005.1和A375细胞24小时后进行Hoechst染色(图3G,S5)。荧光显微镜检测表明,在554 nm激发下,LIPO组的Cy3荧光信号显著增强,而Cy3 PBS对照组几乎无荧光信号。这表明脂质体封装显著提高了物质的内吞运输效率,同时荧光信号并非源于染料泄漏。上述结果证实,脂质体封装显著改善了药物递送效率,并提高了药物的生物相容性和生物利用度。
通过集落形成实验、细胞凋亡实验和细胞周期实验(图4A-C,S6A-C),B/ML显示出抑制CoM和皮肤黑色素瘤细胞增殖的能力,与D&T组的效果相当(图4A,S6A)。细胞凋亡实验表明,B/ML组的晚期凋亡率高于D&T组(图4B,S6B)。细胞周期实验显示,B/ML和D&T均使肿瘤细胞在G1期停滞(图4C,S6C)。
Western blot结果显示,B/ML处理下磷酸化ERK(pERK)表达下调,同时验证了CCND1和ITGβ3的下调(图4D,S6D)。
总结来说,B/ML成功释放药物,激活相关通路,在增殖抑制、凋亡诱导和细胞周期阻滞方面表现出良好疗效,与D&T组相当。
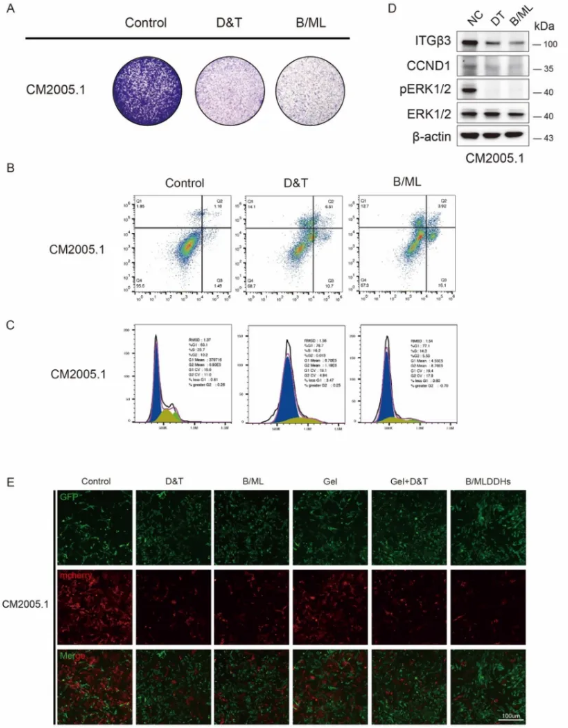
为了克服眼表屏障、增强眼部药物停留时间并实现BRAF/MEKi的持续释放,研究通过将B/ML嵌入可注射水凝胶中合成了B/MLDDHs。具体而言,采用氧化和酸化方法分别制备了醛基葡聚糖和质子化壳聚糖,随后按醛基与氨基的摩尔比1:2混合,确保凝胶形成过程中基团能精准匹配。在30秒内,这种脂质体-壳聚糖溶液与醛基壳聚糖混合后可形成稳定、可注射且形状可调的水凝胶。性能测试表明,水凝胶具有良好的动态网络结构,表现为动态扫描中G'值始终高于G''值,并在经历高应变后能够恢复原有形态。冷冻扫描电子显微镜显示,B/MLDDHs具有规则的层状结构,层间包含光滑的脂质体颗粒,推测是由于凝胶化过程中脂质体的融合导致的。通过共培养实验进一步验证了B/MLDDHs的药物释放与选择性细胞毒性,结果显示B/MLDDHs对CoM和皮肤黑色素瘤细胞具有明显的毒性作用,而对正常黑色素细胞无明显影响。同时,水凝胶的存在并未阻碍药物释放,展现出良好的治疗潜力。
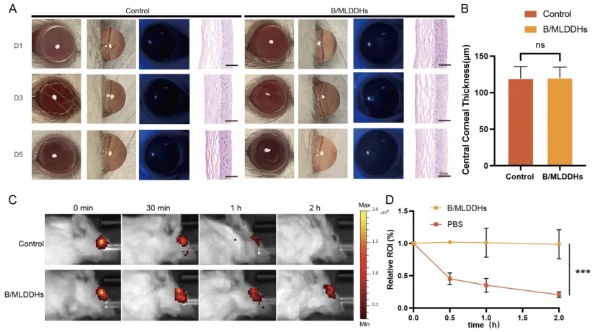
为了验证B/MLDDHs的生物安全性,将实验动物分组后分别滴注B/MLDDHs眼药水,并在连续1、3或5天后观察角膜状态。结果显示,所有B/MLDDHs处理组的角膜均无混浊、炎症或充血现象,同时荧光素染色未见绿色染色,表明角膜上皮完整无损。H&E染色结果进一步证实了角膜的组织结构规则且厚度正常,验证了B/MLDDHs的良好生物相容性。此外,为评估其药物停留性能,采用体内成像系统(IVIS)监测药物在眼表的保留情况。结果显示,与PBS组在2小时内荧光强度下降79.5%相比,B/MLDDHs组在同时间段内仍保留了98.74%的荧光,显著延长了药物在眼表的停留时间。这表明B/MLDDHs作为眼表药物递送载体,能够延长药物的停留和渗透时间,特别适用于眼表恶性肿瘤的长期治疗需求。
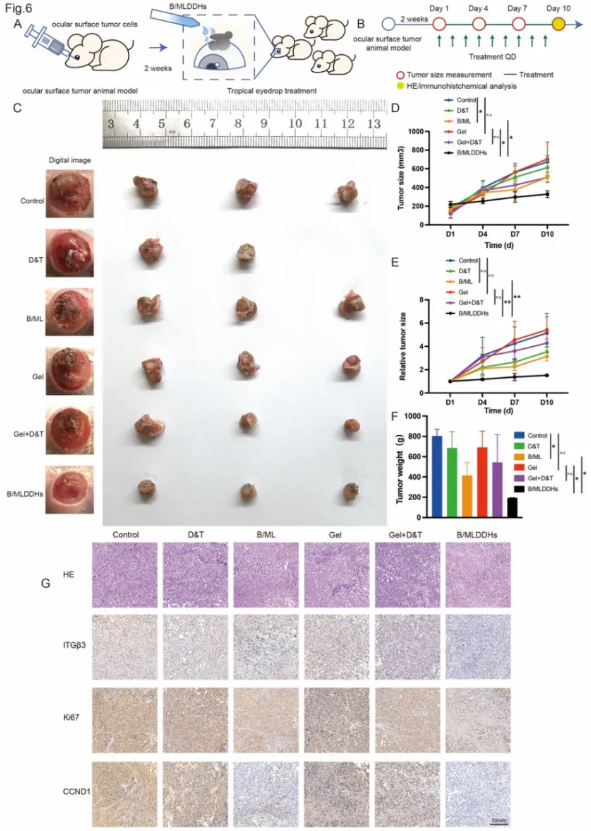
为了全面评估B/MLDDHs的体内抗肿瘤效果,研究通过将CM2005.1细胞注射到高度血管化的结膜基质中,建立了CoM原位模型。两周后,小鼠被随机分为几个组别:对照组(PBS)、Gel组(不含B/ML的水凝胶)、D&T组(5 nM Dabrafenib和5 nM Trametinib)、Gel+D&T组(嵌入等量D&T的水凝胶)、B/ML组和B/MLDDHs组(均为等量D&T)。每组小鼠连续9天非侵入性滴眼处理20μl的相关成分。由于D&T组的肿瘤进展较为侵袭,导致小鼠在9天治疗前死亡,因此未能得出该组的统计学结论。
成像结果显示,B/MLDDHs组肿瘤负担显著减轻,肿瘤生长速度较慢。与其他组相比,B/MLDDHs组的眼球外观显示出肿瘤进展的异质性最小。肿瘤大小、相对肿瘤大小和肿瘤重量的量化数据显示,B/MLDDHs组治疗效果显著优于其他组。根据肿瘤大小和肿瘤重量的量化结果,直接在眼表应用BRAF/MEKi水凝胶形式(Gel+D&T组)未能表现出疗效,而脂质体载药形式(B/ML组)则有效减小了肿瘤大小,突出了脂质体封装BRAF/MEKi的重要性。B/MLDDHs组相比B/ML组在抑制增殖方面具有更强的效果,表明水凝胶封装提高了B/ML的细胞毒性和生物利用度。相对肿瘤大小的数据表明,只有B/MLDDHs组达到了统计学显著治疗效果,证明了B/MLDDHs在CoM中的临床价值。为更好地观察眼内病理变化,使用了H&E、Ki67、CCND1和ITGβ3免疫组化染色。H&E和Ki67染色显示PBS组和Gel组肿瘤细胞增殖和形态学异常明显,而BRAF/MEKi单药或联合水凝胶的治疗未能有效改变组织学表型(D&T组和Gel+D&T组)。然而,在B/ML组和B/MLDDHs组中,细胞形态和排列趋向正常,Ki67表达减少,提示增殖受到抑制。这个趋势在B/MLDDHs组中更为显著,表明B/MLDDHs滴眼治疗在生物利用度和抗肿瘤效果方面具有显著优势。CCND1和ITGβ3的表达与Ki67表现出相似的变化模式,在对照组中高度表达,在D&T组和Gel+D&T组中轻度下调,在B/ML组和B/MLDDHs组中显著降低。B/MLDDHs组CCND1和ITGβ3的抑制最为明显,进一步强调了B/MLDDHs滴眼治疗能够获得显著的药理学效果。总之,局部滴用B/MLDDHs眼药水在CoM原位模型中有效达到了杀伤肿瘤的目的。
作者简介


文章信息

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号