“强强联合”:增强万古霉素活性的新策略
副标题:万古霉素-泰斯巴汀偶联物
人类与致病菌之间的斗争延续了无尽岁月。在青霉素发明之前,人类基本处于“躺倒挨锤”的弱势境地,但青霉素大规模应用之后致病菌也升级了自己的“武器库”,进化出针对青霉素这种β-内酰胺类抗生素的防御机制,人类科学家不得不再努力开发出新的抗生素,致病菌再进化……如此双方各显神通,这场残酷的“军备竞赛”一直延续至今。研究显示,1990年至2021年间,每年有超过百万人死于耐药菌感染。一些多重耐药菌株更被称为“超级细菌”,目前没有任何有效的药物可以高效地杀死它们。改进现有抗生素的疗效,开发具有全新抑菌机制的新抗生素以及抗菌疗法,已经迫在眉睫。
自1958年万古霉素(Vancomycin)临床应用以来,它一直是治疗多重耐药革兰氏阳性病原菌的“最后一道防线”。万古霉素通过结合细菌细胞壁合成过程中的关键分子——lipid II的D-丙氨酰-D-丙氨酸(D-Ala-D-Ala)部分,从而抑制细胞壁的生物合成,导致细菌死亡。然而,随着万古霉素耐药菌的出现,如万古霉素耐药肠球菌(VRE)和万古霉素耐药金黄色葡萄球菌(VRSA),这一防线正面临前所未有的挑战。在细菌耐药机制中,一个常见策略是改变万古霉素的靶点结构。例如,VRE通过将D-Ala-D-Ala替换为D-丙氨酰-D-乳酸(D-Ala-D-Lac),从而破坏了万古霉素与lipid II之间结合的关键氢键,导致万古霉素的亲和力降低至此前的千分之一。近年来,泰斯巴汀(Teixobactin)作为一种新型抗生素,引起了科学界的广泛关注。泰斯巴汀是一种由11个氨基酸组成的环缩肽,它通过结合lipid II的焦磷酸基团,抑制细胞壁的生物合成并最终导致细菌裂解。由于泰斯巴汀针对的是lipid II的焦磷酸基团,这是一个在细菌中高度保守的靶点,因此革兰氏阳性细菌几乎无法对其产生耐药性。泰斯巴汀对包括耐甲氧西林金黄色葡萄球菌(MRSA)、VRE和肺炎链球菌在内的多种革兰氏阳性细菌展现出强大的抗菌活性,最低抑菌浓度(MIC)低至0.005-0.5 μg/mL。尽管泰斯巴汀具有强大的抗菌活性,但其临床应用仍面临一些挑战。例如,泰斯巴汀的生产成本较高,且其稳定性有待进一步提高。因此,研究人员开始探索将泰斯巴汀与其他抗生素结合的策略,以期在保持或提高抗菌活性的同时,克服单一抗生素的局限性。
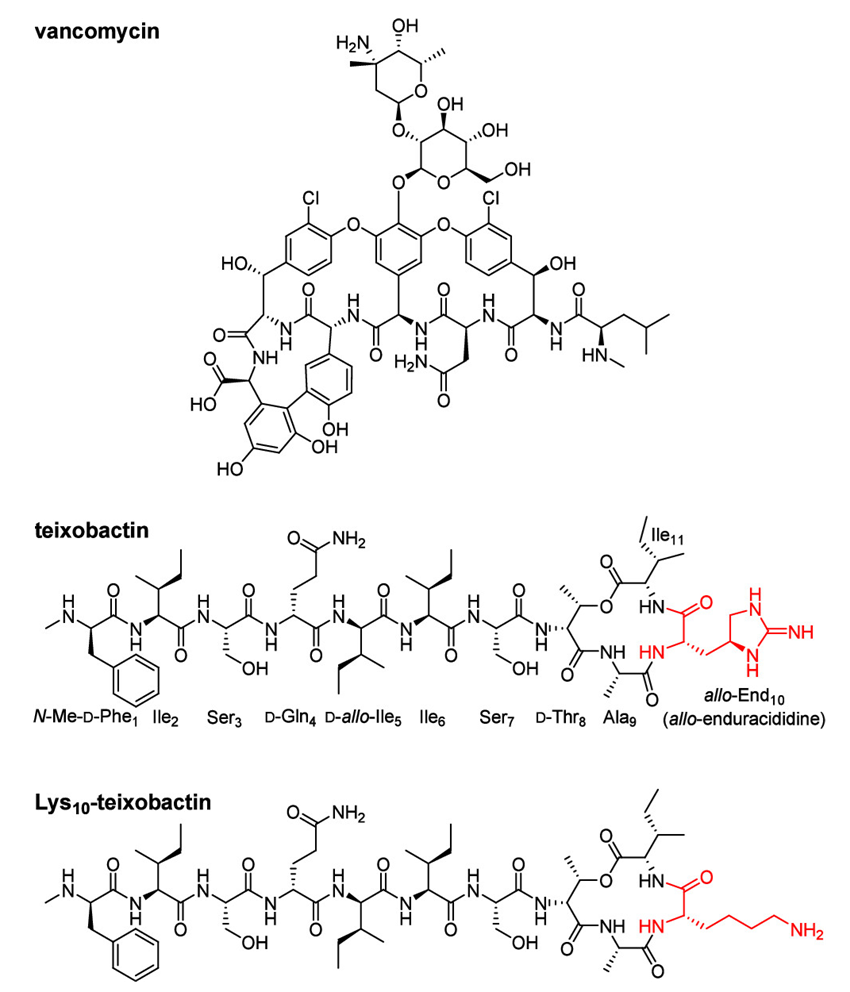
万古霉素、泰斯巴汀和Lys10-泰斯巴汀的结构。图片来源:JACS
近日,美国加州大学尔湾分校的James S. Nowick教授课题组在J. Am. Chem. Soc.发表论文,报道了一种万古霉素-泰斯巴汀偶联物,对多种耐药菌以及耐万古霉素菌有很好的活性。这项研究的关键在于将万古霉素与针对同一靶点(lipid II)但不同区域的第二种抗生素(即泰斯巴汀)结合起来。其中,万古霉素与泰斯巴汀最小药效团(其残基1-6被芳香酰胺取代)的偶联物,活性比两种成分单独及混合使用要显著增强。所得到的三种偶联物对MRSA的MIC为0.5 μg/mL,对甲氧西林敏感金黄色葡萄球菌(MSSA)的MIC为0.063 ~ 0.125 μg/mL,而且每一种都对VRE有活性,其中活性最高偶联物(Cbp-Lys10-teixo7–11-vanco)的MIC为2-4 μg/mL。这些发现表明,万古霉素结合泰斯巴汀最小药效团策略相当有效,可以提高万古霉素对一些重要的革兰氏阳性病菌的抗菌活性。
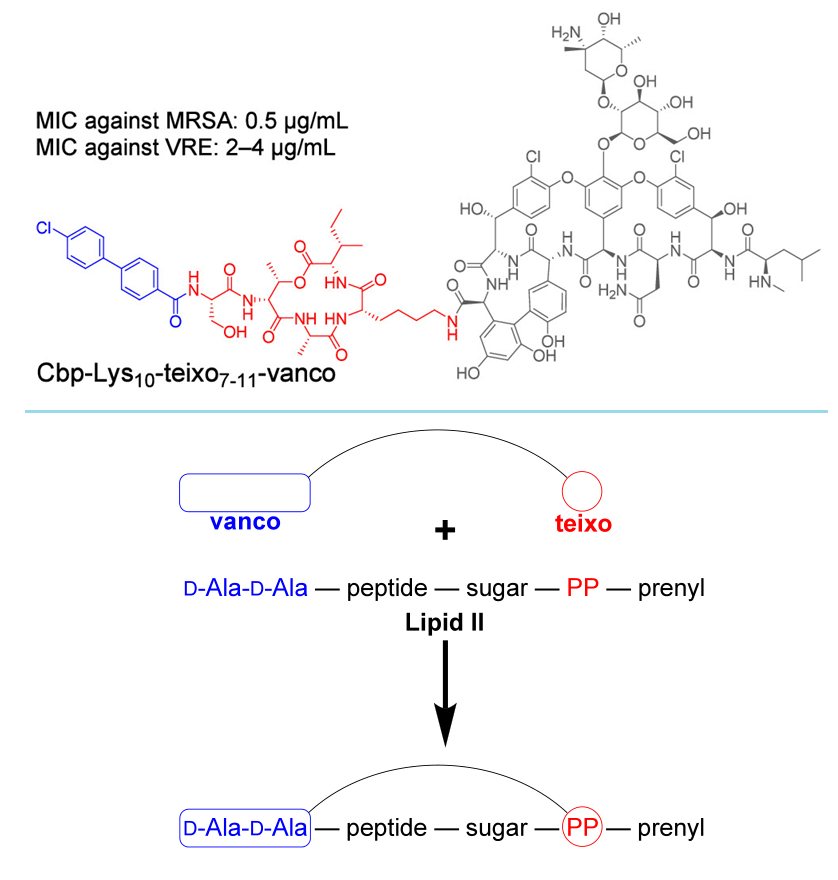
万古霉素-泰斯巴汀偶联物及作用机制示意图。图片来源:JACS
研究团队首先通过EDC偶联反应,将万古霉素与Lys10-泰斯巴汀偶联,合成了Lys10-teixo-vanco。随后,他们通过MIC测定,评估了Lys10-teixo-vanco对一系列革兰氏阳性细菌的抗菌活性。结果显示,Lys10-teixo-vanco对MRSA和VRE的MIC分别为4 μg/mL,这一活性显著高于单独使用万古霉素或Lys10-泰斯巴汀时的活性。此外,Lys10-teixo-vanco的活性也高于等量的万古霉素和Lys10-泰斯巴汀混合物,表明偶联反应而非简单混合是实现抗菌活性增强的关键。
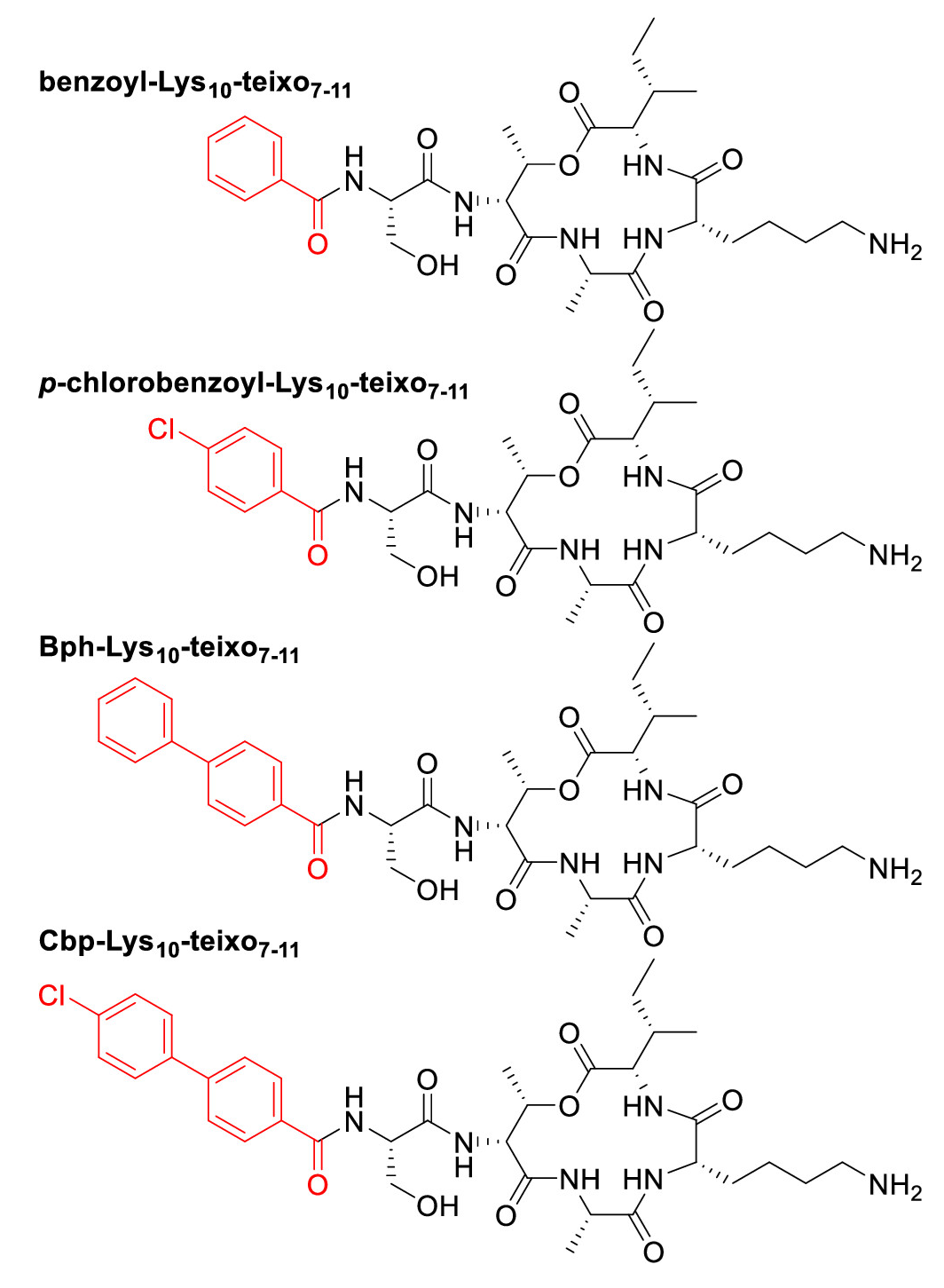
Lys10-泰斯巴汀截短类似物的结构。图片来源:JACS
有意思的是,万古霉素与全长Lys10-泰斯巴汀偶联,活性增强程度只能说尚可,这让研究团队猜测——与小一些的泰斯巴汀药效团偶联会不会效果更佳?于是,他们将万古霉素偶联到一系列基于泰斯巴汀最小药效团的截短类似物,包括benzoyl-Lys10-teixobactin7−11、p-chlorobenzoyl-Lys10-teixobactin7−11及其联苯类似物Bph-Lys10-teixobactin7−11、Cbp-Lys10-teixobactin7−11。这些截短类似物中,泰斯巴汀的疏水尾部(残基1-6)替换为芳香族或氯芳香族亲脂基团,旨在通过增强与细菌细胞膜的相互作用,提高偶联物的抗菌活性。研究团队评估了它们的抗菌活性,结果显示,与万古霉素相比,benzoyl-Lys10-teixo7−11-vanco对MSSA和枯草芽孢杆菌(Bacillus subtilis)的抗菌活性有所提高,但对MRSA和表皮葡萄球菌(Staphylococcus epidermidis)的活性与万古霉素相当。此外,该偶联物对VRE也表现出一定的抗菌活性,尽管其活性相对较弱。p-chlorobenzoyl-Lys10-teixo7−11-vanco、Bph-Lys10-teixo7−11-vanco和Cbp-Lys10-teixo7−11-vanco则表现出更为显著的抗菌活性增强。这些偶联物对MSSA、MRSA和VRE的MIC均低于万古霉素,特别是对VRE的活性提高尤为显著。其中,Cbp-Lys10-teixo7−11-vanco对VRE的MIC低至2-4 μg/mL,显示出最强的抗菌活性。

抑菌活性。图片来源:JACS
为了评估Cbp-Lys10-teixo7−11-vanco的杀菌效果,研究团队进行了时间杀伤实验。结果显示,在1 μg/mL(MIC的两倍)的浓度下,Cbp-Lys10-teixo7−11-vanco能在4小时内将MRSA的菌落形成单位(CFU)减少约三个数量级,而相同浓度的万古霉素则无法有效抑制MRSA的生长。此外,研究团队还评估了这些偶联物对人红细胞和HEK-293细胞的溶血活性和细胞毒性。结果显示,它们在较高浓度下仍表现出较低的溶血活性和细胞毒性。特别是Cbp-Lys10-teixo7−11-vanco,在100 μg/mL的浓度下仅表现出轻微的溶血活性(4%),且在30 μg/mL的浓度下仅表现出轻微的细胞毒性。这些结果表明,这些偶联物在抗菌活性与安全性之间取得了良好的平衡。
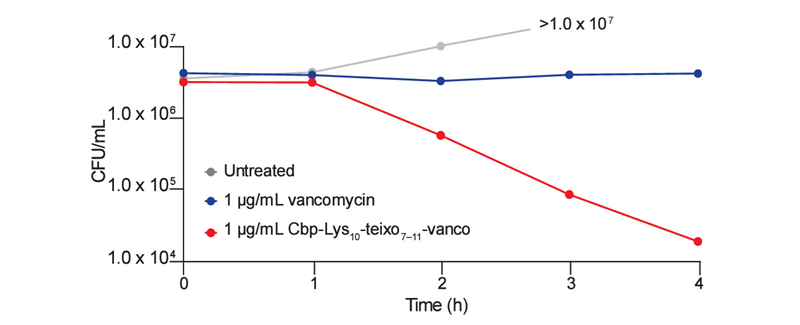
时间杀伤实验。图片来源:JACS
研究团队还探讨了这些偶联物可能的作用机制。他们认为,万古霉素与泰斯巴汀或其最小药效团的偶联,使得偶联物能够同时结合lipid II的D-Ala-D-Ala和焦磷酸基团。尽管VRE中的D-Ala-D-Ala被替换为D-Ala-D-Lac,导致万古霉素结合亲和力降低,但偶联物中的泰斯巴汀部分仍然能够结合焦磷酸基团,并通过与细菌细胞膜的相互作用增强万古霉素的渗透性,从而恢复或增强其抗菌活性。此外,研究团队还推测,这些偶联物也可能通过与两个不同的lipid II分子相互作用来发挥其抗菌活性。
总结
本研究通过将两种针对lipid II靶点不同区域的抗生素偶联起来,通过协同作用增强抗菌活性。这种策略不仅为克服细菌耐药性提供了新的思路,也为开发新型抗生素提供了有力的工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Vancomycin–Teixobactin Conjugates
Maria Sophia Teresa Lee Padilla, and James S. Nowick*
J. Am. Chem. Soc., 2025, DOI: 10.1021/jacs.4c17175
(本文由甘棠供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




































 京公网安备 11010802027423号
京公网安备 11010802027423号