江苏科技大学唐盛教授组Adv Mater:人造细胞内嵌碳纳米管以增强探针的传输
细胞间的信号传感、传输和交流是推动建立分析化学新方法的前沿关键技术,其挑战在于跨膜阻碍和干扰限制了传感探针的跨膜传输。体液中生物基质的复杂性往往导致信号分子(如探针)的干扰、失活和扰动。因此,迫切需要开发新的分析方法,能够在复杂的生理环境中检测生物标志物,同时有效地保护信号探针免受基质诱导的干扰。基于脂质体的人造细胞(ArtifCell)成为生物传感和药物递送的强大载体,因其模拟生物膜等可控结构特征,为信号探针的封装、保护和传输提供通用平台,备受关注。但靶细胞与ArtifCell间融合效率受细胞膜通透性等因素限制,影响传感传输效率。为促进高效细胞-细胞分子转移或膜融合,使信号探针快速进入细胞,碳纳米管(CNTs)可作为人工通道,促进更快的化学反应和具有更强的分子相互作用势能。然而,以CNTs作为分子通道,用于传感目的离子转移过程以及将传感探针从ArtifCell传输到真实细胞的研究尝试仍然是一个研究盲点。
近日,江苏科技大学环境与化学工程学院唐盛教授(点击查看介绍)课题组在Advanced Materials 上发表研究论文,首次以CNTs作为人工通道用于增强细胞间分析化学信号探针的转导和传递。该论文第一作者为硕士研究生吴俊雯,通讯作者为沈薇教授、李贤基教授、唐盛教授。
本研究中,作者构建了基于人造细胞的信号探针传递增强传感策略,巧妙地将CNTs嵌入脂质膜(ArtifCell@CNTs),其独特性能可作为人工信号传输通道,促进细胞间信号探针传输与传递。CNTs的嵌入增强了ArtifCell和靶细胞之间的探针传输,细胞融合过程加快,离子和信号的传递增强。该传输过程符合动力学一级和二级反应模型。分子模拟数据显示,ArtifCell@CNTs势能随时间推移逐渐变弱,ArtifCell@CNTs与细胞之间的离子交换率提高。研究团队利用该传感器作为microRNA传感工具,验证了直接准确定量检测真实血清样本中let-7a的能力。该ArtifCell@CNTs策略巧妙地解决了信号分子和离子从溶液传递到细胞的挑战,使活细胞中靶标的快速检测和可视化成为可能。这些发现推动了传感分析技术在分子层面的革新,为人造细胞在复杂生理研究中的生物分析和生物传感成像开辟了潜在的应用。
在本研究中,作者首先利用该微流控装置构建了ArtifCell@CNTs生物传感器系统。由于传感策略通常存在细胞膜通透性低的问题,为了增加探针在细胞间的传输和通讯能力,作者将CNTs作为一种高度生物相容性的人工通道,嵌入到ArtifCell细胞膜中,以提高其通透性。核酸探针和荧光染料被包裹在ArtifCell@CNTs内,以确保对传感探针的保护,并促进microRNA靶标的生物学检测。当ArtifCell@CNTs靠近含有目标microRNA (let-7a) 的细胞时,嵌入的CNTs作为离子传输的人工通道,加速了细胞融合和物质交换(图1)。核酸传感探针经由CNTs人工通道穿过细胞膜,与靶标let-7a结合,形成基于Mg2+的DNAzyme。由于Mg2+和K+离子可以从基于CNTs的人工离子通道快速导入细胞,因此Mg2+离子可以快速识别融合细胞中的DNAzyme,产生荧光信号用于细胞内的靶标分析与传感,提供了一种高效的基于ArtifCell@CNTs的传感器。
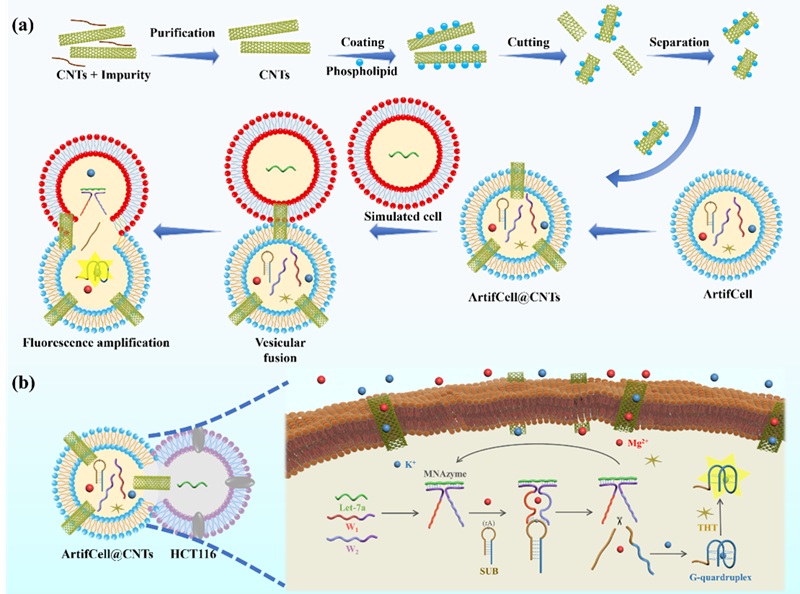
图1. 基于ArtifCell@CNTs的探针传输增强传感策略过程及原理。
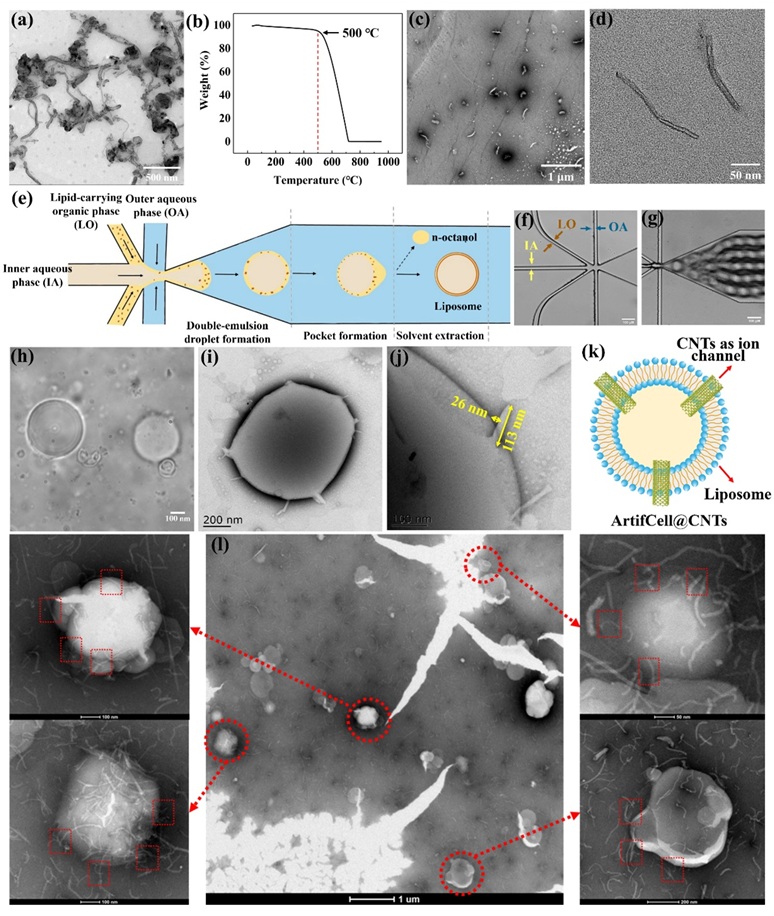
图2. CNTs和ArtifCell@CNTs的制备和表征。
作者通过高分辨率透射电子显微镜(HRTEM)成功表征出ArtifCell@CNTs表面嵌入的多个CNTs,且CNTs嵌入在人工细胞膜的边缘。该论文从微观层面表征了CNTs插入ArtifCell的细节图,并分析了CNTs浓度的影响。
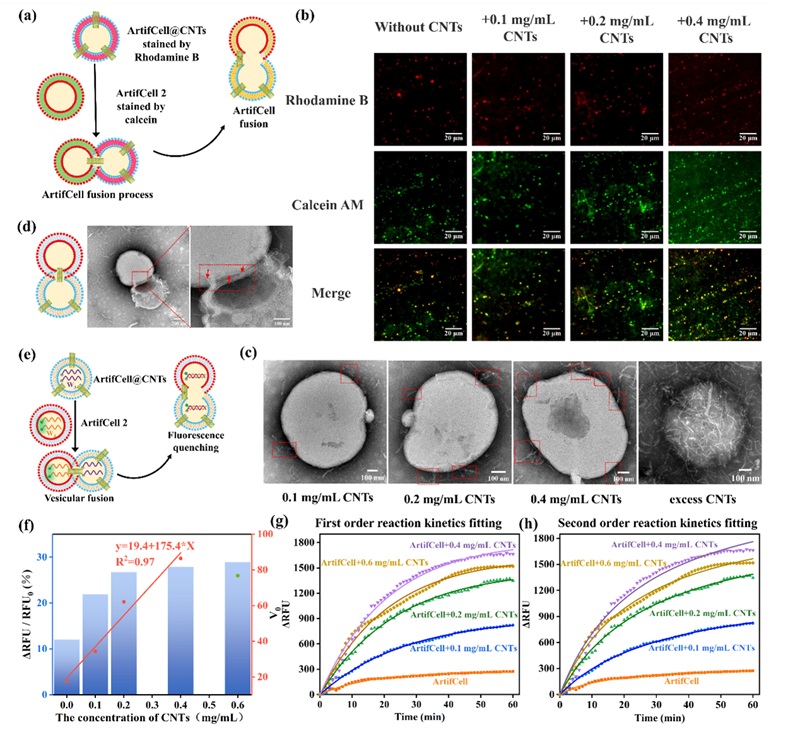
图3. ArtifCell@CNTs与人造细胞的融合过程表征。
为了评估ArtifCell@CNTs的融合和探针传输能力,作者在全内反射显微镜下观察融合过程(图3)。并对该过程荧光变化的动力学曲线进行了分析拟合(图3g和图3h),发现动力学曲线既符合一级反应动力学曲线,也符合二级反应动力学曲线。表明融合过程是由一个复杂的过程加速的类似于吸附过程,物理吸附和化学吸附在系统中同时发生。
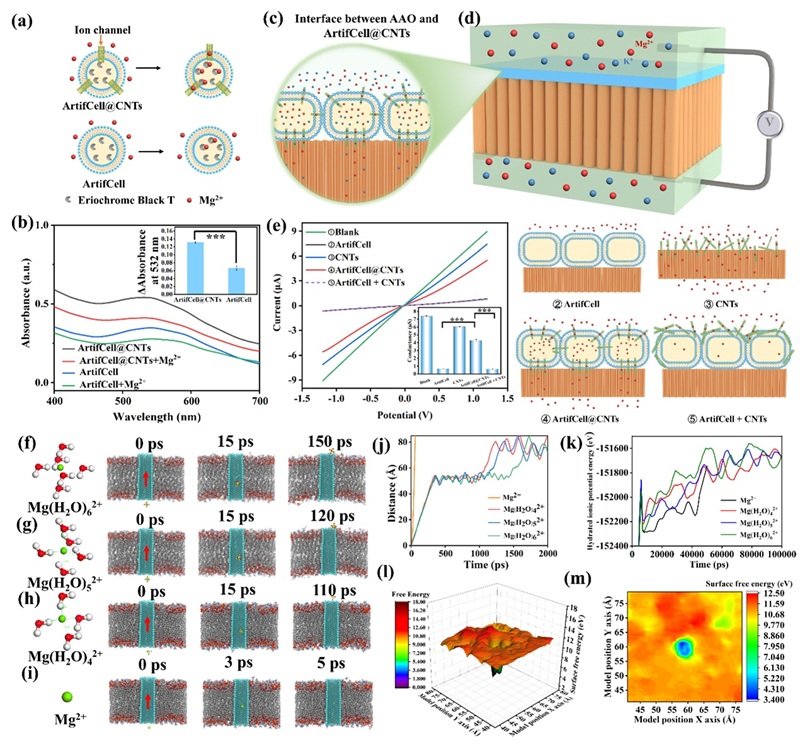
图4. ArtifCell@CNTs用于加速离子传输的过程表征。
由于很难直接监测离子从脂质体外部到内部的运动,作者使用I-V曲线和分子动力学模拟研究了Mg2+在CNTs中的运动。并分别研究了游离离子或水合离子在ArtifCell@CNTs体系中的膜穿透过程。
小结
本论文设计了一种信号探针传递增强传感策略,构建以脂质体为基础的ArtifCell对核酸、金属离子和荧光染料等信号探针进行保护。碳纳米管被包埋在人工细胞膜上,并作为人工通道用于增强细胞间信号探针的传输。该策略促进了高效的细胞-细胞融合和分子探针的传输,有望推动生物分子传感技术的快速发展和生物标志物的快速监测与诊断技术的发展。
近年来,唐盛教授课题组在分析化学与生物材料方向取得突破,相关成果发表在Adv. Mater.、Adv. Funct. Mater.、Adv. Sci.、Anal. Chem.等期刊。研究得到国家自然科学基金等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Embedding Carbon Nanotubes in Artificial Cells Enhances Probe Transfer
Junwen Wu, Xuemin Zeng, Lina Wang, Jinghui Zhang, Shuhua Cui, Zixiao Ma, Ruirong Pan, Chang Liu, Dezhao Kong, Juan Song, Lei Liu, Chunying Feng, Wei Shen, Xiaocen Suo, Zixia Lin, Hian Kee Lee, Sheng Tang
Adv. Mater., 2025, DOI: 10.1002/adma.202418271
导师介绍
唐盛
https://www.x-mol.com/university/faculty/67654
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号