南开大学周其林团队JACS:光诱导铜催化C(sp³)–H键与羧酸的不对称氧化偶联反应
C(sp3)–H键的直接对映选择性官能化反应具有高原子经济性和步骤经济性,将从根本上改变手性分子的合成方法。通过对映选择性氧化,可以直接在烷烃中引入含氧官能团,为新药开发提供了的新工具。手性醇和酯因其在天然产品、药品和精细化学品中的广泛应用,一直是有机合成化学的研究热点。近年来,通过过渡金属催化C(sp3)–H键对映选择性官能化的方法构筑C–C和C–N键的研究已取得显著进展。然而,通过C(sp3)–H键的直接氧化对映选择性地构筑C–O键仍面临挑战。
最近,南开大学周其林(点击查看介绍)团队开发了一种离子型铜催化剂,结合可见光协同催化策略,实现了C(sp3)–H键与羧酸的高对映选择性氧化偶联反应。这一方法不仅适用于烯丙位和炔丙位C(sp3)–H键,还能适用于各种羧酸偶联试剂。利用该策略,可以从烯烃和炔烃出发,直接合成一系列手性酯,极大简化了手性酯及相应醇的合成。
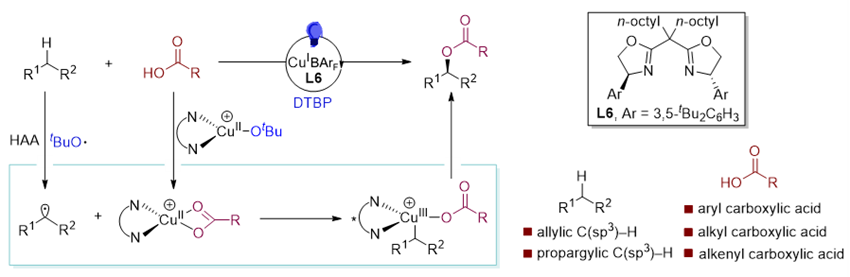
图1. C(sp3)–H键与羧酸不对称氧化偶联反应。图片来源:J. Am. Chem. Soc.
经过系统的条件优化,作者发现在光照条件下,使用具有较大位阻的BArF⁻作为抗衡阴离子的手性铜催化剂能够高效高对映选择性地促进反应。使用这种离子型手性铜催化剂,作者对反应的适用范围进行了详细研究。在所测试的烯烃系列中,无论是延长或缩短烷基链的烯烃,还是邻位有位阻或含有酯基、卤素等官能团的烯烃,反应均展示出了优异的收率和对映选择性。值得一提的是,该反应体系能够适用于包括芳基、烷基及烯基羧酸在内的多种羧酸底物。研究团队进一步将反应扩展到了炔烃与羧酸的对映选择性氧化偶联反应,多种具有不同取代基的芳基炔和杂芳基炔均表现出良好的产率和高对映选择性。此外,脂肪族羧酸和不饱和羧酸也能实现与炔烃C(sp3)–H键的对映选择性偶联反应。
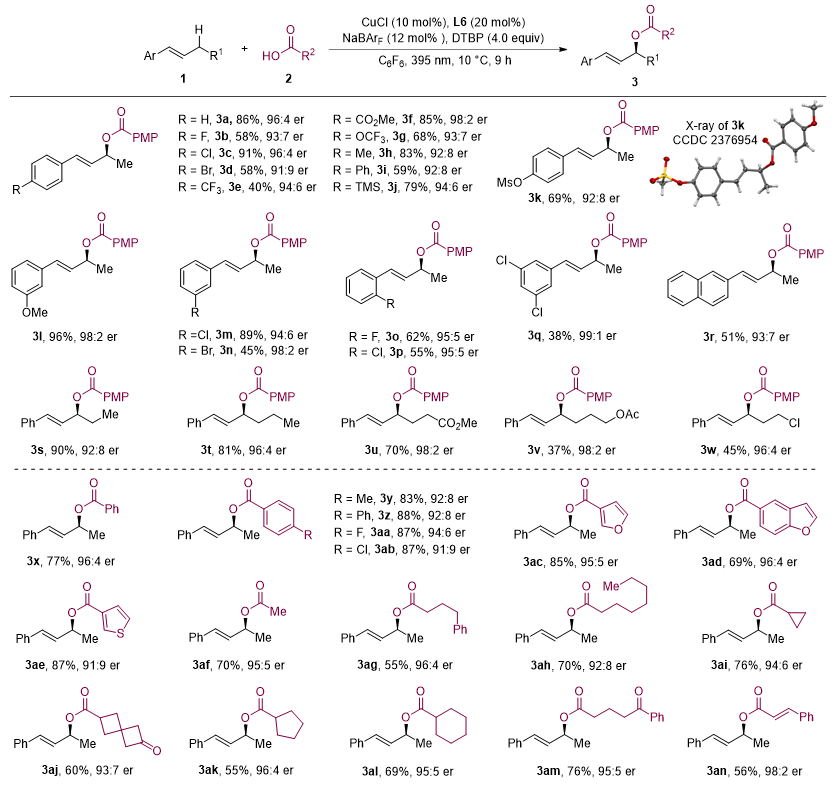
图2. 烯烃与羧酸不对称氧化偶联反应底物范围。图片来源:J. Am. Chem. Soc.
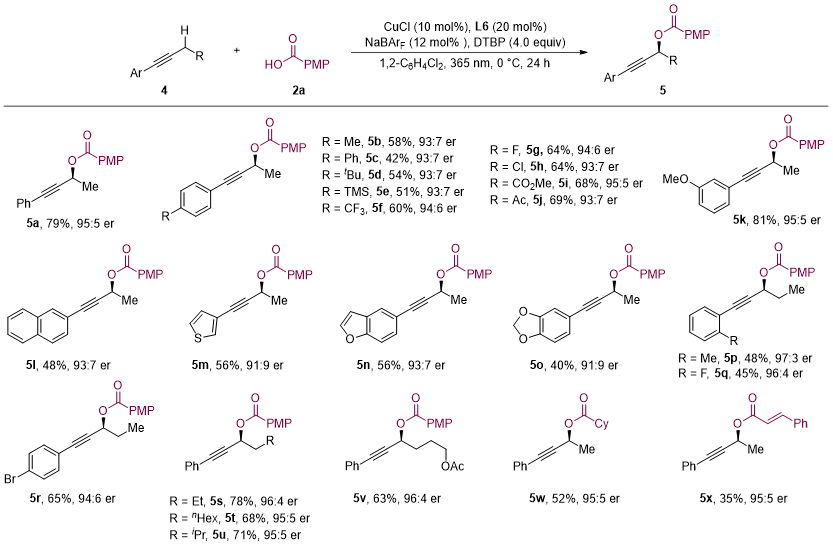
图3. 炔烃与羧酸不对称氧化偶联反应底物范围。图片来源:J. Am. Chem. Soc.
为了展示他们开发的方法在有机合成中的潜在应用,作者将此反应应用于生物活性分子的衍生化。通过这些示例,展现了从烯烃和炔烃直接合成手性酯的实用性,以及其在生物活性分子后期结构修饰中的应用价值。

图4. 生物活性分子后期修饰。图片来源:J. Am. Chem. Soc.
为了阐明C(sp3)-H键与羧酸氧化偶联的反应机理,作者利用2,2,6,6-四甲基哌啶氮氧化物(TEMPO)进行了自由基捕获实验。TEMPO对反应的抑制效果表明自由基参与了反应过程。通过动力学同位素效应实验发现,这两种反应的kH/kD比值分别为3.1和3.3,表明C(sp3)-H键的氢原子解离可能是速率决定步骤。使用预先制备的中间体CuII-OtBu和CuII-OBz(分别记为Int-I和Int-II)催化反应,成功获得了目标产物,从而证实了反应过程中形成了这些中间体。通过一系列电子顺磁共振(EPR)测量,证明反应中的自由基及中间体Int-I和Int-II的存在。此外,原位制备的催化剂EPR光谱测定也显示了Cu(II)中间体的存在。值得注意的是,作者在10 K条件下通过平行模式的EPR光谱实验检测到了典型的S = 1信号,并对此信号进行了详细拟合。结果表明,这个S = 1信号可能来源于Cu(III)中间体。作者还通过EPR分析确认了叔丁氧自由基主要由DTBP的光解产生。最后,通过开关灯实验确认,反应并非通过自由基链式反应机制进行。
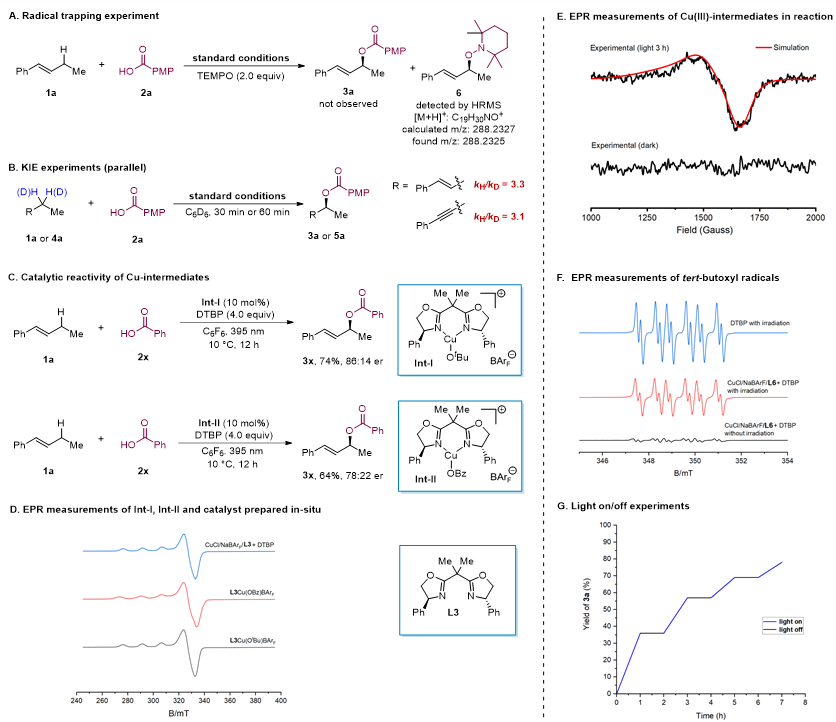
图5. 机理研究。图片来源:J. Am. Chem. Soc.
为了进一步深入研究反应机理,作者还进行了密度泛函理论(DFT)计算。首先,Cu(I)络合物与光分解DTBP产生的叔丁氧自由基反应,形成中间体Int-I;接着,该中间体与羧酸发生配体交换,生成中间体Int-II。随后,由叔丁氧自由基攫氢产生的烯丙基自由基与中间体Int-II反应得到关键的Cu(III)中间体Int-III。进一步该中间体通过外球模式还原消除,形成C-O键,得到中间体Int-IV。随后,中间体Int-IV解离生成目标产物。整个反应过程,生成烯丙基自由基需要克服9.8 kcal/mol的能垒,这一步骤是整个机理中的速率控制步骤,符合动力学同位素效应的实验结果。当使用L6配体时,过渡态TS-R-allylic-RA和TS-S-benzylic-RA的能量分别比TS-S-allylic-RA高出3.9和5.8 kcal/mol,计算所得的对映选择性和区域选择性与实验结果一致。DFT模拟还阐释了BArF–作为抗衡阴离子在Cu(I)中心形成空配位的重要性;如果Cu(I)中心被Cl–占据,则会显著提高整体反应的能垒,导致反应收率下降。
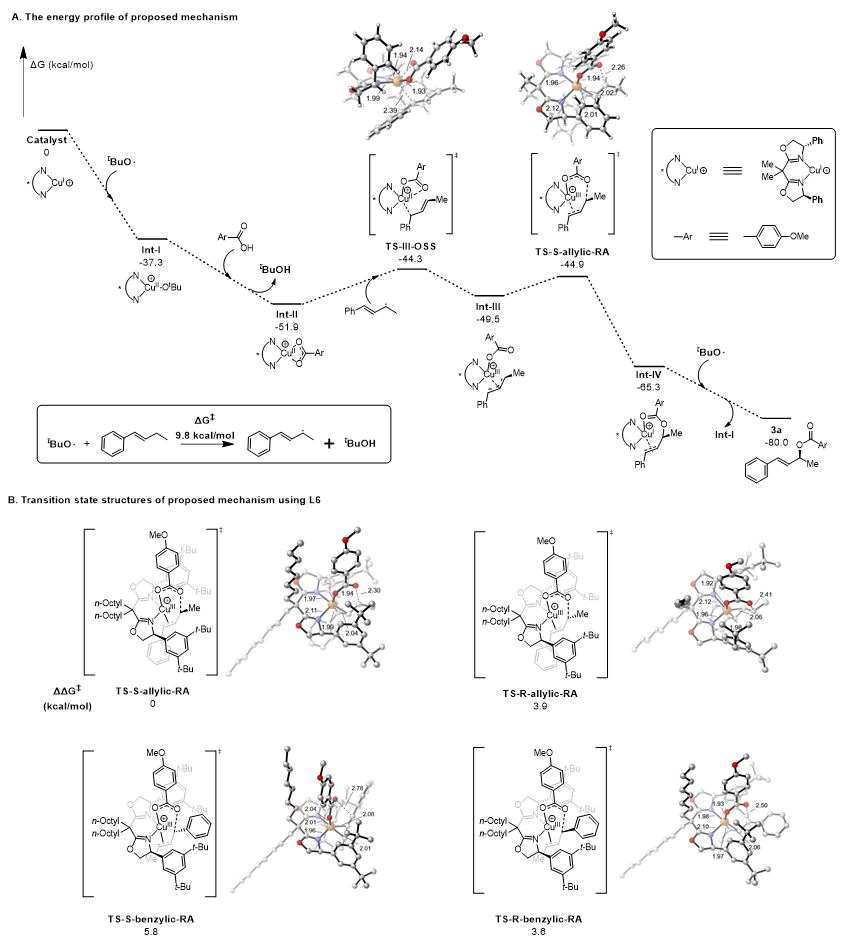
图6. DFT计算。图片来源:J. Am. Chem. Soc.
综上,周其林团队开发出了一种光诱导的阳离子铜催化剂,成功实现了烯丙位和炔丙位的C(sp3)–H键与羧酸的不对称氧化偶联反应。这一策略打破了传统Kharasch反应的底物限制,不仅将C(sp3)–H键不对称氧化反应的范围扩展到了开链烯烃和炔烃,还克服了传统反应中必须使用过氧酸酯作为氧化和偶联试剂的局限。该方法直接使用常见的烯烃、炔烃和羧酸底物,合成了多种手性烯丙酯和炔丙酯,为手性化合物的合成提供了新的途径。
该研究工作的部分结果先发布于预印本平台上ChemRxiv(DOI: 10.26434/chemrxiv-2024-6k7n9; DOI: 10.26434/chemrxiv-2024-hqqb0),近期正式发表在J. Am. Chem. Soc.上。文章通讯作者为南开大学周其林教授、肖力军研究员和上海有机所薛小松研究员,南开大学博士研究生刘贤明和李府为共同第一作者。该项工作得到了国家自然科学基金和国家重点研发计划的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Asymmetric Oxidative Coupling Between C(sp3)–H Bonds and Carboxylic Acids
Xian-Ming Liu,# Fu Li,# Tongkun Wang, Ling Dai, Yin Yang, Neng-Quan Jiang, Li-Yuan Xue, Jing-Yuan Liu, Xiao-Song Xue,* Li-Jun Xiao,* and Qi-Lin Zhou*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c12544
导师介绍
周其林
https://www.x-mol.com/university/faculty/11976
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号