同手性铱(III)-金属螺旋的可编程模块化组装,通过抑制CDK1逆转金属药物耐药性
耐药性是癌症复发和预后不良的主要原因,对于肿瘤耐药相关的特异性蛋白,设计合成针对性的抑制剂对克服肿瘤化疗耐药极具潜力。然而,如何精确调整抑制剂的立体化学结构以匹配肿瘤特异性靶蛋白的手性区域仍是一个挑战。
近日,南京大学王秀秀副研究员、赵劲教授与大连理工大学段春迎教授、李学召副研究员共同在Angewandte Chemie International Edition 杂志发表研究论文,成功开发了一种新型可编程的模块化组装方法,精确地设计并合成了两对二硫脲连接的同手性双核铱(Ⅲ)金属螺旋配合物 (Λ2S4-Hbpy和Δ2R4-Hbpy,Δ2S4-Hbpy和Λ2R4-Hbpy)(图1)。这些手性铱(Ⅲ)金属螺旋配合物在体外和体内都表现出了独特且优异的手性依赖性的光动力治疗(PDT)效果。其中,Δ2S4-Hbpy光毒性指数(PI)高达2.3×104。通过基于蛋白质组学的进一步作用机理解析与结构验证,研究人员发现手性Δ2S4-Hbpy结构能够与靶标细胞周期蛋白依赖性激酶1(CDK1)进行精准的手性结合,从而发挥了优异的手性依赖的光动力治疗效果。
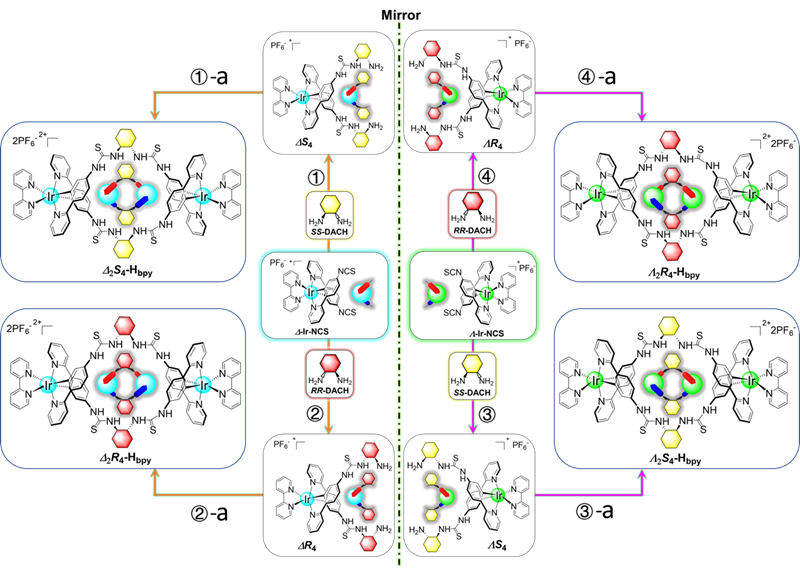
图1. 具有功能化二硫脲结构的手性双核铱(Ⅲ)金属螺旋配合物结构
值得注意的是,CDK1是肿瘤细胞对奥沙利铂耐药发展过程中的一类关键蛋白,本研究工作中,Δ2S4-Hbpy对CDK1的高特异性结合增强了奥沙利铂耐药细胞HCT8/L细胞对Δ2S4-Hbpy结构的细胞摄取并增强了其在耐药细胞中的光动力治疗效果。研究人员进一步通过蛋白质组筛选、蛋白质亲和力分析以及CDK1基因沉默的方法对Δ2S4-Hbpy结构在金属药物耐药细胞中的作用机制进行了深入的解析,证实了手性Δ2S4-Hbpy结构选择性靶向CDK1在逆转金属药物耐药性中的关键作用。
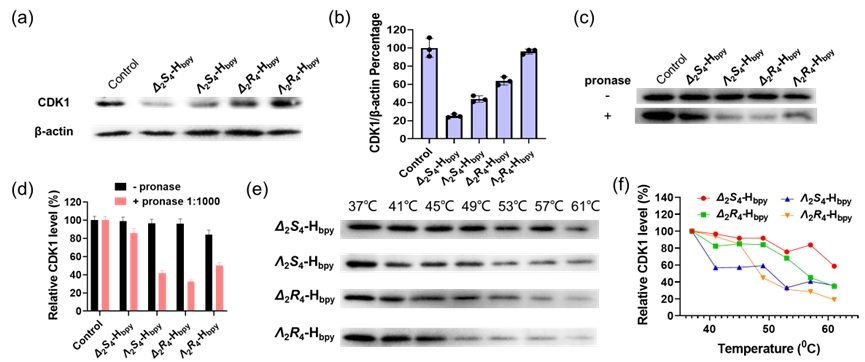
图2. 手性配合物Δ2S4-Hbpy靶向抑制CDK1活性的手性依赖性验证
综上,这项研究为构建和定制具有精确构象和立体化学特性的金属药物以靶向化疗耐药相关特异性蛋白提供了一条独特的解决策略,为克服金属药物化疗耐药的药物设计提供了创新性见解。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Programmable Modular Assembly of Homochiral Ir(III)-Metallohelices to Reverse Metallodrug Resistance by Inhibiting CDK1
Xuezhao Li, Xing Zhao, Xingyun Wang, Anxian Xiong, Zhicheng Wang, Zhuolin Shi, Jingyi Zhang, Hanlin Wang, Wei Wei, Cheng He, Jiajia Ma, Zijian Guo, Chunying Duan, Jing Zhao, Xiuxiu Wang
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202419292
导师介绍
赵劲
https://www.x-mol.com/university/faculty/11607
段春迎
https://www.x-mol.com/university/faculty/254271
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号