Baran等人Science:简化复杂哌啶的合成
从FDA批准上市的药物以及现代医学的角度来看,吡啶及其苯并环化类似物是最重要的杂环化合物结构。如图1A所示,这些平面二维(2D)结构通过一系列顺序官能团化(如:卤化、硼化)以及过渡金属介导的交叉偶联反应来实现多样化。近年来,复杂哌啶(即吡啶的完全饱和类似物)在药物研发过程中受到广泛关注,这也与当前药物发现的重点逐渐转向拓扑更复杂的3D空间有关。事实上,多取代哌啶是药物先导化合物和天然产物中最常见的结构单元(如:1-5),其中二取代哌啶占目前含哌啶药物的61%,但是此类骨架的精确立体化学控制、模块化的合成仍极具挑战性。虽然考虑了立体化学因素,但是此类化合物的逆合成主要依赖于极性键断裂(图1B),这依赖于羰基和烯烃化学,并且往往会受到官能团(FG)、保护基(PG)和氧化还原操作的影响。另一方面,定向进化技术促进的酶促C-H键氧化已被认为是在未活化Csp3-H键上位点特异性安装官能团的最有效方法之一。从某种程度上来说,这种酶促策略有些类似于吡啶上一些常规的经过验证的功能化策略,比如亲电芳香取代。最近,化学家利用自由基交叉偶联策略成功地偶联常见的含Csp3官能团(如酸和醇),这类似于在吡啶上发生Suzuki及相关偶联。那么,酶促C-H键氧化与自由基交叉偶联这两种策略能否“双剑合璧”,产生1+1>2的神奇效果呢?
近日,美国斯克利普斯研究所(Scripps Research)的Phil S. Baran、Yu Kawamata和莱斯大学的 Hans Renata等研究者利用生物催化C-H键氧化和自由基交叉偶联相结合策略(图1B),成功地发展了一种快速、模块化、对映特异性和非对映选择性官能团化哌啶的方法,从而极大地简化了大量高价值手性哌啶的合成路线。以3,4-二取代哌啶8为例,作者通过生物催化C-H键氧化和两次连续的自由基交叉偶联反应即可获得,而先前的方法则需要8步合成并且涉及手性拆分、自燃性试剂使用(Grignard、LAH×2)和多次氧化还原操作。相关成果发表在Science 上。
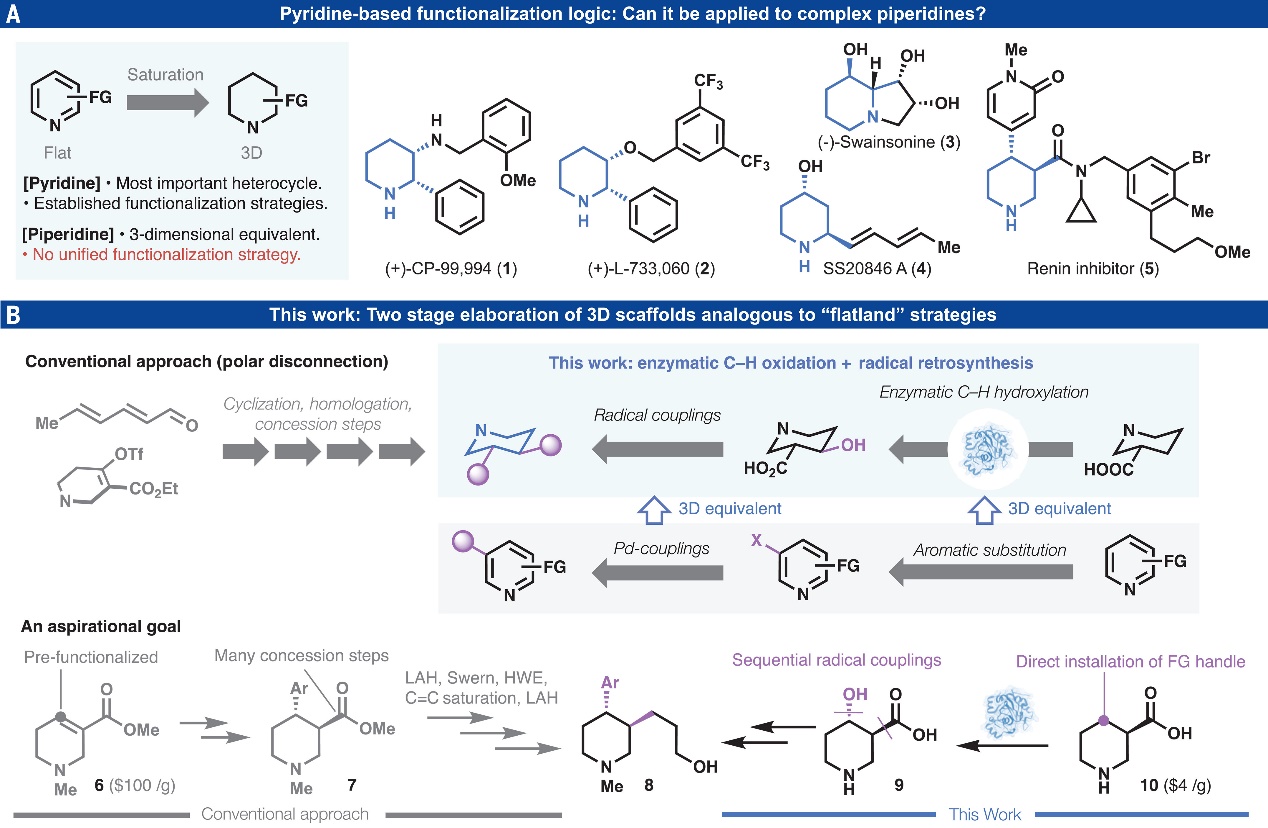
图1. 研究背景及本文工作。图片来源:Science
首先,作者对酶促手性2-羧基哌啶11($ 0.80/g)和3-羧基哌啶10($ 8.0/g)的大规模位点特异性C-H键羟基化反应条件进行了探索(图2A),当使用2-酮戊二酸(α-KG)依赖性双加氧酶trans-脯氨酸4-羟化酶(trans-P4H)时仅以39%的转化率获得产物12,进一步优化反应参数(α-KG和Fe2+当量、缓冲液pH值)后转化率提高至>99%,而且这种最优条件可实现克级规模制备,同时底物浓度远高于先前报道的条件(15 vs 1 mM)。随后,作者以Xenorhabdus doucetiae(XdPH YR)衍生的工程化α-KG依赖性L-哌可酸羟基酶和脯氨酸-4-羟基化酶(P4H810)为催化剂探索了11转化为5-羟基化L-Pip 13的反应条件,结果显示P4H810能够区域和立体选择性地获得产物13(转化率:80%),进一步对反应pH进行优化后可将转化率提高到100%。类似地,作者还筛选了(R)-3-羧基哌啶(D-Nip,10)进行羟基化反应的酶,发现从Sphingopyxis alaskensis(SaEctD)中分离出的四氢嘧啶5-羟化酶能以90%的转化率获得4-羟基-D-Nip 9(其结构通过NMR分析和二硝基苯甲酰胺衍生物的X-射线衍射分析得以证实),进一步增加α-KG的当量(2.5→5.0)可将转化率提高至~100%,并且在较高的底物浓度(15 mM)下也适用。此外,作者分析了EctD对D-Nip的米氏(Michaelis-Menten)动力学参数,并确定催化常数(kcat)和米氏常数(Km)分别为19.9±0.6 min−1和20.4±2.2 mM,同时计算获得kcat/Km值为0.98±0.1 mM−1 min−1。初步对接研究表明D-Nip在活性位点内的结合模式与ectoine不同,即D-Nip主要依赖于羧基基团与Gln127、Arg129和Arg280之间的极性相互作用。基于上述酶促C-H键氧化,借助常规的Boc保护完成了五种关键哌啶化合物(14-18)的合成(图2B),其中4种虽市售可得,但价格昂贵($773/g-$1737/g)。值得注意的是,所有酶促羟基化过程均能以>99:1 dr值获得产物12、13和9。
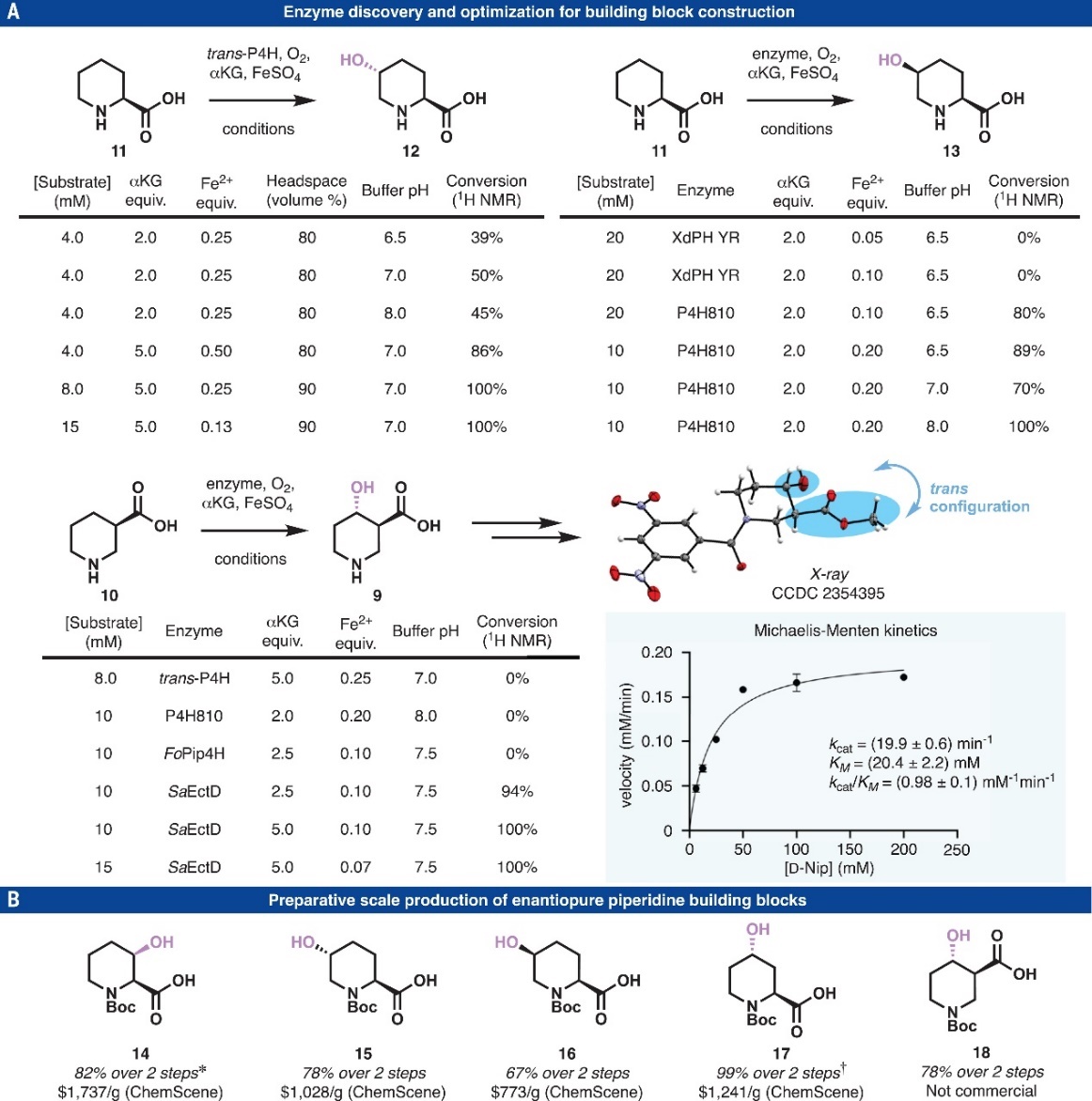
图2. 可放大生物催化C-H键羟基化。图片来源:Science
随后,作者利用酶促羟基化和自由基交叉偶联级联策略来简化复杂哌啶的合成,具体而言:1)N-Boc哌啶衍生物14经Ni/电催化脱羧交叉偶联反应便可以48%的分离产率获得单一的立体异构体——N-Boc-3-羟基-2-苯基哌啶19(总共3步,图3A),该化合物是合成神经激肽NK1受体拮抗剂(如:(+)-L-733,060(2)、(+)-CP-99,994(1))的关键中间体,而先前的合成策略通常存在立体选择性差、步骤冗长(7-17步)、低温条件和贵过渡金属催化等问题;2)2-羧基哌啶11经酶促C-H键羟基化、Boc保护、电催化脱羧烯基化、一锅法Appel反应和环化以及双羟基化5步转化便可获得具有抗癌、α-D-甘露糖苷酶和甘露糖苷酶II的强效抑制剂作用的苦马豆素3,而之前已报道的40多种合成方法则需要6->20步转化,其中最短的合成路线以5-氯戊醛为原料,涉及不对称氯化(-35℃反应19天)、炔基锂加成、Lindlar还原、脱Boc、环化和双羟基化;3)从Steptomyces sp. S20846中分离的天然产物 SS20846 A 4,其以前的合成路线需要6-17 步并且所有步骤均依赖于极性键断裂,而经酶促C-H键羟基化和自由基交叉偶联反应仅需3步便可以51%的分离产率和7:1 dr值获得4(图3B),从而避免使用自燃性试剂、手性助剂和非战略性还原;4)从2-羧基哌啶11出发,经酶促C-H键羟基化、Boc保护、Ni/电催化脱羧交叉偶联反应、乙基化便可构建创新药物LNP023(治疗阵发性睡眠性血红蛋白尿症(PNH))的关键中间体32,而之前则是通过9步转化获得关键中间体38;5)以2-羧基哌啶11为原料,通过酶促C-H键羟基化、Boc保护、与甘氨酸甲酯偶联、碘化反应、Ni/电催化的非对映选择性交叉偶联、一锅法酰胺还原和亲核芳香取代反应便可构建多巴胺D4受体拮抗剂CP-293019(共7步,图3C),而先前的合成路线则从2,5-二吡啶甲酯43出发,先后通过氢化、环化、还原、手性拆分、差向异构化、Mitsunobu反应和亲核芳香取代反应等12步转化。
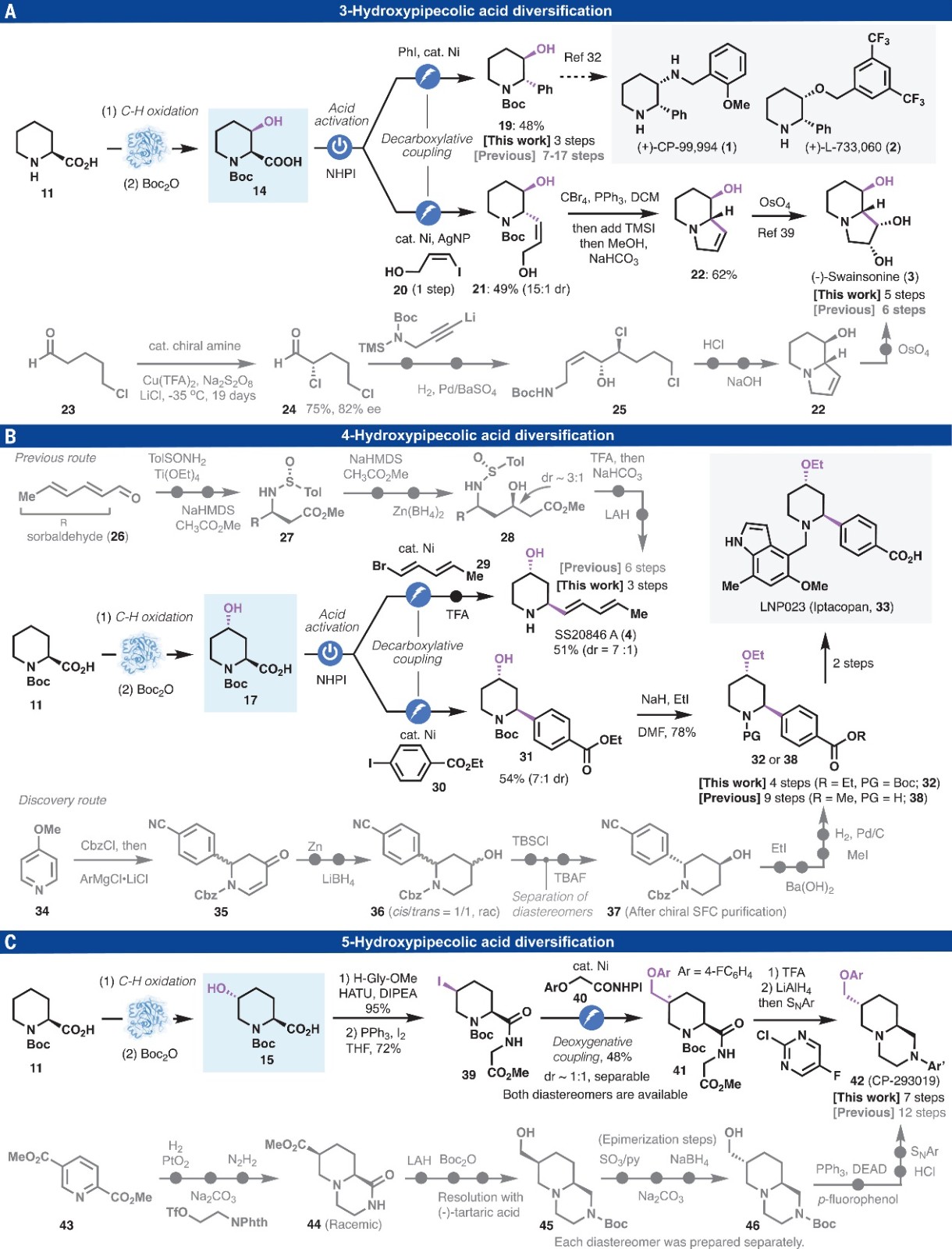
图3. Pipecolic acid多样化:生物催化C-H键氧化或自由基交叉偶联。图片来源:Science
最后,作者对3,4-二取代复杂哌啶的合成过程进行了研究。如图4A所示,高活性单胺转运蛋白配体8的先前合成路线需要八步转化,而本文发展的3-羧基哌啶10经酶促C-H键羟基化、Boc保护、双脱羧交叉偶联(dDCC)、原位溴化、Ni/电催化非对映选择性偶联以及Boc和酯还原五步转化即可获得目标产物8,从而避免手性拆分、自燃性试剂(Grignard、LAH×2)使用和多次氧化还原操作。此外,手性3,4-二取代哌啶61是肾素抑制剂的合成中间体(图4B),虽然目前的合成工艺能实现千克级制备,但是总体路线完全依赖于极性键断裂和贵金属催化。先前对于芳基片段57的合成,四步转化中有两步涉及贵金属催化偶联和氢化;而本文从市售二溴苯甲酸55出发,经酰胺化、单选择性Ni-Ag电催化脱羧芳基化便可获得57,后者经BH3还原得到苄胺58。另一方面,先前报道的哌啶片段的工艺规模路线以市售的苄基保护β-酮酯62为原料,共经过10个反应步骤来获得产物61,其中只有三步形成骨架键(C-C和C-N),包括Pd催化氢化、硼化和Suzuki偶联以及Ru催化的不对称氢化。相比之下,本文通过N-Boc哌啶衍生物18与苄胺58的酰胺缩合和Appel反应获得烷基碘化物,再与碘代吡啶酮60发生Ni-Ag电催化自由基交叉偶联即可获得产物61,这意味着本文开发的工艺路线(5步,总共8 步)比目前的工艺路线(10步,总共14步)简化很多,并且没有使用贵金属催化的几步。
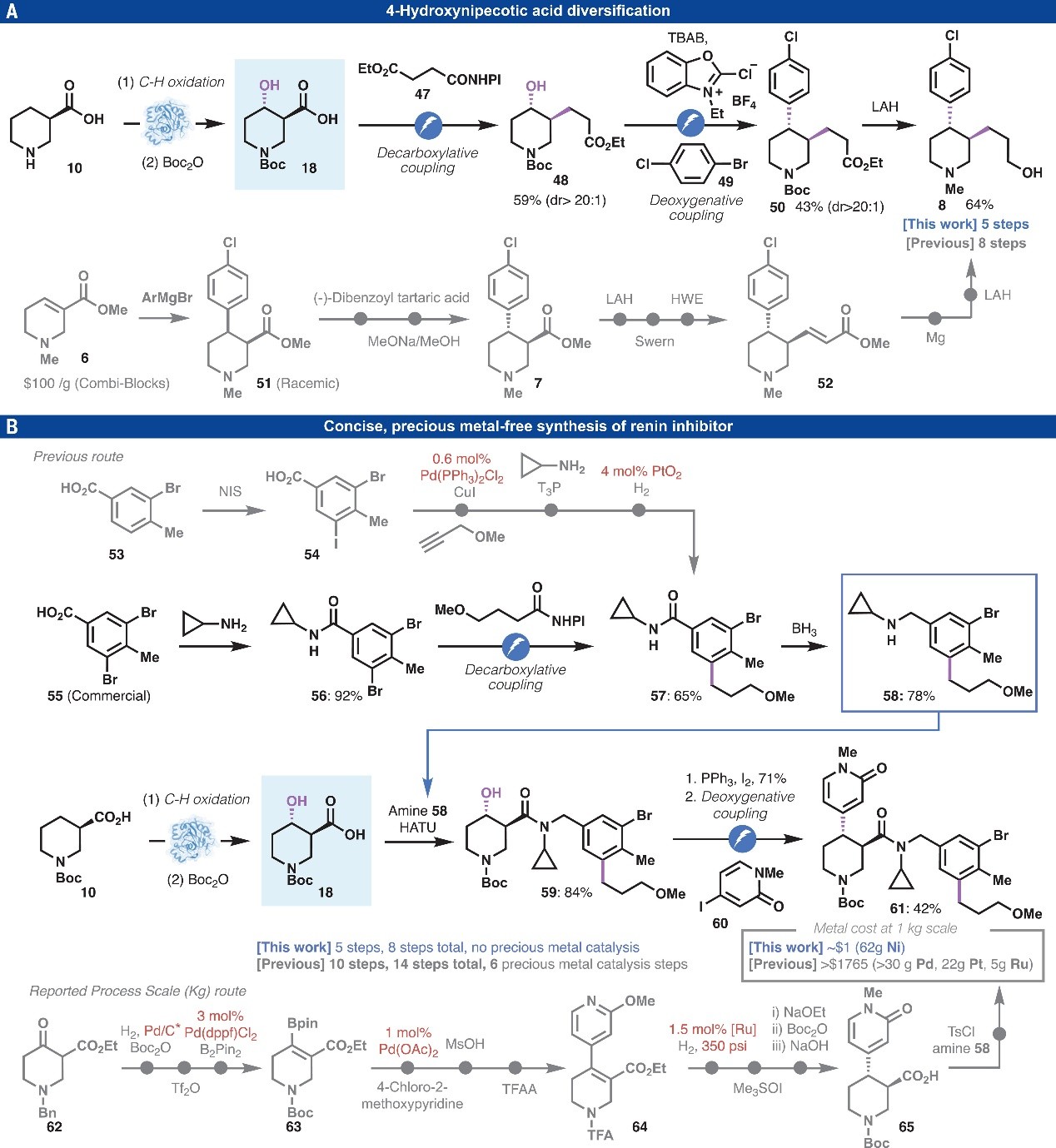
图4. Nipecotic acid多样化:生物催化C-H氧化键或自由基交叉偶联。图片来源:Science
总结
Phil Baran教授等研究者利用生物催化C-H键氧化和自由基交叉偶联相结合的策略,成功地发展了一种快速、模块化、对映特异性和非对映选择性官能团化哌啶的方法,从而极大地简化了大量高价值手性哌啶(如:神经激肽受体拮抗剂、抗癌剂和抗生素)的合成路线。该策略可快速制备复杂的 3D 分子,并且减少对手性拆分步骤、昂贵的手性配体和贵金属催化剂等依赖,进而简化传统上具有挑战性的合成途径,对药物化学家和工艺化学家来说都意义重大。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Biocatalytic C–H oxidation meets radical cross-coupling: Simplifying complex piperidine synthesis
Jiayan He, Kenta Yokoi, Breanna Wixted, Benxiang Zhang, Yu Kawamata, Hans Renata, Phil S. Baran
Science, 2024, 386, 1421-1427, DOI: 10.1126/science.adr9368
导师介绍
Phil S. Baran
https://www.x-mol.com/university/faculty/668
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号