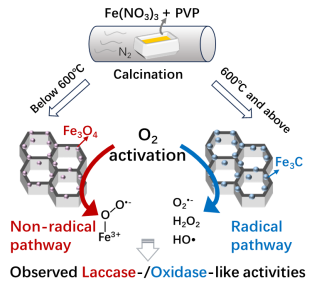
香港城大彭咏康副教授Small:大规模合成具有可控O2活化路径和相关酶促反应特异性的Fe基纳米酶
不同于天然酶,纳米酶往往缺乏催化特异性,从而阻碍其广泛的应用,这一挑战在最近的许多综述文章中得到了广泛关注。到目前为止,一些工作在调节H2O2的活化进而实现相关特定酶促反应活性方面取得了进展。香港城市大学彭咏康副教授(点击查看介绍)课题组的一项近期工作对H2O2在CeO2表面的活化进行了精确控制,从而调控了CeO2在过氧化物酶模拟和卤过氧化物酶模拟反应中的活性和专一性 (ACS Nano 2023, 17, 17383-17393)。然而,对于O2活化调控的报道仍然十分有限。近期,彭咏康副教授团队在Small 上发表研究论文,通过简单的煅烧法实现了铁基纳米酶的大规模合成,且该铁基纳米酶具有可调控的O2活化路径和相关酶促反应特异性。他们使用了一种简易的高温热分解法制备了嵌入在多孔碳中的Fe基纳米酶,该方法可以达到克级生产规模,并通过控制煅烧温度来调节纳米酶中Fe物种的组成(Fe3O4或Fe3C)。有趣的是,含Fe3O4的样品表现出优异的漆酶 (laccase) 模拟活性,而含Fe3C的样品则表现出更好的氧化酶 (oxidase) 模拟活性。进一步的研究表明,表面Fe物种的差异导致了不同的O2活化途径,从而让对应的纳米酶展现了相反的活性趋势。这项工作有望为提升与O2活化相关纳米酶的活性和特异性提供参考。
尽管纳米酶的多种酶促反应活性使其能够参与自级联反应,但缺乏“底物”或“反应”特异性可能会阻碍其在选择性生物测定中的应用。纳米酶的“底物”特异性是指其在各种底物中选择性激活特定底物的能力。O2和H2O2分别是氧化酶和过氧化物酶的底物 (图1a),对O2和H2O2“底物”特异性的控制依赖于O2和H2O2之间氧化还原电位的差异 (图1b)。
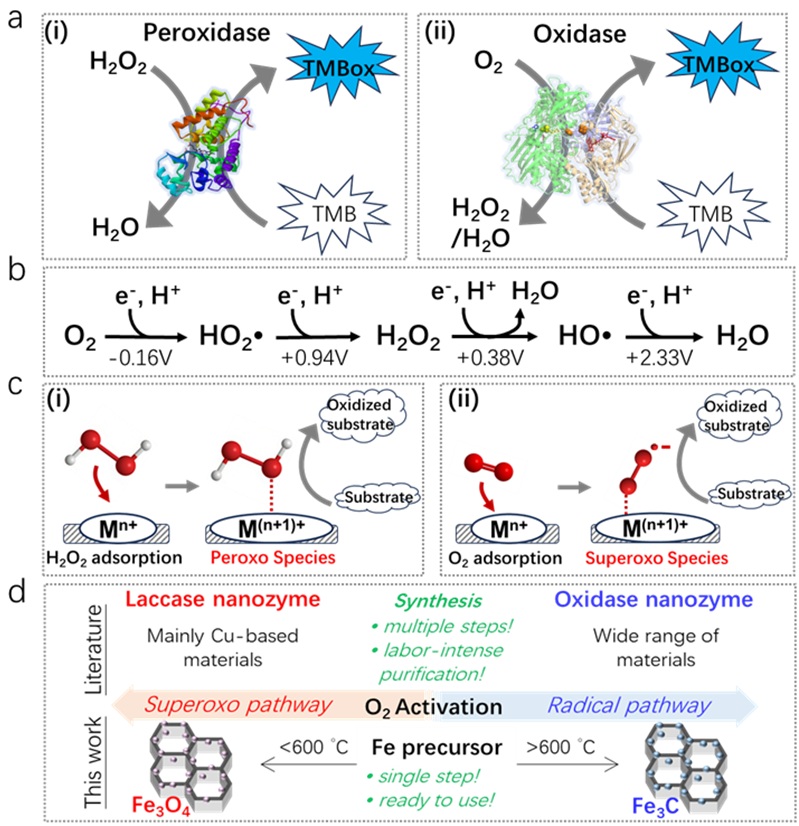
图1. (a) 由 (i) 过氧化物酶和 (ii) 氧化酶催化的 TMB 氧化和 (b) 在O2连续还原过程中产生的活性氧 (ROS)的示意图。(c) (i) 通过过氧化途径活化H2O2和 (ii) 通过超氧化途径活化O2的机理示意图。(d) 比较文献和本研究中氧化酶/漆酶模拟物的合成。
除了“底物”特异性之外,控制单一底物的活化(从而控制它们的“反应”特异性)是更具挑战的任务。该课题组最近的工作证明,通过控制CeO2纳米颗粒曝露的表面可以精确调节H2O2的活化途径,途径分别为自由基途径以及非自由基途径 (图1c(i)),从而实现了CeO2在过氧化物酶模拟和卤过氧化物酶模拟反应中的特异性。与H2O2类似,O2的活化途径也包含自由基途径 (图1b) 和非自由基途径 (图1c(ii)),然而目前关于调控O2活化途径的研究非常有限。与O2活化相关的酶促反应方面,虽然氧化酶和漆酶模拟活性被大量研究,但其中关于O2活化途径的综合理解不甚明确。此外,用于模拟这两种酶促反应活性的纳米酶的制备通常涉及多个步骤和纯化过程,这对于实际应用来说并不理想 (图1d)。
本文介绍了一种简便且可批量生产的方法来制备具有可调控的氧化酶和漆酶模拟活性的Fe基纳米酶。该制备可以一步完成,所得样品无需纯化即可直接使用。在低于600 °C的温度下获得的含Fe3O4的样品表现出优异的漆酶模拟活性,而在高于600 °C的温度下制备所得样品中的Fe3C则由Fe3O4转化而来,并表现出更好的氧化酶模拟活性。研究发现,O2不同的活化途径与其表面Fe物种的分布密切相关。Fe3C中碳原子配位的金属Fe可以通过自由基途径将吸附的O2还原为活性氧物种ROS,从而促进氧化酶模拟活性。而Fe3O4表面晶界上高活性的Fe2+(Fesgb2+)则倾向于通过非自由基途径将吸附的O2转化为 Fesgb3+-超氧复合物,从而促进漆酶模拟活性。
在这项研究中,Fe基纳米酶通过在氮气下高温分解Fe(NO3)3和聚乙烯吡咯烷酮 (PVP)的混合物制备。仅需简单地调节煅烧温度,即可控制镶嵌于蜂窝状碳基框架(简称为CN)的Fe基纳米酶的类型 (Fe3O4或Fe3C)。
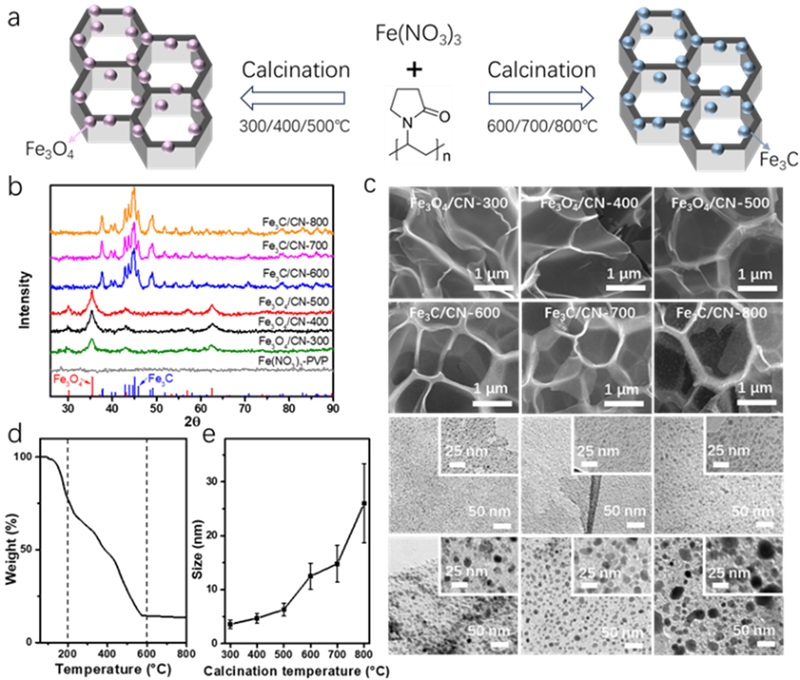
图2. (a) 嵌入蜂窝状碳基框架中的Fe基纳米酶合成示意图。(b) 样品的XRD谱图。(c) Fe3O4/CN-300、Fe3O4/CN-400、Fe3O4/CN-500、Fe3C/CN-600、Fe3C/CN-700 和 Fe3C/CN-800的 SEM和TEM图像。(d) 在氮气下 Fe(NO3)3-PVP 混合物在高温下的分解。(e) Fe基纳米酶中Fe3O4/Fe3C纳米颗粒的粒度分布。
样品氧化酶模拟活性的评估通过追踪3,3'5,5'-四甲基联苯胺(TMB)的氧化来实现。漆酶模拟活性则通过2,4-二氯苯酚(2,4-DP)被氧化后和4-氨基安替比林(4-AP)生成的产物进行评估。对于氧化酶模拟反应活性,含Fe3C的样品比含Fe3O4的样品表现更佳,其中Fe3C/CN-700具有最高的氧化酶模拟活性。对于漆酶模拟反应活性, 活性趋势则相反,含Fe3O4的样品活性超过了含Fe3C的样品,其中Fe3O4/CN-400具有最优的漆酶模拟活性。通过引入Fe(NO3)3-PVP混合物、PVP-700和PVP-400 (分别对应在700度和400度煅烧的纯PVP样品) 的活性测试,排除了基底中潜在的未分解的Fe(NO3)3和煅烧后碳基底对于反应活性的贡献。因此,观测到的氧化酶模拟活性或漆酶模拟活性,主要来源于镶嵌于碳基底的Fe3O4或Fe3C纳米颗粒。
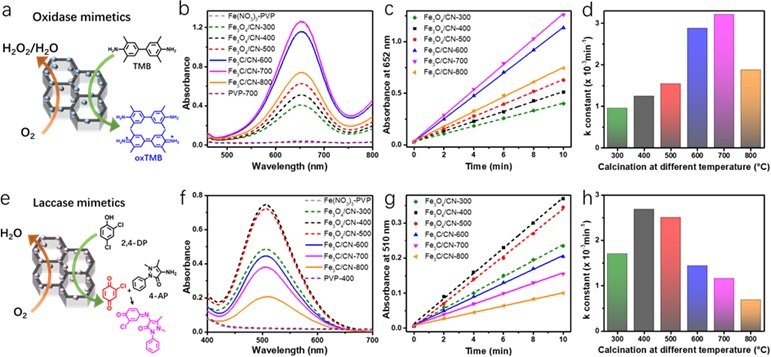
图3. (a) 在TMB存在下氧化酶纳米酶反应的示意图,(b)反应10分钟后记录的Fe基纳米酶的紫外可见光谱, (c) 在652 nm处随时间变化的紫外可见吸光度, 和(d)相应的速率常数(min-1)。(e)在2,4-DP和4-AP存在下漆酶纳米酶反应的示意图。(f)反应60分钟后记录的 Fe基纳米酶的紫外可见光谱, (g) 在652 nm处随时间变化的紫外可见吸光度, 和(h)相应的速率常数(min-1)。
如上所述,Fe基纳米酶在氧化酶模拟/漆酶模拟活性中表现的特异性与其Fe3C和Fe3O4表面的Fe物种密切相关。因此,接下来作者对发挥关键作用的Fe物种进行了进一步研究。Fe K边X射线吸收近边结构(XANES)表明,Fe物种的平均电子密度趋势为:Fe3C/CN-700 > Fe3C/CN-600 > Fe3O4/CN-500 ≈ Fe3O4/CN-400,这一趋势与其氧化酶模拟活性一致,路易斯酸性顺序Fe3O4/CN-400 ≈ Fe3O4/CN-500 > Fe3C/CN-600 > Fe3C/CN-700也和观测到的漆酶模拟活性趋势相符合。扩展 X 射线吸收精细结构(EXAFS)和相应的小波分析进一步揭示了样品中由Fe3O4向Fe3C的转化。X射线光电子能谱(XPS)分析表明,含Fe3C样品的金属Fe促进了氧化酶模拟活性,而含Fe3O4样品中Fesgb2+物种是漆酶模拟活性的关键因素。
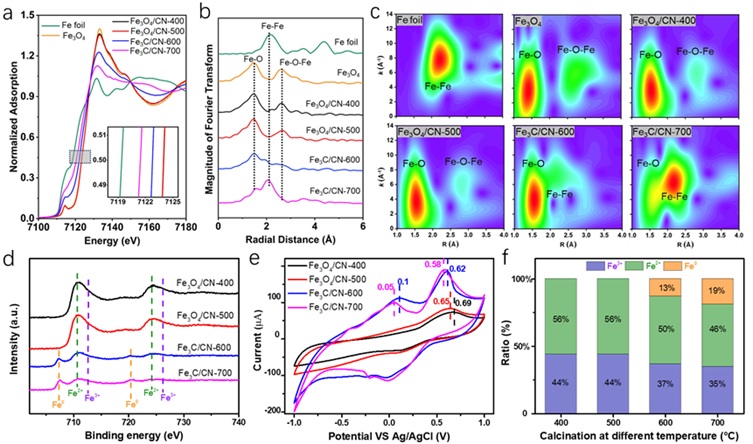
图4. (a) Fe K边XANES光谱,(b) 傅里叶变换的 EXAFS 结果和 (c) 相应的小波分析,(d) XPS Fe2p光谱,(e) 循环伏安图结果和 (f) Fe 基纳米酶中金属Fe、Fe2+和Fe3+的比例。
通过电子顺磁共振(EPR)、酶抑制实验等研究表明,对于氧化酶模拟活性,含Fe3C样品中更高电子密度的金属Fe促进了O2还原生成HO2自由基和OH自由基的过程,其中OH自由基是TMB氧化的主要驱动力,HO2自由基促进了活性位点的再生。而对于漆酶模拟活性,则主要由含Fe3O4样品表面的Fesgb3+-超氧复合物介导,实现对2,4-DP的选择性氧化,而非通过自由基路径完成催化。
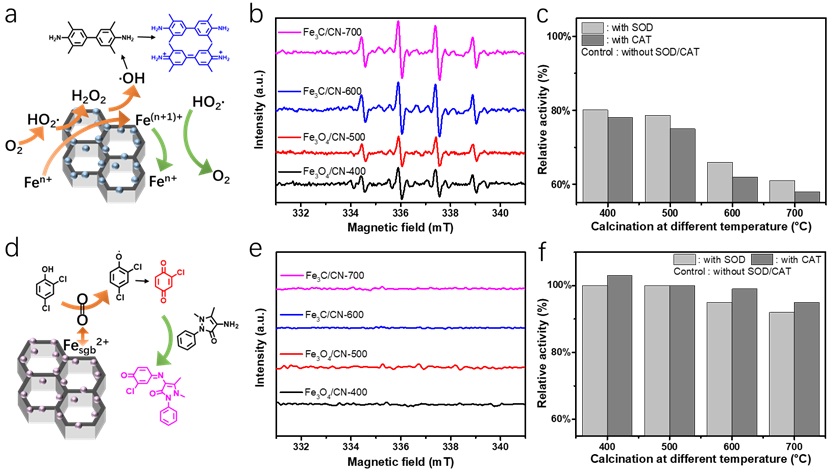
图5. (a) 氧化酶模拟机制的示意图,(b) EPR监测在醋酸缓冲液(pH=4.0)中Fe基纳米酶激活O2生成的OH自由基,(c) 添加超氧化物歧化酶(SOD)或过氧化氢酶(CAT)至反应溶液后,相对于对照组(活性设定为100%)的氧化酶模拟活性变化,(d) 漆酶模拟机制的示意图,(e) EPR监测在中性条件下OH自由基的产生情况,(f) 添加SOD或CAT至反应溶液后,相对于对照组(活性设定为100%)的漆酶模拟活性变化。
结论
本文报道了一种简便的方法来一步制备具有可调节Fe物种的纳米酶。有趣的是,与含Fe3O4的样品相比,含Fe3C的样品表现出更好的氧化酶模拟活性,而含Fe3O4的样品在漆酶模拟活性方面优于含Fe3C的样品。这一发现表明它们通过不同的途径激活O2。氧化酶模拟活性源于酸性条件下 O2 被促进还原为游离 ROS。相反,该过程在中性pH下受到阻碍,导致了表面 Fesgb3+-超氧复合物的形成,从而使2,4-DP 在漆酶模拟活性中被选择性氧化。因此,含 Fe3C样品的高氧化酶模拟活性归因于金属Fe的存在,它相较含Fe3O4样品中的Fesgb2+具有更高的电子密度,从而更有效地促进了ROS 的生成。而它们较低的漆酶模拟活性则是因为Fe3C的粒径较大,与较小的 Fe3O4颗粒相比,它能提供的对漆酶模拟活性起主要贡献的Fesgb2+物种较少。最后,Fe3O4/CN-400和Fe3C/CN-700的氧化酶和漆酶模拟活性被用于检测GSH和多巴胺,以强调控制O2活化途径在相关应用中的重要性。本研究提出的能够调节O2活化途径、并具有高反应特异性的Fe基纳米酶,预计能够为相关纳米酶的设计提供见解。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

One-Pot and Gram-Scale Synthesis of Fe-Based Nanozymes with Tunable O2 Activation Pathway and Specificity Between Associated Enzymatic Reactions
Yuwei Qiu, Tianqi Cheng, Bo Yuan, Tsz Yeung Yip, Chao Zhao, Jung-Hoon Lee, Shang-Wei Chou, Jian Lin Chen, Yufei Zhao, Yung-Kang Peng
Small, 2024, DOI: 10.1002/smll.202408609
作者及团队介绍

Prof. Will Yung-Kang Peng (彭詠康) began his PhD study in 2013 at the Wolfson Catalysis Centre of Inorganic Chemistry at the University of Oxford (UK) under the supervision of Prof. Edman Tsang. He received a Clarendon Scholarship from the university for being in the top 3% of admitted graduates in his cohort. After obtaining his PhD in 2017, he joined the Chemistry Department at City University of Hong Kong in 2018 as an Assistant Professor and is now an Associate Professor. His research focuses on the understanding of surface coordination chemistry to design and synthesize hetero(photo)catalysts and MRI contrast agents. To date, he has published over 90 SCI papers in the relevant field and secured more than 5 million HKD in funding as a principal investigator.
彭咏康
https://www.x-mol.com/university/faculty/304554
课题组主页
https://ykpenglab.wixsite.com/ykpenglab
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号