诺奖得主Science:用光学显微镜测量分子,分辨率达Å级?
上世纪40年代,德国化学家Theodor Förster发表了一系列论文,阐明了共振能量转移机理。他发现处于激发态的供体生色团能够通过非辐射的方式,将能量转移到受体生色团。为了纪念Förster,这种机理被命名为FRET(Förster resonance energy transfer)。此后,FRET显微技术成为探测纳米尺度下蛋白质或其他生物大分子长度的唯一光学方法,因此FRET显微技术也被称为“分子标尺”,为生命科学提供关键的表征和实验证据。
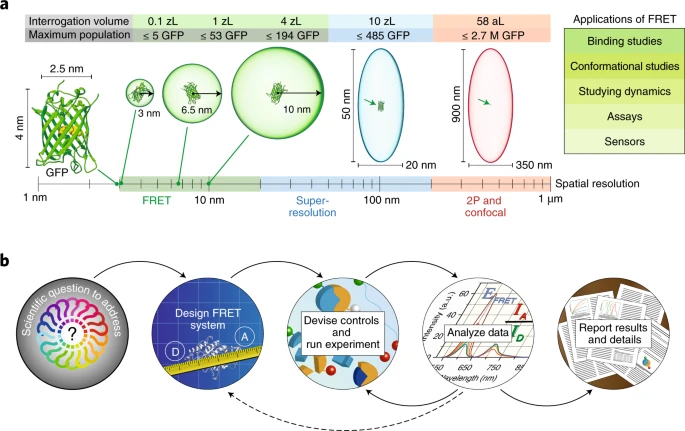
FRET 检测范围与实验流程。图片来源:Nat. Methods [1]
尽管FRET在生命科学中广泛应用,但它也存在一些限制。首先,能量转移的效率随着供体与受体之间距离的六次方迅速衰减,这使得FRET的应用范围通常局限在1至10纳米。能量转移还依赖于分子极化率和偶极矩的相对取向,通常较难控制。此外,供体分子的发射光谱必须与受体分子的激发光谱存在一定的重叠,否则能量跃迁难以实现。这些因素影响了FRET在某些实际应用中的灵活性和范围。
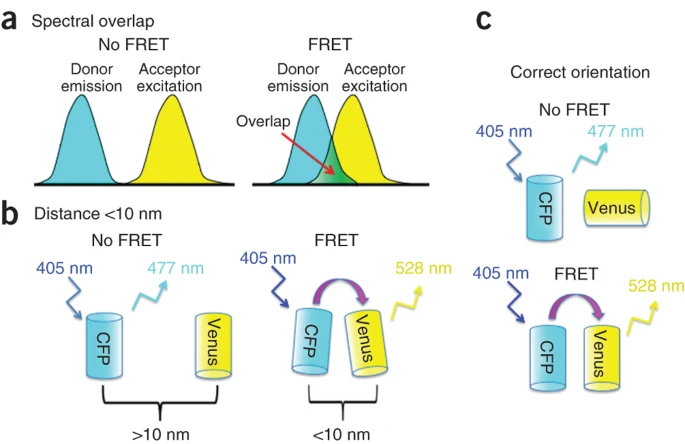
高效FRET必须满足的三个条件。图片来源:Nat. Protoc. [2]
近日,因开发超分辨显微镜而获得2014年诺贝尔化学奖的德国马克斯•普朗克多学科科学研究所Stefan W. Hell教授课题组在Science 杂志上发表论文,改进了此前他们提出的超分辨率荧光显微技术MINFLUX,使这种光学成像方法达到了在平面投影中的埃级(Å)精度。这项技术突破性地实现了对1~10 nm范围内分子长度的精确测量,甚至在分子具有倾斜角度时,能够测量低于1 nm的距离。研究人员通过使用聚脯氨酸作为标尺,展示了MINFLUX对已知纳米级间距的荧光团的分辨能力。
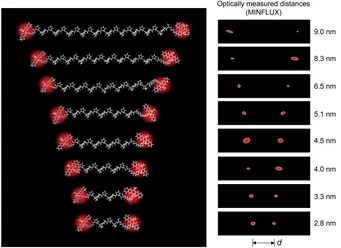
不同长度的聚脯氨酸作标尺,展示MINFLUX的分辨率。图片来源:马普所 [3]
早在2016年,Stefan Hell教授课题组就提出了MINFLUX的概念 [4]。在传统的光学成像中,由于阿贝极限的存在,单个荧光团会因衍射而变得模糊,导致显微镜无法分辨间距小于约半个光波长的两个物体。而MINFLUX的测量原理则采用了与传统方法相反的定位策略。具体来说,MINFLUX使用一个空心光束作为定位光源,光束中心的信号强度为零。定位过程不依赖于光信号的最大值,而是将分子定位在激发光场的最小信号区域。这种方法显著减少了定位所需的光子数量,即使在光信号极低的情况下,也能获得高分辨率 [5]。
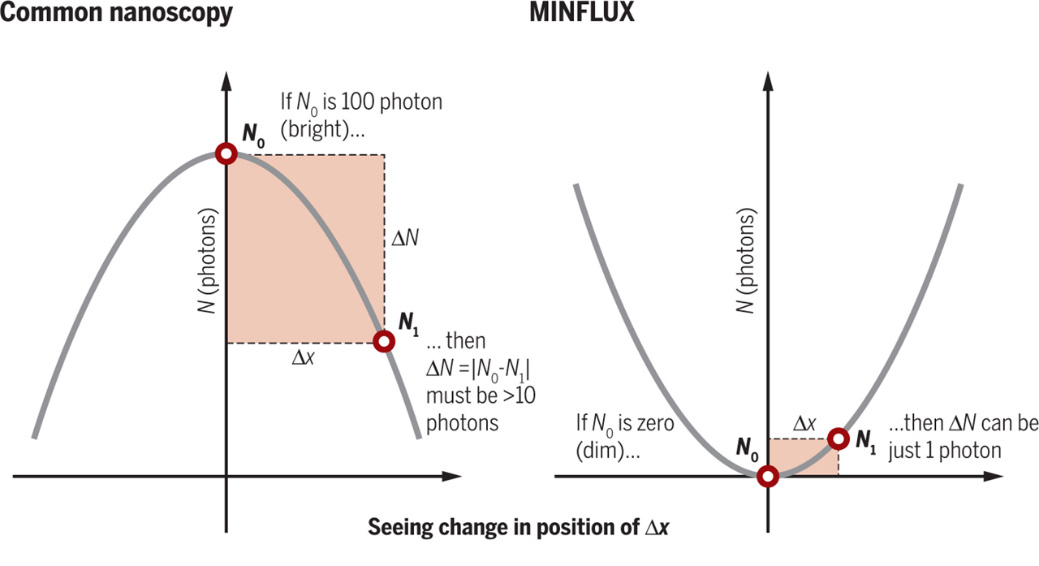
MINFLUX法与传统纳米显微镜原理对比。图片来源:Science [5]
在本篇Science论文中,研究者进一步采用聚脯氨酸作为长度参考,聚脯氨酸是一种由相对刚性的螺旋构成的肽链,带有末端的甘氨酸和赖氨酸残基,以及两端结合的光活化荧光团。不同聚合度的聚脯氨酸可以组成2.5至11 nm的预期长度梯度。
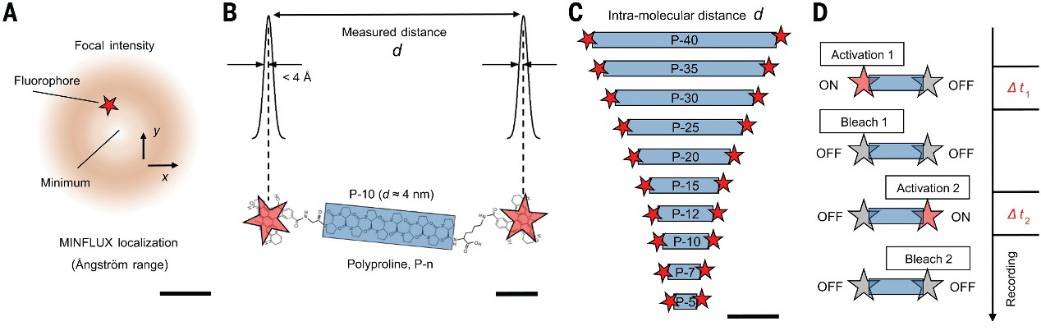
MINFLUX法测量分子长度示意图。图片来源:Science
为了量化单个荧光团在多聚脯氨酸链末端的定位精度,实验首先对单标记的聚脯氨(n=15)样品进行成像。实验中,通过聚焦的405 nm光束激活荧光团,并使用640 nm的空心激发光束来精确定位。MINFLUX算法使激发光束迅速聚焦在已激活的荧光团上,并通过多次重复定位操作直到光漂白,最终得出一组荧光团的位置数据,定位精度达到亚纳米级别。对于双标记的多聚脯氨酸链,实验确保两个荧光团的激活和定位相互独立,进一步提升了实验的精度和可靠性。
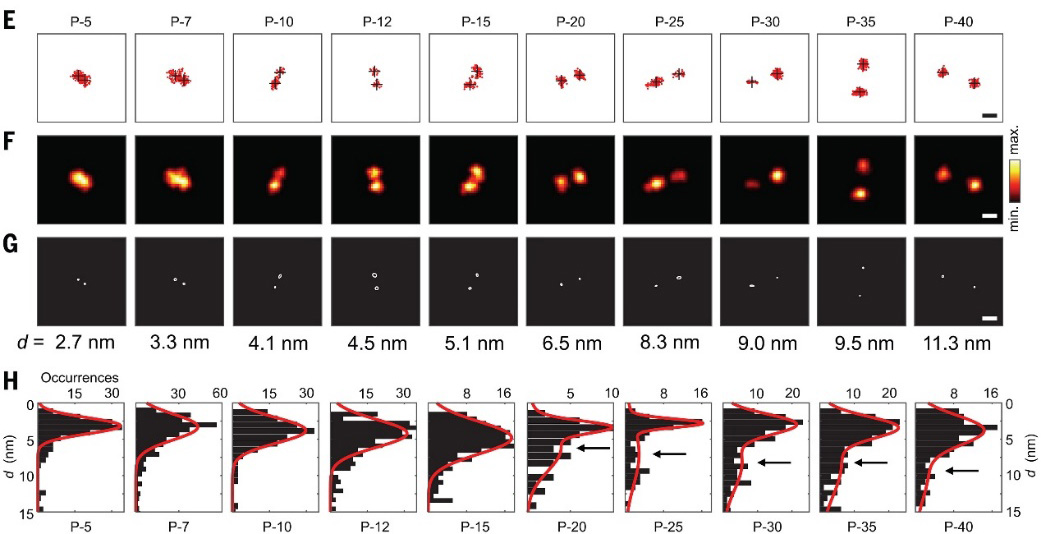
MINFLUX法测量多种聚合度的聚脯氨酸。图片来源:Science
在聚合度低于20的聚脯氨酸链中,分子长度与脯氨酸个数呈线性关系,每增加一个脯氨酸残基,长度增加约0.21 nm。MINFLUX能够清晰解析和量化这种分子内“阶梯”状的长度分布。
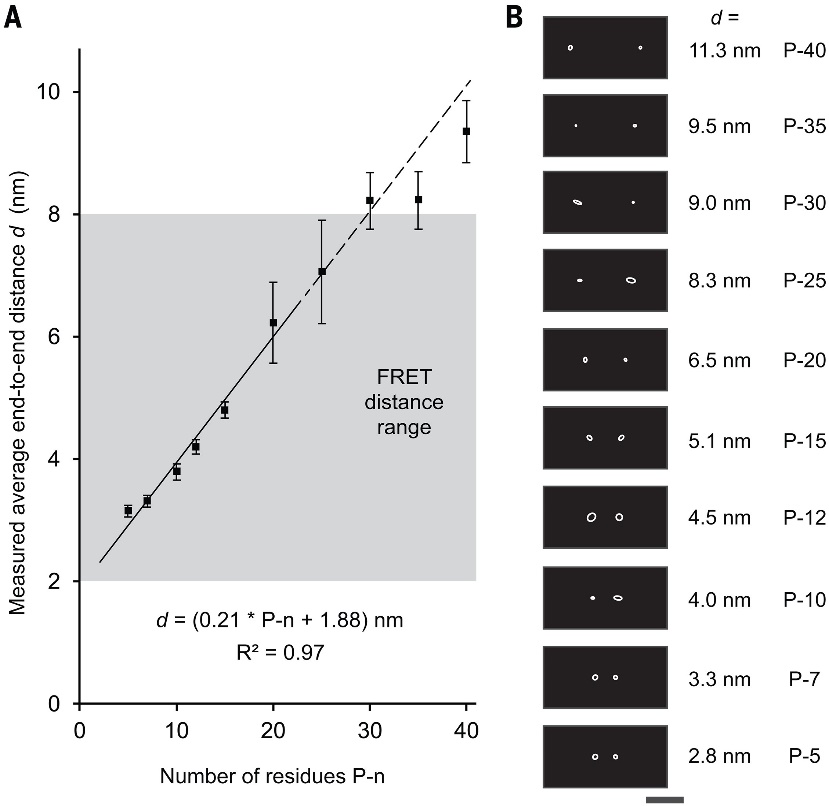
聚脯氨酸的MINFLUX成像。图片来源:Science
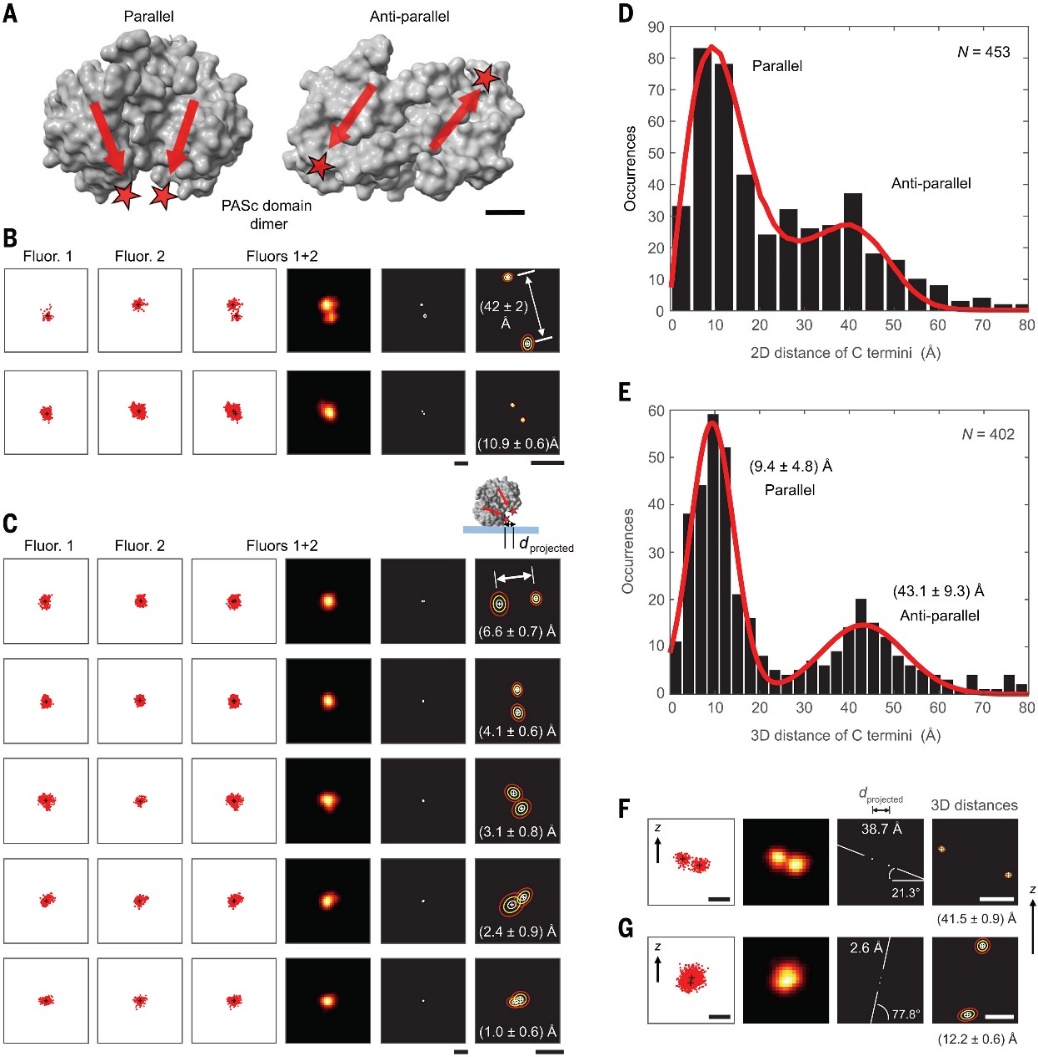
研究者利用MINFLUX法测量了一个蛋白质分子的长度,蛋白质分子的C端和N端距离约为3.8 nm。根据拟合曲线还发现,少数情况下,长度分布延伸到16 nm,推测是因巯基导致的二聚体和三聚体形成,凝胶电泳也验证了二聚体和三聚体的存在。此外,MINFLUX还可以用于更大的蛋白质分子(如免疫球蛋白IgG)的结构测量,直接观察IgG的两个“臂”的定位和取向。
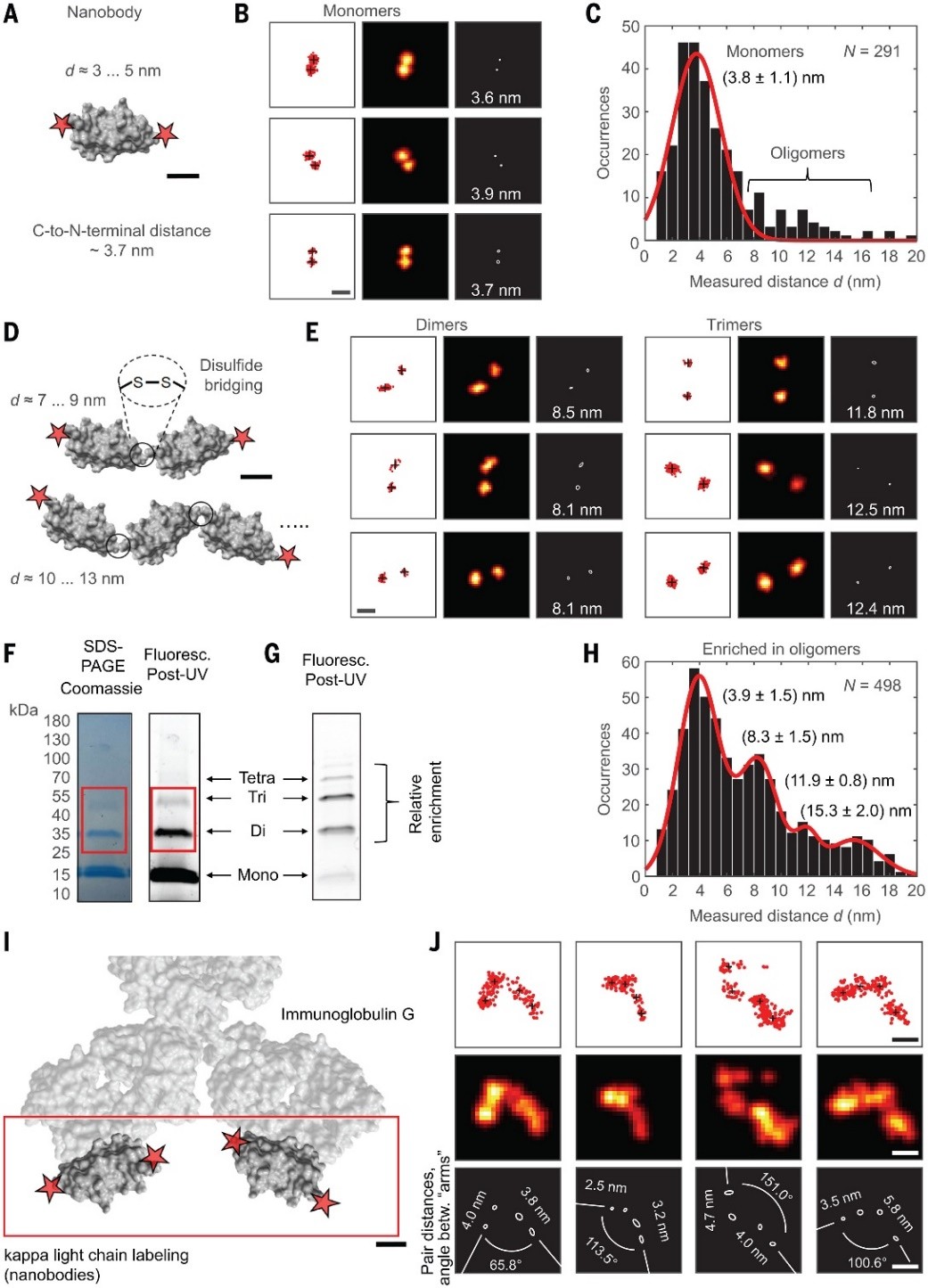
蛋白质大分子距离测量。图片来源:Science
MINFLUX可以广泛地应用于生物成像领域。例如,研究人员利用它对细胞内的核纤层蛋白结构进行了测量。这类蛋白形成的细丝直径约为3.5 nm,由二聚体的反向配对构成,观察发现,平均每隔约20 nm出现一对C端的球状结构,而N端则呈现不等距排列,总间距约为40 nm。借助MINFLUX的高分辨率,还可以分析分子的构象变化,例如直接观察细菌中柠檬酸感受器蛋白(CitA)在感受到柠檬酸前后的构象转变。
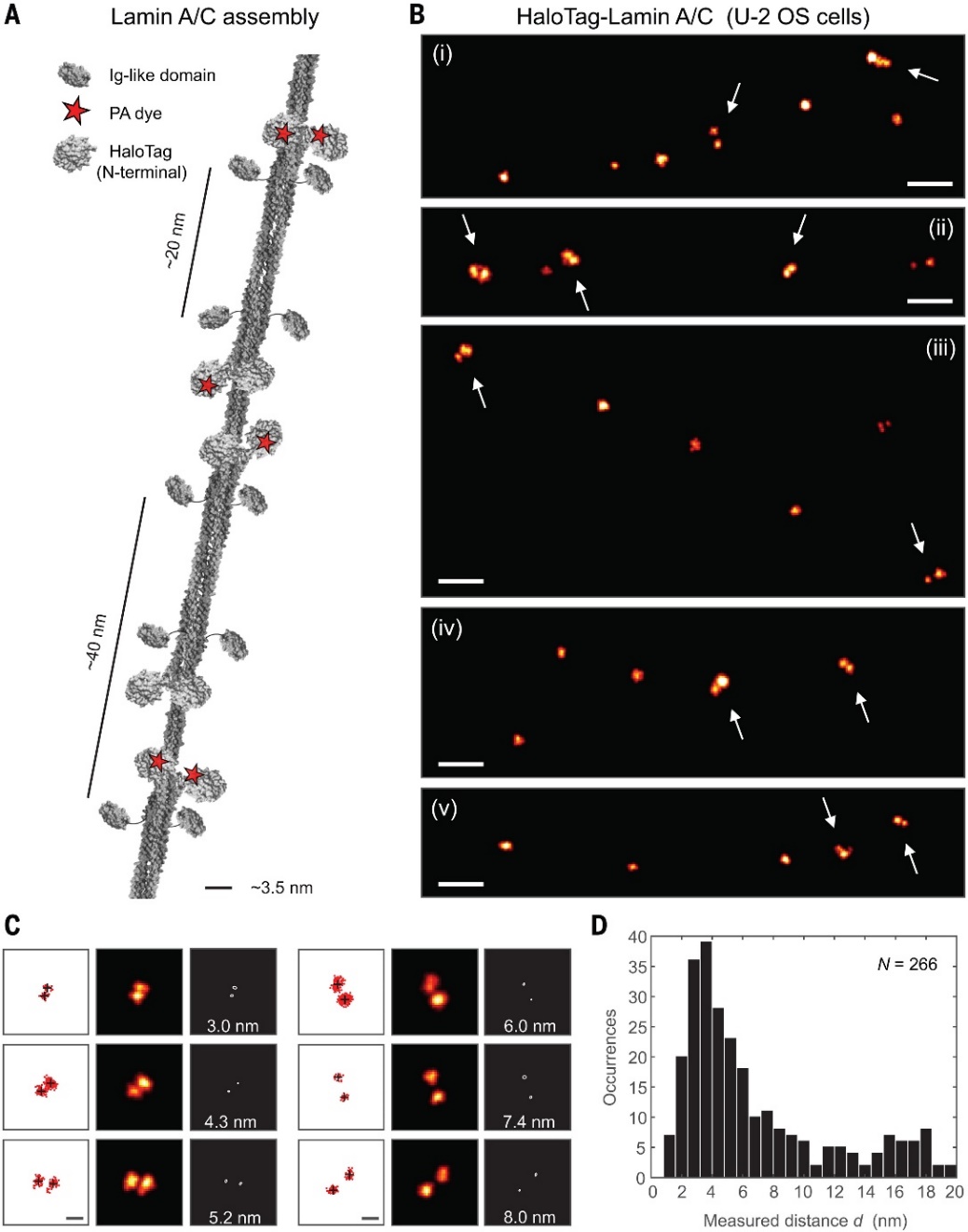
观察细胞中的蛋白分子。图片来源:Science
观察蛋白分子构象转变。图片来源:Science
“在数纳米的尺度上,小于1纳米距离的荧光基团经常相互作用,无法独立发射荧光——而这正是精确距离测量的关键条件”,Steffen Sahl说(论文一作及通讯作者),“我们已经证明,利用MINFLUX可以测量分子长度,甚至是所有荧光基团的距离,只需要确定分子在二维或三维空间中的位置即可。我们已经超越了FRET。”Stefan Hell教授补充道,“MINFLUX方法能够精确测量低至1纳米的长度,再次从根本上突破了光学显微镜的界限,有望成为结构生物学中用于研究蛋白质和其他生物分子及其相互作用的强大新工具。”[3]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Direct optical measurement of intramolecular distances with angstrom precision
Steffen J. Sahl, Jessica Matthias, Kaushik Inamdar, Michael Weber, Taukeer A. Khan, Christian Brüser, Stefan Jakobs, Stefan Becker, Christian Griesinger, Johannes Broichhagen, Stefan W. Hell
Science 2024, 386, 180-187. DOI: 10.1126/science.adj7368
参考文献:
[1] W. R. Algar, et al. FRET as a biomolecular research tool — understanding its potential while avoiding pitfalls. Nat. Methods 2019, 16, 815-829. DOI: 10.1038/s41592-019-0530-8
[2] J. Broussard, et al. Fluorescence resonance energy transfer microscopy as demonstrated by measuring the activation of the serine/threonine kinase Akt. Nat. Protoc. 2013, 8, 265-281. DOI: 10.1038/nprot.2012.147
[3] Researchers can measure distances in molecules optically
[4] F. Balzarotti, et al. Nanometer resolution imaging and tracking of fluorescent molecules with minimal photon fluxes. Science 2016, 355, 606-612. DOI: 10.1126/science.aak9913
[5] J. Xiao & T. Ha, Flipping nanoscopy on its head. Science 2017, 355, 582-584. DOI: 10.1126/science.aam5409
(本文由小希供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号