中国药科大学JMC综述 | 通过邻近诱导方式调节蛋白磷酸化以用于癌症治疗
英文原题:Modulating phosphorylation by proximity-inducing modalities for cancer therapy

通讯作者:王磊、尤启冬(中国药科大学)
作者:Qiuyue Zhang (张秋月), Jia Yu (于佳), Qidong You (尤启冬)*, Lei Wang (王磊)*
磷酸化修饰是重要的蛋白翻译后修饰之一,由激酶和磷酸酶共同负责调控。蛋白的磷酸化调控对维持细胞功能正常至关重要,该调控一旦异常,将引发各类疾病,特别是癌症。因此,开发小分子实现蛋白质磷酸化的精准调节,在药物开发方面潜力巨大。虽然传统的激酶/磷酸酶小分子调节剂取得了一定的成功,但要实现蛋白磷酸化精准调控仍然极具挑战性。除了直接靶向蛋白激酶和磷酸酶外,近年来相继出现了基于诱导拉近作用模式的嵌合体分子—磷酸化诱导嵌合体(PHICSs)和磷酸酶招募嵌合体(PHORCs,又称PhosTAC和DEPTAC)。该类嵌合体分子通过将激酶/磷酸酶招募到靶标蛋白(POI)上,加速靶标蛋白的磷酸化和去磷酸化过程,它们在POI和激酶/磷酸酶之间构建了一对一的关系,使POI的特异性去磷酸化成为可能。
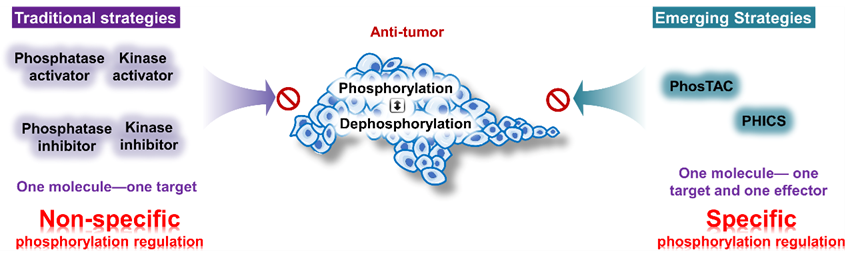
图1. 靶向肿瘤靶标异常磷酸化调控的分子设计策略
近日,中国药科大学王磊/尤启冬课题组针对基于诱导拉近作用模式调节磷酸化以促进癌症治疗的药物设计方向进行了系统性综述,发表在药物化学领域顶级期刊Journal of Medicinal Chemistry 上。中国药科大学药学院张秋月副教授、2022级硕士研究生于佳为本文共同第一作者。

图2. 通过邻近诱导方式调节蛋白磷酸化的抗肿瘤分子设计策略
该综述首次聚焦肿瘤中的异常磷酸化靶点,通过分析近45个临床热门肿瘤靶标的重要磷酸化位点,重点突出校正靶蛋白异常磷酸化在癌症治疗中的潜力。此外,本文还全面综述了靶向蛋白质磷酸化修饰的双功能分子(PTHMs)设计策略,通过分析现有PHORC及PHICS分子的设计思路及其生物活性,总结出PTHMs的“三新”机制特点——靶向新底物、新位点、新氨基酸,利用该特性,作者进一步提出one-fit-all平台策略,展望未来可通过PTHMs技术,利用一个生物效应器实现对任何靶蛋白的翻译后修饰调控。在分子设计上,基于转移化学的PTHMs分子设计,能有效克服生物效应器非抑制配体不足的瓶颈问题,为双工能分子的设计提供高效的分子设计范式,进一步展望更多的化学技术应用于PTHMs分子设计中。本文提出靶向蛋白磷酸化修饰的癌症治疗策略,并全面综述了该策略的治疗潜力,对PTHMs的未来发展也极具指导意义。
近年来,中国药科大学王磊研究员、尤启冬教授课题组主要围绕“HSP90伴侣及共伴侣系统”、“蛋白翻译后修饰的化学调控”开展靶向创新药物的研究,在HSP90-CDC37蛋白-蛋白相互作用抑制剂方向、蛋白磷酸化调控方向取得多项重要研究成果(Angew. Chem. Int. Ed. 2024.; J. Am. Chem. Soc. 2022, 145, 1118-1128; Sci. Adv. 2019, 5, eaax2277; J. Med. Chem. 2024, 67, 15080-15097; J. Med. Chem. 2024, 67, 15691-15710.)。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Modulating phosphorylation by proximity-inducing modalities for cancer therapy
Qiuyue Zhang, Jia Yu, Qidong You*, Lei Wang*
J. Med. Chem. 2024, XXXX, XXX, XXX-XXX
https://doi.org/10.1021/acs.jmedchem.4c02624
Published December 9, 2024
© 2024 American Chemical Society
导师介绍
尤启冬
https://www.x-mol.com/university/faculty/49905
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!









































 京公网安备 11010802027423号
京公网安备 11010802027423号