上海交通大学叶俊涛课题组JACS:利用双重氢原子转移策略实现内酰胺的光促去消旋化及氘代反应
去消旋化策略是立体选择性合成手性化合物最直接、最具原子经济的途径之一,但因为熵的减少和微观可逆性原理的限制,这一过程在热力学和动力学上都是不利的,因而一步实现去消旋化过程具有很大的挑战。利用光化学可以有效解决上述两个问题:一方面,光可以提供去消旋化所需的能量;另一方面,由于反应涉及激发态和基态,立体化学的破坏和重建可以在两个不同的势能面上进行,因而可以突破微观可逆性原理的限制,实现单一对映体的富集(图1a)。自从Bach课题组(Nature 2018, 564, 240)和Knowles & Miller课题组(Science 2019, 366, 364, 点击阅读详情)的开创性工作以来,光促去消旋化反应研究备受关注并取得快速发展(代表性综述:Angew. Chem. Int. Ed. 2023, 62, e202308241; Nat. Rev. Chem. 2023, 7, 35; Chem. Eur. J. 2023, 29, e202204029; J. Am. Chem. Soc. 2023, 145, 10917)。从反应机理角度来看,现有方法主要是利用能量转移(EnT)、单电子转移(SET)、配体-金属电荷转移(LMCT)等策略促进手性中心的破坏,利用氢原子转移(HAT)实现手性中心的破坏与重建的去消旋化反应仍然较少。尽管这种策略可以有效避免底物的三线态能量或氧化还原电位带来的限制,但同时也面临着巨大的挑战,即手性催化剂如果无法区分两种对映异构体,那么手性产物也会进一步反应,从而很难获得高的ee值。截至目前,仅有Bach课题组利用带有手性氢键模板的二芳基酮作为手性催化剂,在第一步攫氢反应中实现了两种对映异构体的区分,从而实现了低活性对映体的富集(图1c)。该催化体系非常简单,但不足之处在于底物需要能和催化剂通过双重氢键进行结合。
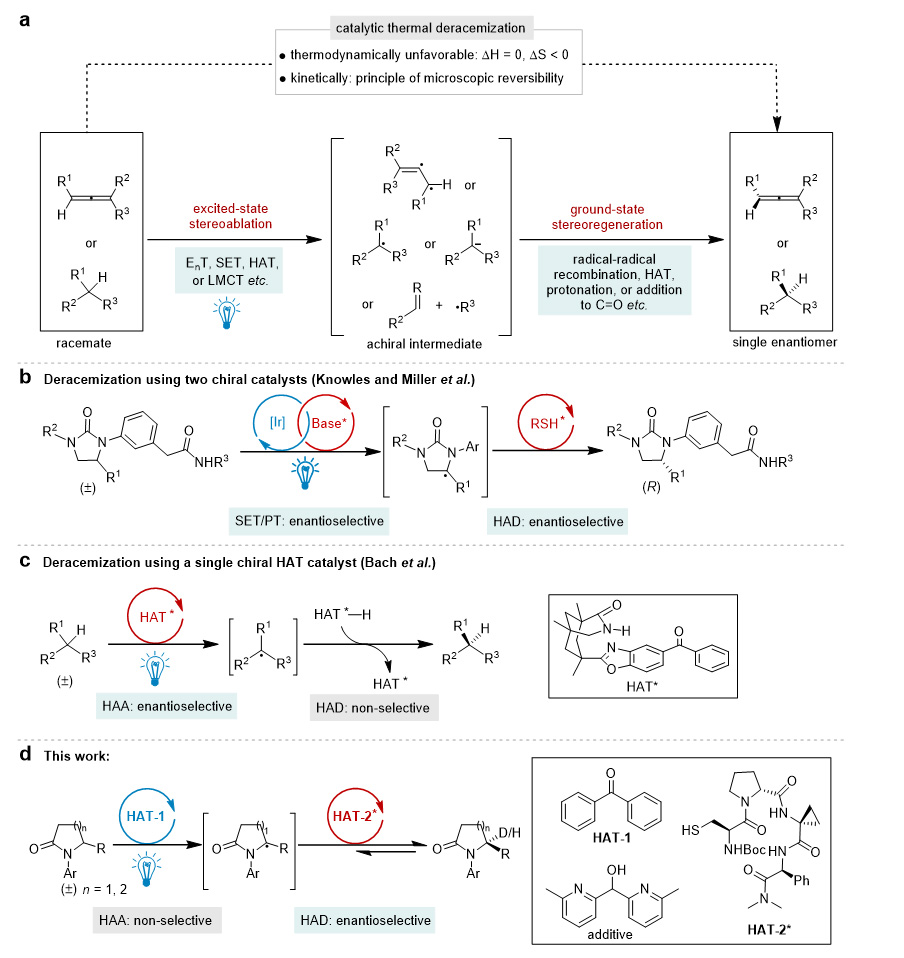
图1. 光促去消旋化反应策略。图片来源:J. Am. Chem. Soc.
上海交通大学叶俊涛(点击查看介绍)课题组在过去几年一直致力于光促氢原子转移反应的研究。在前期研究基础上,该课题组最近发展了一种新型的光促双重氢原子转移策略,成功实现了δ-和γ-内酰胺的光促去消旋化及氘代反应。该策略在第一步攫氢反应(HAA)不具有选择性,两种对映异构体都会参与反应。第二步给氢反应(HAD)利用基于多肽的手性硫醇实现立体选择性控制。这一策略不需要手性催化剂与底物结合从而区分两种构型,因而有利于发展更加广谱的去消旋化反应,但该策略的最大挑战在于手性富集的产物在反应条件下也会不断地被消耗从而使得很难获得高的对映选择性。作者发现了一种吡啶醇添加剂(A3)对反应至关重要,其不仅促进了第一步HAA,还提高了第二步HAD的对映选择性,使得反应在达到光稳态后能够实现较高的手性富集。相关研究成果近期发表于J. Am. Chem. Soc.,博士生闫晓雨为论文的第一作者。
研究初期发现,使用二苯甲酮BP作为攫氢试剂,半胱氨酸衍生的多肽硫醇作为手性给氢试剂时,反应并不能实现很好的手性富集(图2b)。为了搞清楚问题是在第一步攫氢反应未进行完全还是第二步给氢反应立体选择性较差,作者向体系加入氘水,利用产物的氘代率作为第一步攫氢反应的探针,从而指导反应条件的优化。通过筛选,作者发现带吡啶的二芳基酮BPy能够提升反应的对映选择性。进一步研究时作者意外发现真正提高反应立体选择性的物种是体系产生的副产物A1。最终作者发现以A3作为添加剂,二苯甲酮(BP)作为攫氢试剂,S2作为手性给氢试剂时,能够以95:5 er和95% D获得目标产物(图2c)。
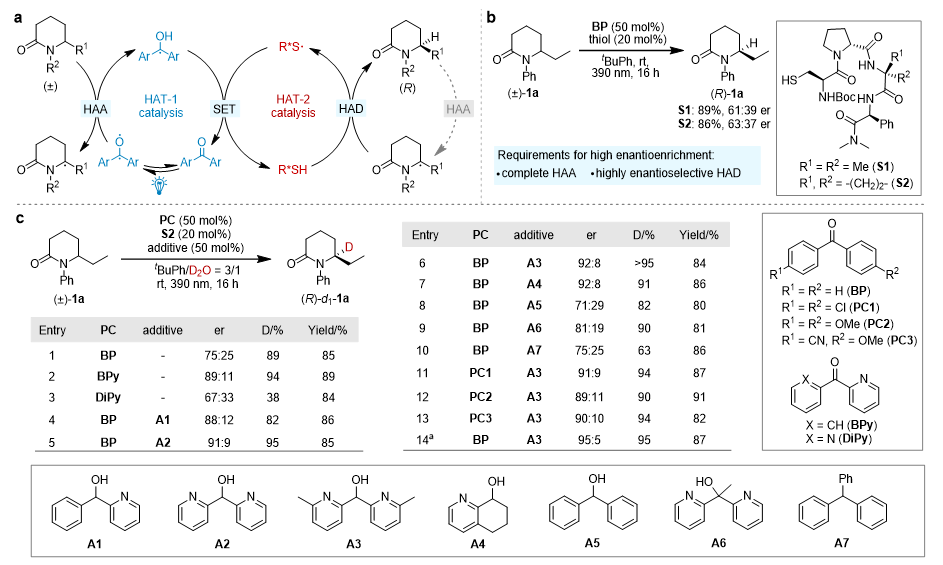
图2. 光促去消旋化反应的优化。图片来源:J. Am. Chem. Soc.
在上述反应条件下,作者对反应底物的适用性进行了考察(图3)。结果表明,反应对于苯基上含有不同取代基以及立体中心含有不同烷基侧链的δ-和γ-内酰胺均有很好的兼容性,都可以以中等到良好的对映选择性和优秀的氘代率得到目标产物。此外,将氘水更换为水,发现产物的对映选择性基本保持不变或者仅有略微降低。
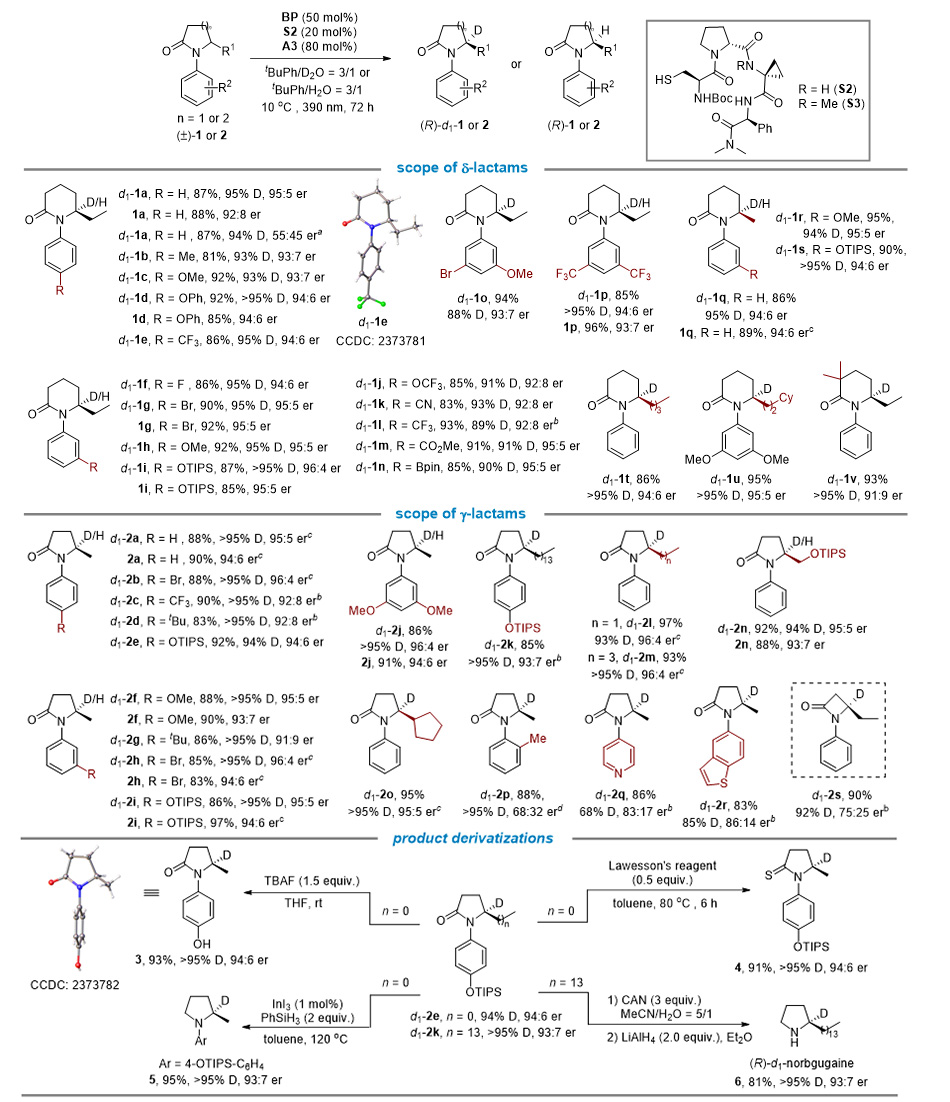
图3. 光促去消旋化反应的底物范围。图片来源:J. Am. Chem. Soc.
基于一系列的机理研究实验,作者提出了可能的反应机理:BP经光激发后,形成三线态双自由基Ⅰ,该自由基攫取底物中氨基α位的C−H键生成自由基Ⅱ以及前手性自由基中间体Ⅲ。随后中间体Ⅲ与原位生成的氘代硫醇发生立体选择性的氘原子转移反应,生成手性目标产物,同时生成的硫自由基Ⅴ会与添加剂A3发生快速氢原子转移,重新再生硫醇催化剂,并生成α-羟基自由基Ⅳ,该自由基与Ⅱ通过单电子转移/质子转移或质子耦合电子转移(PCET)再生攫氢试剂BP和添加剂A3(图4)。
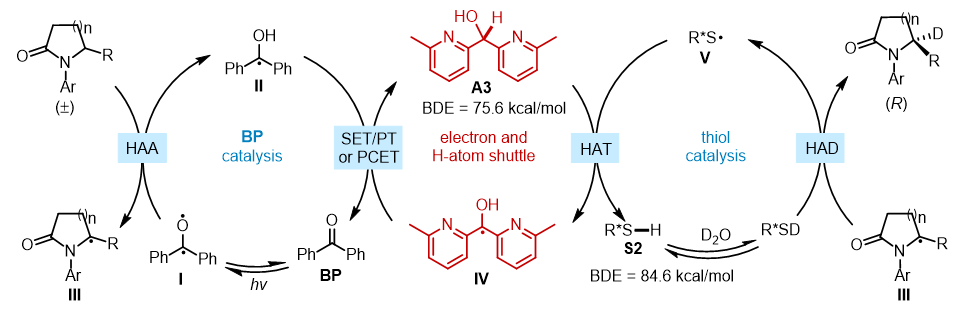
图4. 可能的反应机理。图片来源:J. Am. Chem. Soc.
值得一提的是,当反应未添加A3时,自由基Ⅱ很容易发生二聚从而消耗体系的攫氢试剂BP,导致反应难以获得很高的手性富集。当反应加入添加剂A3后,其可以作为电子和氢原子中介,促进BP和硫醇的催化循环,有效抑制自由基Ⅱ的二聚,从而促进第一步攫氢反应发生完全。此外,添加剂A3还可以通过氢键作用与手性硫醇结合,从而提高第二步给氢反应的立体选择性。因此,添加剂A3在第一步攫氢反应和第二步给氢反应中都起到了至关重要的作用。
小结
叶俊涛课题组通过光促双重氢原子转移策略实现了δ-和γ-内酰胺的光促去消旋化及氘代反应。反应中的吡啶醇作为关键添加剂,不仅促进了第一步攫氢反应,还提高了第二步给氢反应的对映选择性,使得反应在达到光稳态后能够实现较高的手性富集。可以预见,这种光促双重氢原子转移策略有可能适用于更多含有C−H键或杂原子−H键的手性中心的去消旋化反应。
本研究工作得到了国家自然科学基金(No. 22371180)以及上海交通大学启动经费的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical Deracemization of Lactams with Deuteration Enabled by Dual Hydrogen Atom Transfer
Xiaoyu Yan, Yubing Pang, Yutong Zhou, Rui Chang and Juntao Ye*
J. Am. Chem. Soc. 2024, DOI: 10.1021/jacs.4c14934
导师介绍
叶俊涛课题组
https://www.x-mol.com/groups/Ye_Juntao
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号