上海有机所/上海交通大学丁奎岭团队JACS:Ru/SKP催化稠杂芳烃的碳环选择性氢化
芳烃和杂芳烃结构丰富易得,其催化氢化能以简单直接且原子经济的方式高效合成饱和或部分饱和的富含sp3碳原子的环状化合物。其中,稠杂芳烃是这类反应的重要底物,通过过渡金属催化氢化反应可一步构建各类广泛存在于天然产物和生物活性分子中的杂环结构。然而,由于稠杂芳烃结构中可并存碳芳环和杂芳环及各类取代基,相关催化氢化反应常面临多重选择性控制的难题。一方面,异相催化的稠杂芳烃氢化通常得到碳芳环和杂芳环完全还原的产物。另一方面,目前稠杂芳烃均相催化氢化反应研究报道中绝大部分得到杂环氢化的还原产物。这主要是因为在苯并杂芳环结构中,苯环单元通常具有更强的芳香性,其氢化反应需要克服更高的动力学能垒。另外,苯环单元缺乏杂原子等次级配位点协助配位活化。因此,例如喹啉这样的苯并氮杂环均相催化氢化大多得到1,2,3,4-四氢喹啉,而相应的苯环部分氢化则较为困难。在苯并杂芳烃均相催化氢化反应中,如何通过催化剂的介导克服底物芳香性并区分立体特性相似的碳/氮芳环,从而实现高碳环选择性和立体选择性的部分加氢还原,仍是一个富于挑战性的难题(图1)。
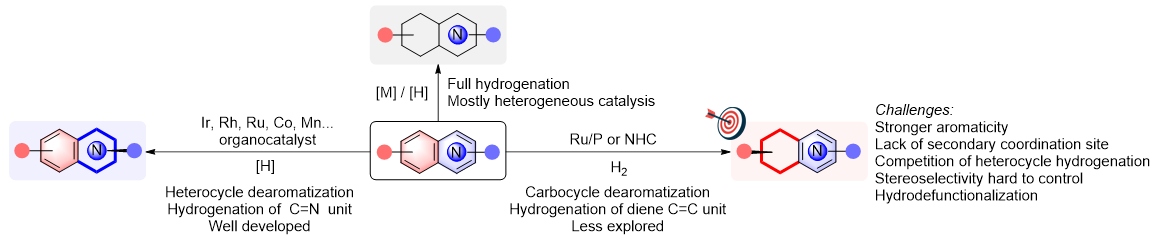
图1. 稠杂芳烃的选择性氢化反应。图片来源:J. Am. Chem. Soc.
中国科学院上海有机化学研究所金属有机化学国家重点实验室丁奎岭(点击查看介绍)课题组长期致力于新型手性配体和高效过渡金属催化剂的开发。其中,他们设计合成的手性芳香螺缩酮骨架双膦配体SKP已在Pd、Cu、Rh、Au、Ni等过渡金属催化的一系列不对称反应中展现了优秀的催化活性及选择性(Angew. Chem. Int. Ed. 2012, 51, 936-940; Angew. Chem. Int. Ed. 2012, 51, 9276-9282; J. Am. Chem. Soc. 2014, 136, 405-411; J. Am. Chem. Soc. 2015, 137, 15346-15349; Angew. Chem. Int. Ed. 2017, 56, 1116-1119; Angew. Chem. Int. Ed. 2017, 56, 5050-5054; Acc. Chem. Res. 2021, 54, 668-684; J. Am. Chem. Soc. 2024, 146, 18440-18450)。近日,他们使用SKP为配体,成功实现了钌催化的喹啉、异喹啉和喹喔啉等稠杂芳烃的碳环选择性不对称氢化,并进而通过广泛的实验研究和理论计算揭示了相关反应的机理和选择性根源(图2)。
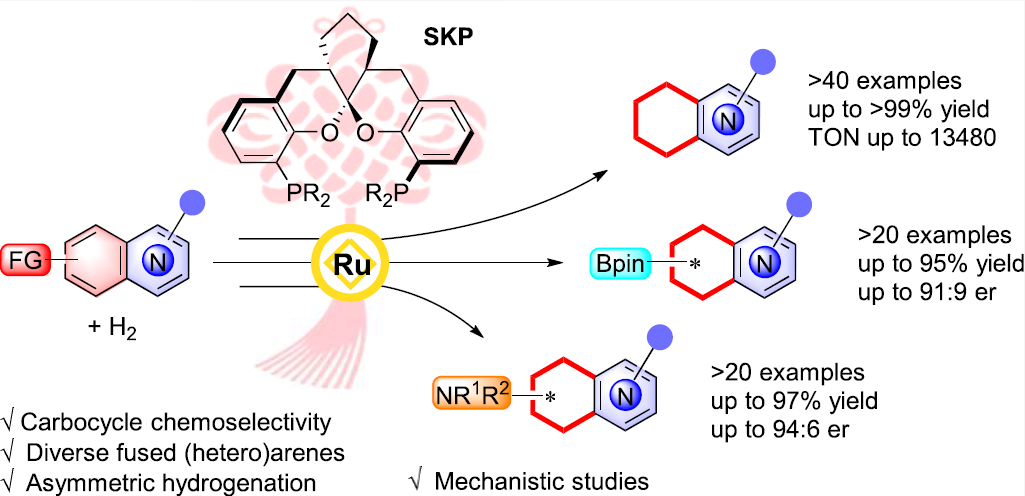
图2. Ru/SKP催化稠杂芳烃的化学选择性不对称氢化。图片来源:J. Am. Chem. Soc.
在条件优化中,作者选用喹啉作为模板底物,以Ru(methallyl)2(cod)为钌前体,对配体类型进行了较广泛的考察。当使用Ph-SKP时,氢化反应以>99:1的碳环选择性和几乎定量的收率得到5,6,7,8-四氢喹啉。在相同反应条件下,一些其它骨架的商业化配体则仅展现出相对较低的化学选择性及反应活性,表明喹啉氢化反应的碳环选择性与催化剂的配体结构密切相关(图3)。
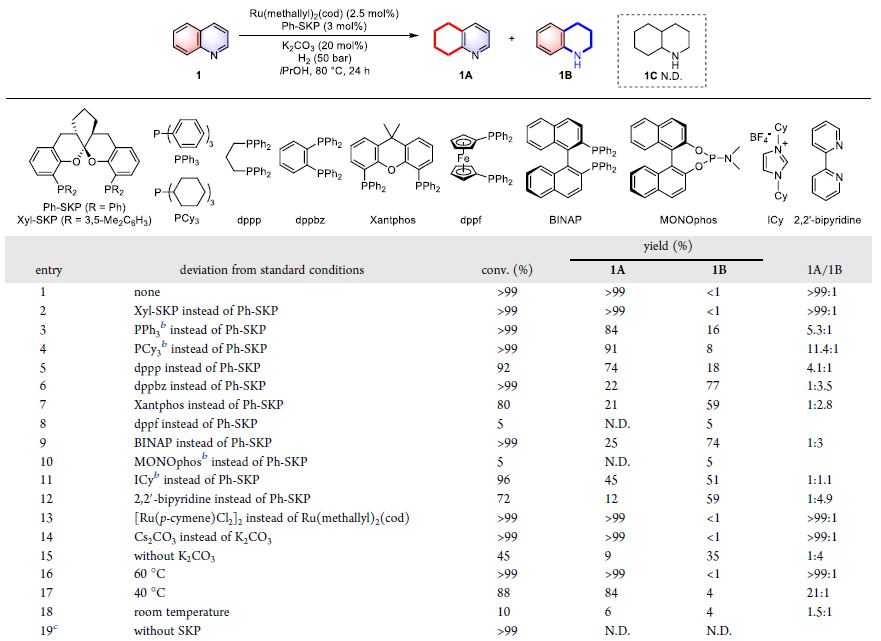
图3. 喹啉氢化的反应条件优化。图片来源:J. Am. Chem. Soc.
随后,作者将该Ru/SKP催化体系拓展应用于一系列结构各异的稠(杂)芳烃的选择性部分氢化反应,特别是对于常见的异喹啉、喹喔啉和萘等二元稠芳环底物,相应的反应均以>99%的收率得到相应碳环氢化的四氢产物。对于蒽、菲、吖啶等三元稠环,主要得到两侧碳环被氢化而中间芳环保留的产物。另外,反应还兼容氮环或苯环单元不同位置带有取代基的稠环底物(图4),展现了该体系广阔的适用范围。
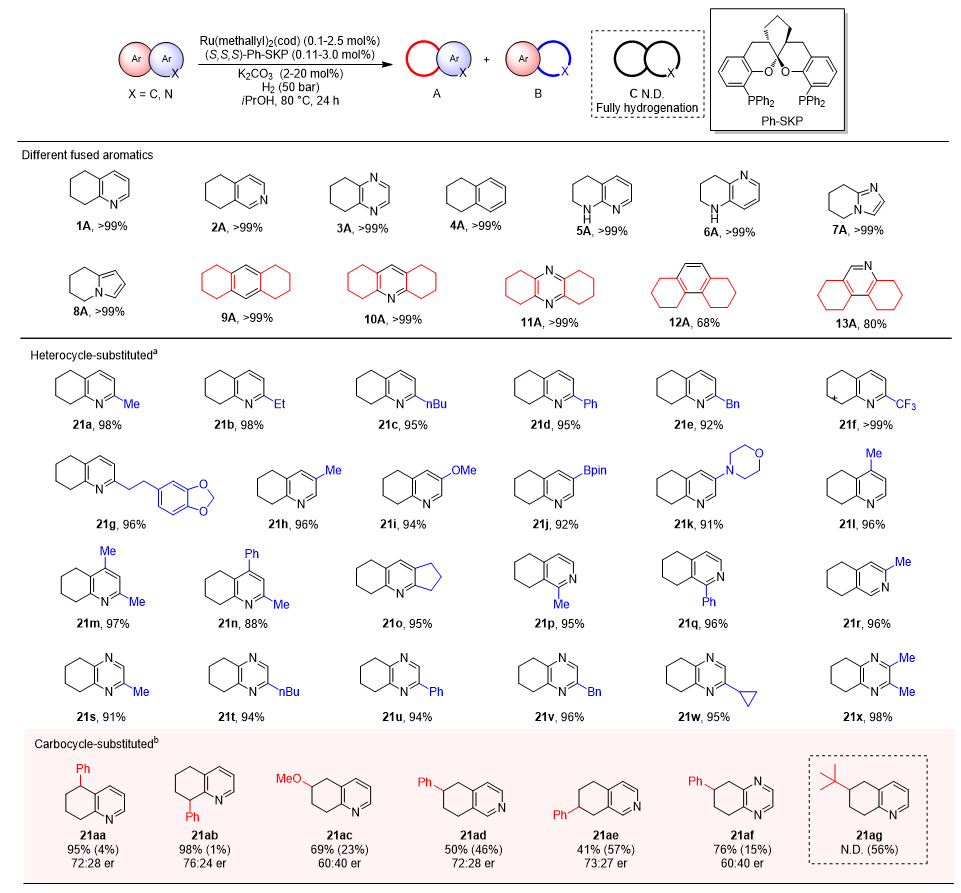
图4. 各种类型的简单稠(杂)芳烃的适用范围。图片来源:J. Am. Chem. Soc.
含sp2C-B键的芳基硼类化合物较易获得,通过芳基硼的氢化反应可以直接得到相应的含sp3C-B键的环烷基硼产物。后者是一类重要的合成子,通过官能团转化和偶联等后期化学修饰可方便获得多类碳(杂)环衍生物,在合成化学中有广泛应用价值。采用相同的SKP/Ru催化体系,作者进一步发展了各种硼基取代喹啉的不对称氢化,以良好的碳环氢化选择性和最高达90:10 er的对映选择性得到6位或7位硼代的5,6,7,8-四氢喹啉产物(图5)。
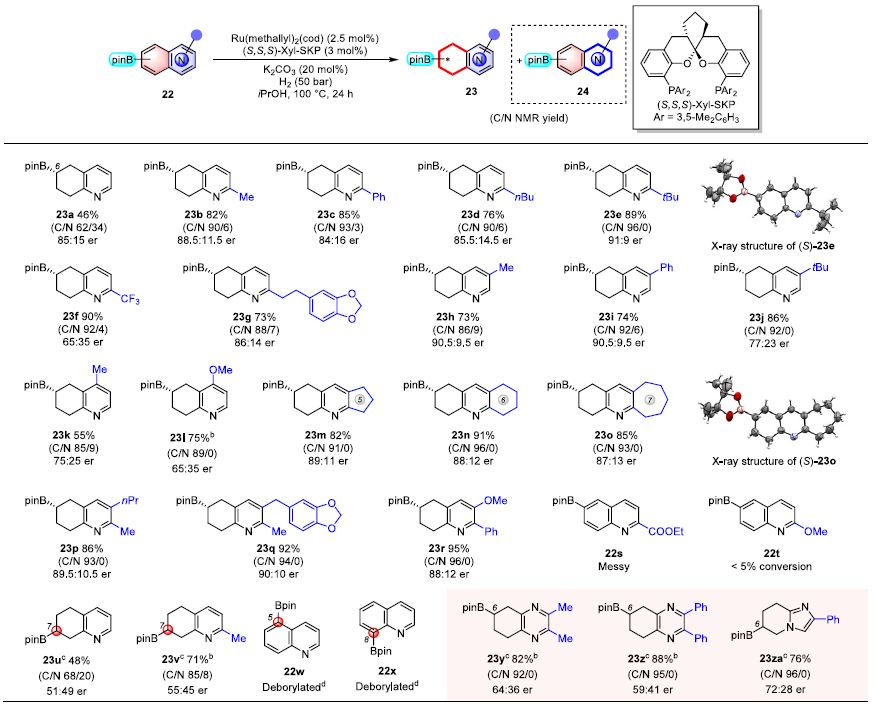
图5. 碳环硼基取代的苯并氮杂芳烃的不对称氢化。图片来源:J. Am. Chem. Soc.
手性胺是药物和生物活性分子中一类常见的结构单元。作者仍采用Ru/SKP体系,通过胺基取代的苯并氮杂芳烃的碳环选择性不对称氢化,合成了一系列以5-胺基取代5,6,7,8-四氢异喹啉为主的手性环外胺,对映选择性可达94:6 er(图6)。通过烯胺28 的氢化控制实验,确认了烯胺并非该氢化反应的中间体。
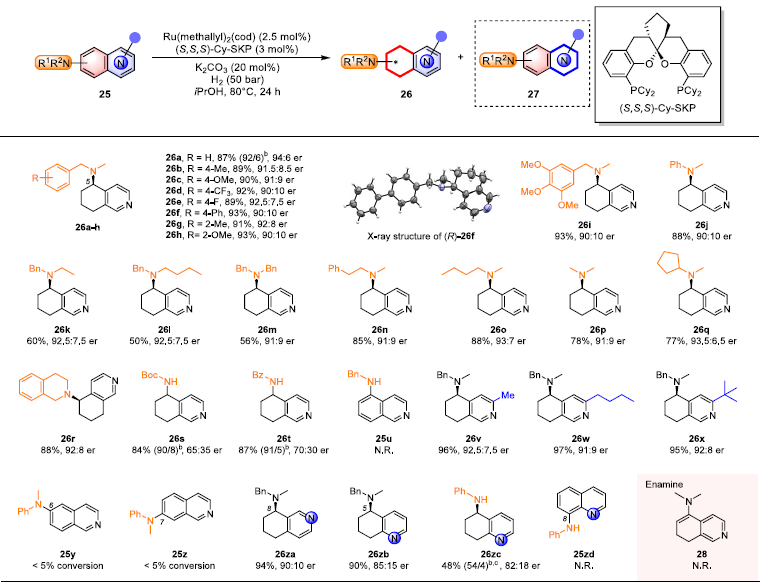
图6. 胺基取代的苯并氮杂芳烃的化学选择性不对称氢化。图片来源:J. Am. Chem. Soc.
随后,作者通过克级反应和衍生化研究展示了该氢化方法的合成应用价值(图7)。对于喹啉的氢化,Ru/SKP催化剂用量可以降低至两万分之一,TON 最高达13480。硼代产物23e可以方便地转化为含有多种不同官能团的5,6,7,8-四氢喹啉衍生物。这些结果表明,该方法有望作为一种通用的5,6,7,8-四氢喹啉砌块合成新路径,在药物分子和天然产物的合成及修饰中得到进一步应用。
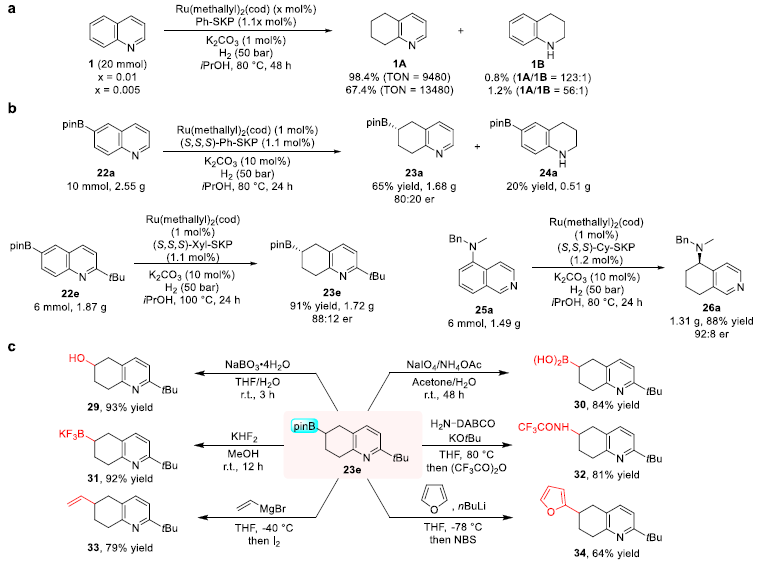
图7. 合成应用研究。图片来源:J. Am. Chem. Soc.
目前关于全碳芳环氢化反应的机制研究仅有零星报道,且相关反应路径的很多细节尚不明晰,这也是限制该反应发展的重要原因。作者通过物种鉴定、非线性效应、氘标记、均相/异相对照控制、以及核磁监测表征等一系列的机理实验研究,证实了当前的Ru/SKP催化氢化反应为均相的分子催化过程,并推测反应的活性物种可能为(κ2-SKP)RuH2(H2)2,进而提出了基于碳芳环η4-配位活化机制的催化循环(图8)。
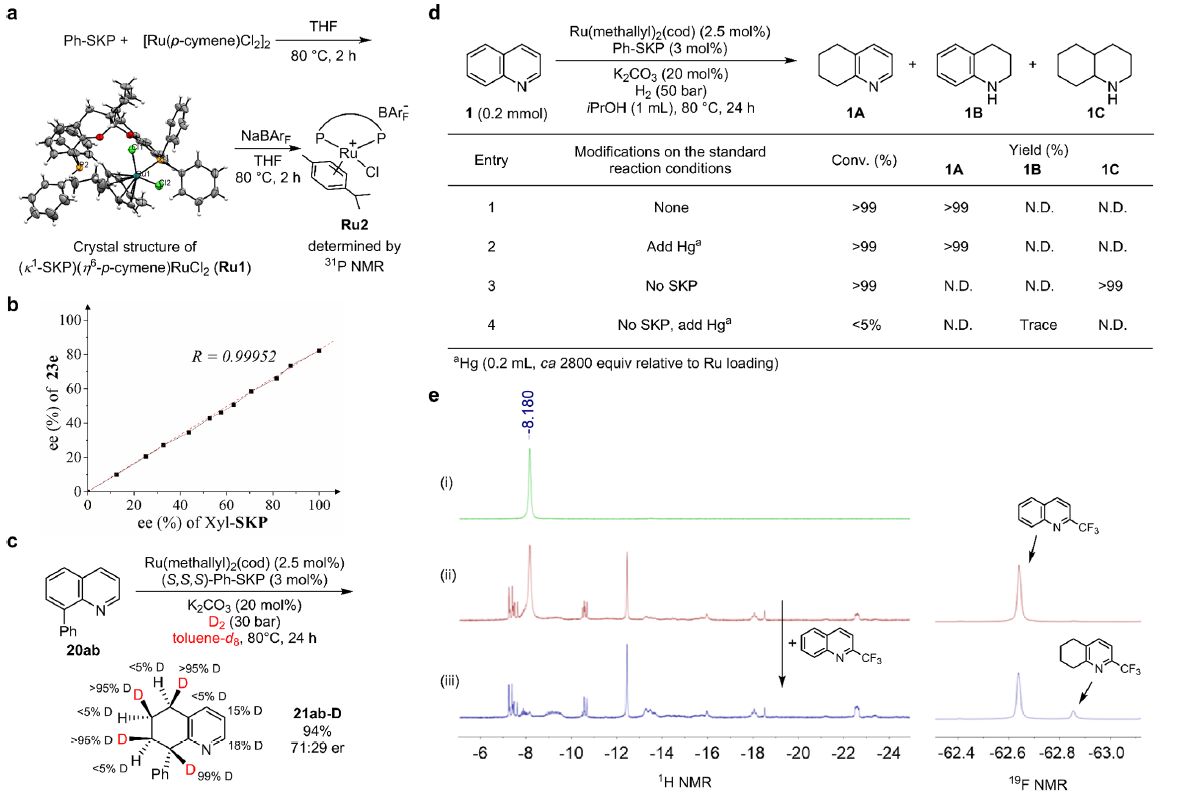
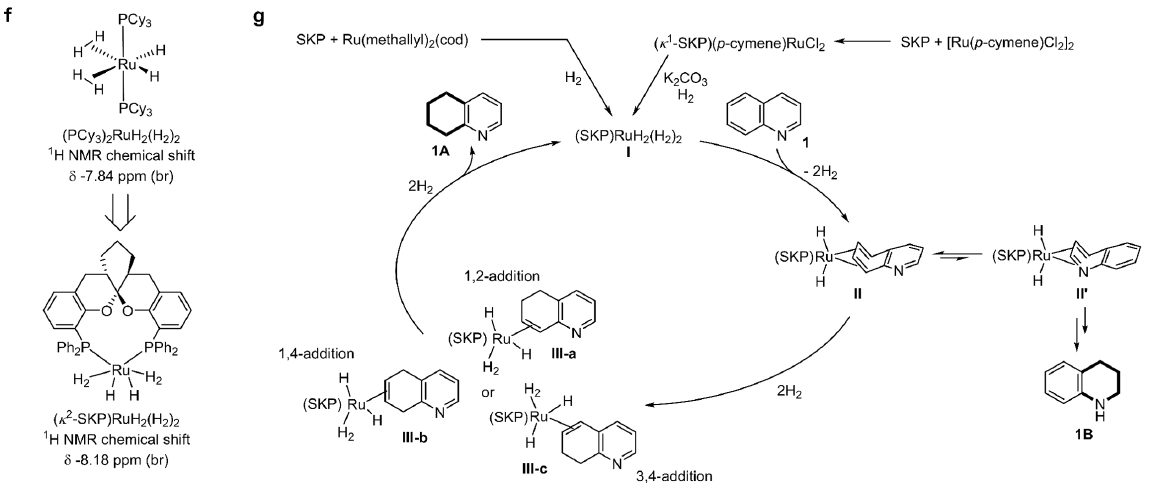
图8. 反应机理实验研究。图片来源:J. Am. Chem. Soc.
在此基础上,作者还利用密度泛函方法(DFT)对SKP/Ru催化喹啉碳环选择性氢化反应的历程进行了较为细致的理论计算研究。计算结果表明,喹啉通过其碳环与Ru中心配位形成η4-络合物,实现其苯环单元的去芳构化活化。后续的氢气分子活化和碳环加氢分步有序进行,均在催化剂Ru中心的介导下顺利发生。喹啉碳环氢化并存一系列竞争反应路径,其中最有利的反应路径最高自由能势垒为25 kcal/mol,表明反应可在较低的温度下发生,与实验研究结果一致。氮环与碳环二者氢化的关键过渡态最高能垒差为3.7 kcal/mol,契合了实验中观察到的>99:1的碳/氮氢化产物比值;而限速步骤过渡态中富电子碳环单元对高价态Ru(IV)中心的稳定化,是碳环氢化选择性的根源。另外,对催化进程中一系列中间体和过渡态的结构分析表明,SKP配体的自适应性对于反应的成功尤为,使得加氢过程中喹啉碳环可围绕钌中心顺利旋转和滑移,而不需要催化剂骨架产生过度形变导致较大的能量代偿。这可能是SKP区别于一般刚性结构配体,能实现这一独特化学选择性的关键因素(图9)。
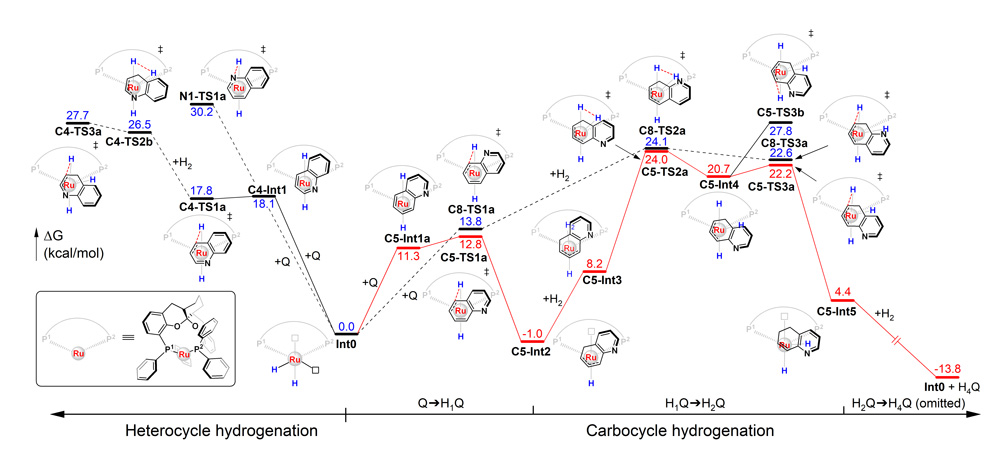
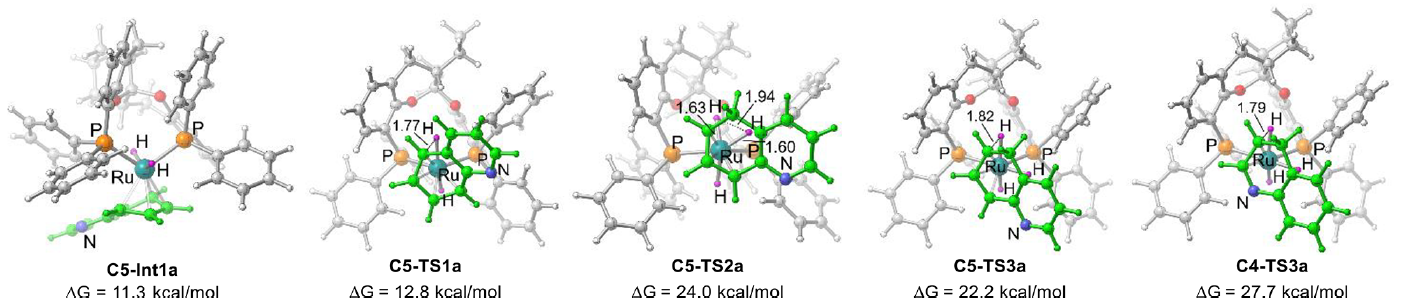
图9. SKP/Ru催化喹啉碳环选择性氢化的DFT计算研究。图片来源:J. Am. Chem. Soc.
综上所述,作者成功实现了芳香螺缩酮骨架双膦配体SKP 与钌催化稠杂芳烃的化学选择性氢化,以优异的活性(TON 高达13480)得到喹啉和异喹啉等分子中碳芳环加氢产物。在碳环硼化喹啉和氨基异喹啉的不对称氢化中,该催化体系还表现出良好的手性控制能力(高达94:6 er),显著拓宽了此类反应的底物适用范围。作者还结合实验探索与理论计算深入探究了该催化反应的机理历程,并揭示了双膦配体SKP的自适应结构特征在反应进程中起到关键作用。这项工作丰富了芳烃的均相催化氢化反应化学,并将进一步促进稠杂环碳环选择性氢化研究,最终使这类转化成为合成化学中便捷有用的工具。
这一成果近期以全文的形式发表于J. Am. Chem. Soc.上,文章的第一作者是上海有机化学研究所的博士研究生罗晨光。该工作得到了科技部、国家自然科学基金委、上海市科委、上海有机所以及金属有机化学国家重点实验室的大力资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ruthenium-Catalyzed Carbocycle-Selective Hydrogenation of Fused Heteroarenes
Chenguang Luo, Chaozheng Wu, Xiaoming Wang, Zhaobin Han,* Zheng Wang,* and Kuiling Ding*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c05365
导师介绍
丁奎岭
https://www.x-mol.com/university/faculty/15586
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号