Nature:C-N键形成的新机理——光酶催化烯烃氢胺化反应
氮杂环结构广泛存在于天然产物、药物分子和农用化学品等中,据统计59%的目前已获批上市的小分子药物中都含有氮杂环。因此,如何高效、简便地构建C-N键已成为现代合成化学中不可或缺的一部分。尽管烯烃与未活化胺的氢胺化反应对于构建C-N键来说原子经济性非常让人满意,但是通过1,1-二取代烯烃与胺的马氏氢胺化来不对称构建α-叔胺却并非易事。另外,虽然过渡金属是最常见的氢胺化催化剂,但是其难以构建大位阻键;小分子催化的自由基氢胺化反应具有良好的官能团耐受性(图1a),但是仅形成反马氏产物且难以实现C-N键的不对称构建。近来,化学家发现Brønsted酸催化剂可以催化这种转化,但是反应的官能团耐受性较差,而且需要具有导向基团的失活胺来实现对映选择性。相比之下,酶是化学合成的理想催化平台,可利用活性中间体和蛋白质之间的共价和非共价相互作用促进化学转化,反应的选择性无与伦比,能实现辅因子或极简蛋白无法实现的反应机理。然而,目前还没有已知的生物催化剂能够实现未活化胺和烯烃的氢胺化反应。
近年来,美国普林斯顿大学的Todd K. Hyster教授课题组利用黄素依赖性“烯”还原酶实现了各种C-C、N-C和C-O成键反应。在此前基础上,Hyster教授课题组近日利用光酶催化策略成功地实现了烯烃的氢胺化反应(图1b),以中等至较好的产率和优异的对映选择性制备了一系列手性2,2-二取代吡咯烷衍生物。更让他们非常意外的是,实验和计算研究表明该反应经历了一种全新的C-N键形成机理,即利用还原生成的苄基自由基与氮原子孤对电子之间的空间相互作用促进了C-N键的构建。相关成果发表在Nature 上。
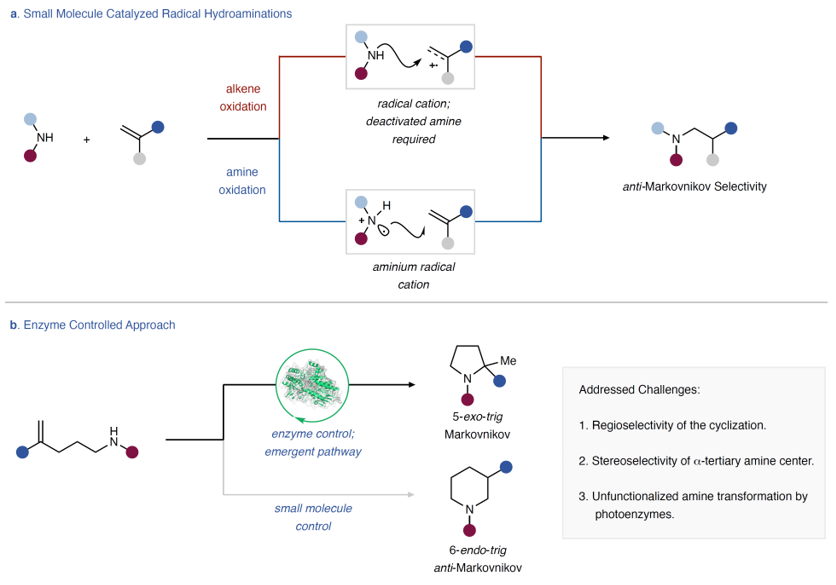
图1. 背景简介。图片来源:Nature
首先,作者选择烯基胺1为模板底物对分子内氢胺化反应条件进行筛选(图2a),发现醋酸钙不动杆菌(AcCHMO)的环己酮单加氧酶可以1%的产率和55:45 e.r.值获得5-exo-trig氢胺化产物2,而非6-endo-trig产物3。对照实验表明CHMO和光至关重要,并且游离的FAD不能促进这种转化。进一步对CHMO同源物库的筛选发现奥美拉唑亚砜酶(AcCHMO-M10)可以12%的产率和55:45 e.r.值获得产物2。随后,作者利用迭代位点饱和突变(ISM)进行蛋白质工程化(图2b、2c),结果显示R490E、C326H、I491T和A479H突变能以97%的产率和95:5 e.r.值获得产物2。另外,分子动力学(MD)模拟显示三个远端突变(R490E、I491T、A479H)位于一个动态环区(残基475-510),这是通往酶活性位点的通道(图2d),并且R490E、I491T和A479H突变很可能在保持活性位点开放和底物接近方面发挥着重要作用,进而导致产率有所提高(15-30%)。值得一提的是,将催化剂负载量降低至0.04 mol%并在无细胞透析裂解物中进行反应时仍能以适当的产率(15%,TON=436)和95:5 e.r.值获得产物2;而在未透析裂解液(1 mol%)中进行反应时产物的对映体比例降低(93:7)。
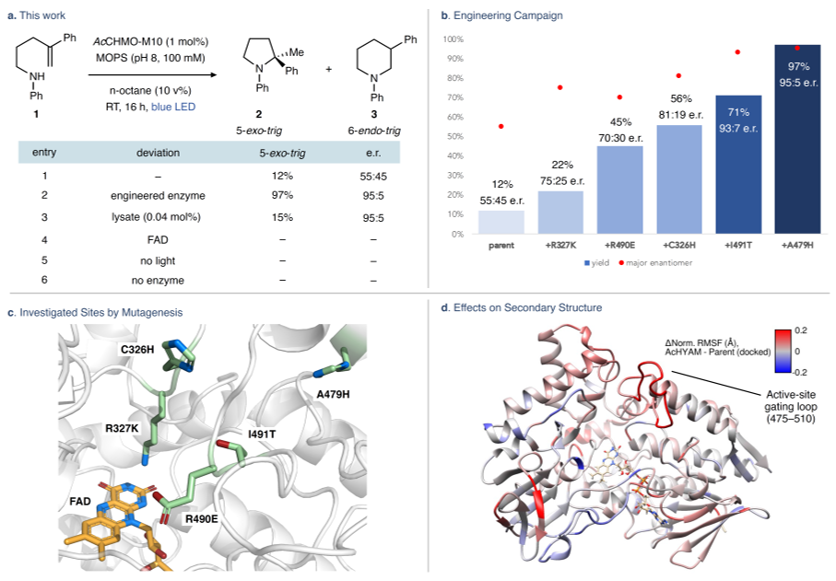
图2. 条件筛选。图片来源:Nature
接下来,作者选择AcHYAM(HYdro AMinase)为酶催化剂对该反应的底物范围进行了考察(图3),结果显示苯环上各种吸/缺电子基团取代的苯胺(2-12)和苯乙烯(13-22)均能兼容该反应,以中等至优异的产率和对映选择性获得相应产物,并且富电子芳烃的产率和选择性更好(2、4-10、13-20)。值得一提的是,苯胺(10)和苯乙烯部分(19)上带有大位阻取代基(如:萘)时并不影响反应的产率和对映选择性,甚至缺电子含氮杂环也能实现这一转化(11-12、21),进而克服Brønsted酸催化环化的局限性。尽管环化反应对杂环取代基十分敏感并且在某些情况下严重受阻,但是蛋白质工程可能会克服这些局限性,例如:同源底物可以进行6-exo-trig环化并以13%的产率和78:22 e.r.值获得产物22;而使用光氧化还原催化剂时此类底物通常会在环化过程中经历1,5-HAT过程。另外,该方法还可以制备三种含芳基吡咯烷原料药的α-甲基化类似物,包括:TRK抑制剂GNF-862541的甲基化吡咯烷片段24(产率:85%、94:6 e.r.)、原肌球蛋白抑制剂Larotrectinib的α-甲基修饰片段26(产率:77%、75:25 e.r.)及其相关结构25(产率:25%、73:27 e.r.)。
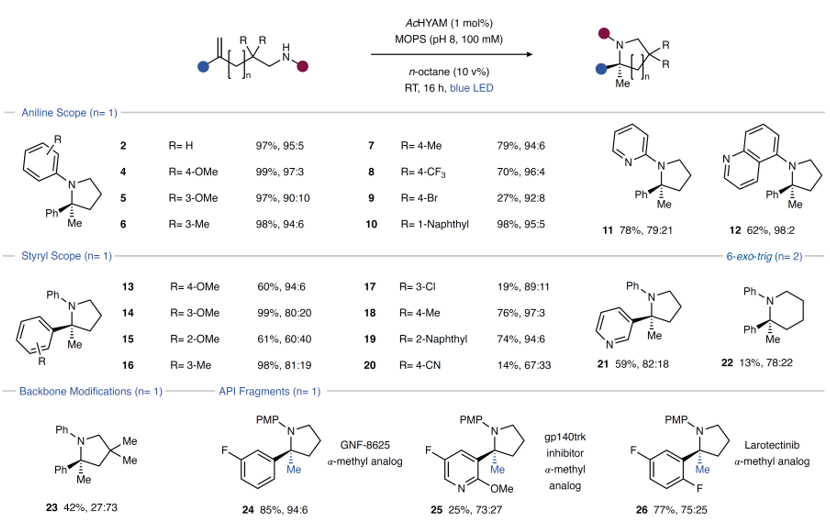
图3. 底物拓展。图片来源:Nature
为了进一步探究反应机理,作者进行了一系列实验。具体而言:1)对诱导期的观察表明氧化黄素没有引发自由基,而是需要光还原才可发生反应;2)用连二亚硫酸钠预还原酶进行模型反应时以74%的产率和95:5 e.r.值获得产物,而且酶被连二亚硫酸盐还原时产生的UV-Vis光谱与酶被缓冲液光还原时观察到的一致,这表明两种条件下产生相同的黄素氧化态;3)观察到的诱导期是由于需要将FAD光还原为FADhq,进而表明反应是从辅因子的还原形式开始的。综上,这些结果排除了氮中心自由基作为反应中间体,并且只有氧化性光催化剂才能形成此物种。其次,作者研究了还原黄素能否作为能量转移催化剂促进反应,即将相关的裂解底物置于酶反应条件下并利用GC-MS和NMR对样品进行分析后没有观察到碎裂的证据,进而表明能量转移机理不太可能,因此作者得出结论:FADhq*(E0=-2.26 V vs SCE)还原烯烃时引发自由基(图4a)。虽然此电位不足以还原底物(α-甲基苯乙烯Ered=-2.6 V vs SCE),但是正电活性位点可以减弱烯烃还原所需的电势,同时稳定生成的半醌态黄素阴离子(FADsq-,图4b),而且由此产生的自由基阴离子碱性极强,进而导致快速和不可逆的质子化并生成苄基自由基。如图4c所示,带有其它亲核物种的底物(如:伯醇27、烷基胺28和甲基取代的烯烃衍生物29)在标准条件下均不反应,这说明苄基自由基被氧化为相应的苄基阳离子后无法参与反应,此结果与三级碳正离子不一致,进而表明π-π堆叠相互作用是反应进行所必需的。此外,作者还利用密度泛函理论(DFT)计算了预组织中间体的前沿分子轨道构型(图4d),结果表明苄基自由基和苯胺氮原子之间的相互作用会影响氧化还原过程,即两者之间的超共轭作用可以有效增加SOMO轨道的能量,使自由基更容易被氧化。由于FADsq-没有足够的氧化性(E0=-0.25 V vs SCE),因此无法从相应的自由基(Eex =0.16 V vs SCE)产生苄基碳正离子。
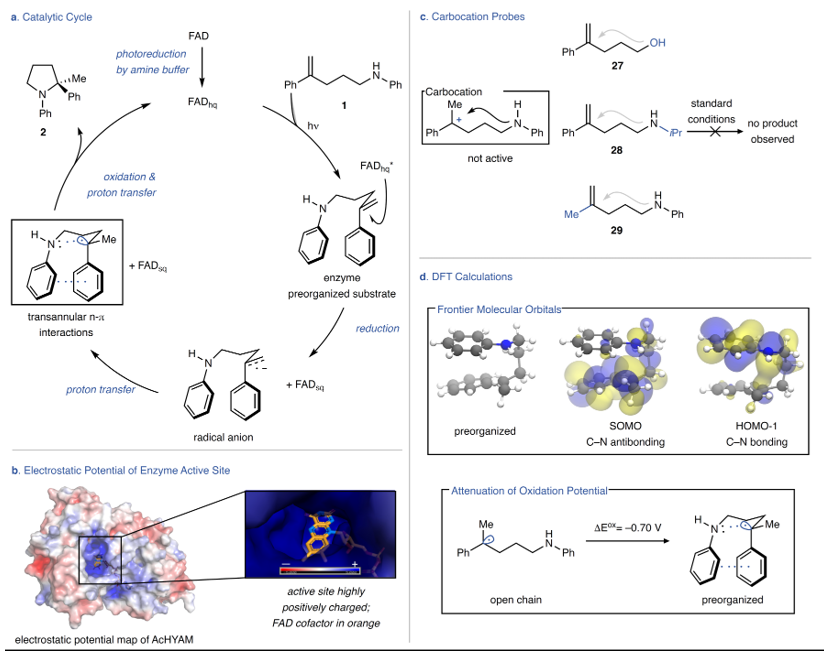
图4. 机理研究。图片来源:Nature
根据实验结果和机理研究,作者认为该酶促氢胺化反应机理与小分子催化途径不同,即该机理主要依赖于二中心三电子反键中间体的相互排斥作用以减弱酶活性位点内自由基的氧化电位。另外,MD模拟表明相对于母体酶,AcHYAM环境为模型底物提供了更多的旋转自由度,而且AcHYAM中的底物构象与DFT研究的预组织构象相似(图5a)。由于底物主要在亲本酶中呈现延伸构象,因此催化位点附近的突变(即R327K、C326H)可能会增强构象灵活性。综上,作者认为新的旋转自由度允许底物进入工程化AcHYAM环境,进而形成重要的构象来构建C-N键。事实上,当用光催化剂10-苯基吩噻嗪进行光氧化还原反应时没有观察到5-exo-trig产物(图5b);而在硫醇催化剂的存在下进行相同反应时能以34%的产率获得烯烃还原产物,这说明虽然10-苯基吩噻嗪能将烯烃还原为自由基阴离子,但不能构建C-N键,进而表明酶对于该反应至关重要。
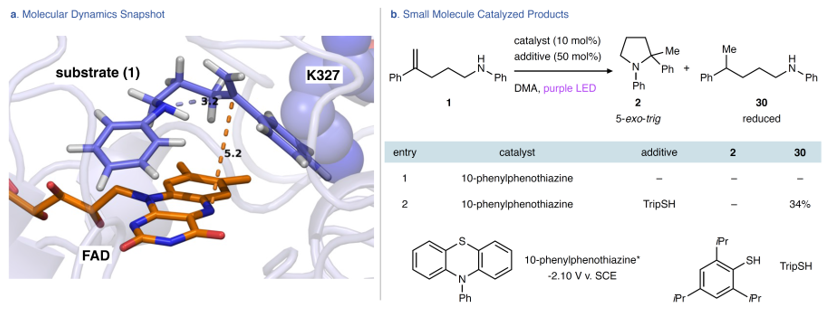
图5. MD模拟及小分子催化。图片来源:Nature
总结
Hyster教授课题组利用光酶催化策略成功地实现了烯烃的氢胺化反应,以中等至较好的产率和优异的对映选择性合成了一系列手性2,2-二取代吡咯烷衍生物。让人意外的是,实验和计算研究表明该反应经历了一种全新的C-N键形成机理,即利用还原生成的苄基自由基与氮原子孤对电子之间的空间相互作用促进了C-N成键反应。该方法不仅突出了酶在新型反应中的潜力,还为解决化学合成中的挑战提供了独特的视角。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Emergence of a distinct mechanism of C–N bond formation in photoenzymes
Felix C. Raps, Ariadna Rivas-Souchet, Chey M. Jones, Todd K. Hyster
Nature, 2024, DOI: 10.1038/s41586-024-08138-w
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号