湖南大学黄晋Adv. Sci.:顺序激活的智能DNA纳米球用于光免疫疗法和免疫检查点阻断
由于癌细胞固有的免疫抑制和免疫逃避,将光免疫疗法与免疫检查点阻断相结合,利用光疗和免疫增强,克服相互限制并显示出显著的抗癌潜力。主要挑战包括药物的非特异性积累、不受控制的激活和药物载体的安全性。近期,湖南大学化学化工学院黄晋教授(点击查看介绍)课题组开发了一种能够顺序激活的智能DNA纳米球,用于光免疫治疗和免疫检查点阻断。这项研究拓宽了DNA纳米材料在精准药物递送和肿瘤治疗中的应用。相关研究成果发表在Advanced Science,论文的第一作者为博士研究生陈余,通讯作者为湖南大学化学化工学院黄晋教授。
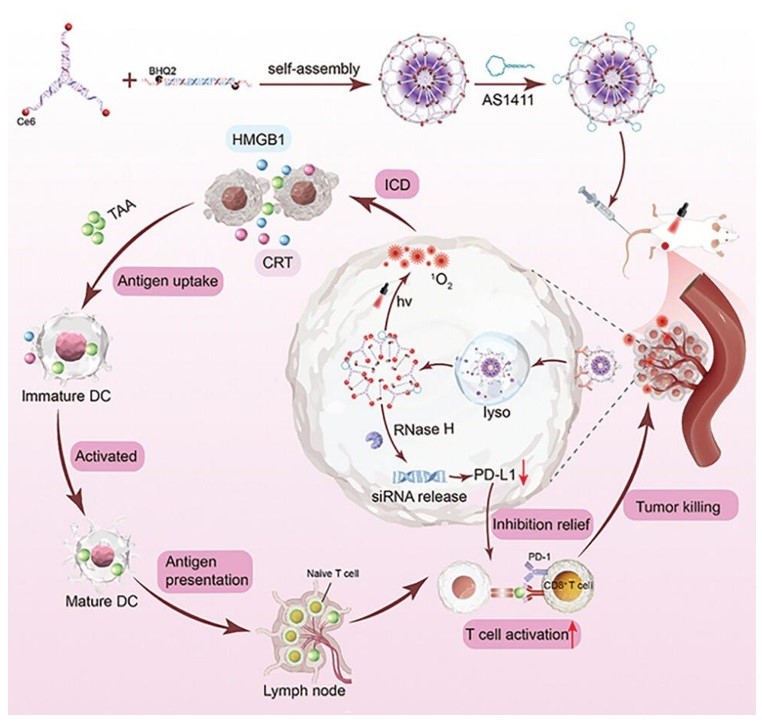
图1. NS-Ce6-PDL1的组装过程及其在癌症光免疫治疗和免疫检查点阻断中的协同作用。
与化疗或放疗相比,光疗具有选择性高、副作用小、局部治疗、诱导免疫原性细胞死亡(ICD)增强免疫应答等优点。然而,由于肿瘤细胞固有的免疫抵抗或免疫逃逸能力,彻底根除肿瘤具有挑战性,且远处转移的风险增加。因此,单纯依靠光疗未必能达到最佳治疗效果。因此,结合光疗和免疫检查点阻断(ICB)可能可以增强整体抗肿瘤效果。目前存在的问题是,针对ICB的抗体疗法仅阻断细胞膜表面的检查点,但细胞内蛋白的持续表达可能补偿免疫检查点,导致阻断失败和耐药。并且治疗剂的非特异性积累、不受控激活可能会降低疗效并导致毒性增加。本文的解决思路是使用siRNA疗法,降低整个细胞的靶点,减少耐受性的产生,另外利用DNA纳米材料的优势开发靶向、响应激活的核酸纳米药物递送系统,用于光免疫治疗疗和免疫检查点阻断的协同治疗,实现强大的肿瘤抑制作用。
实验原理如图1所示,DNA纳米球(NS)是通过Y形DNA单体(Y)和连接DNA单体(L)之间的粘性末端逐步杂交自组装形成的。将i-motif序列和PD-L1 siRNA合理编程到L中,光敏剂(chlorin e6、Ce6)和荧光淬灭剂(BHQ2)分别偶联到Y和L的适当位点。当Y和L自组装时,光敏剂由于靠近淬灭剂被淬灭。为了增强靶向能力,通过DNA杂交将广谱肿瘤特异性适配体(AS1411)锚定在NS上。静脉注射后,NS通过适配体靶向被癌细胞特异性摄取。NS能够响应溶酶体中的酸性环境,导致i-motif的构象变化,NS会解组装并从溶酶体中逃逸。这导致光敏剂和淬灭剂的空间分离,在激光照射下产生单线态氧(1O2),不仅杀死肿瘤细胞,还诱导癌细胞ICD。ICD释放高迁移率族蛋白1(HMGB1)和钙网蛋白(CRT)等信号分子,募集树突状细胞(DC)呈递肿瘤相关抗原(TAAs),并激活T细胞,从而启动免疫攻击。同时,RNase H介导的siRNA释放可以下调癌细胞中PD-L1的表达,降低免疫耐受和逃逸,从而增强免疫治疗的有效性。因此,光疗和免疫疗法的协同作用可以有效地杀死癌细胞,而NS的靶向和可控激活可以最大限度地减少对正常组织的毒副作用。
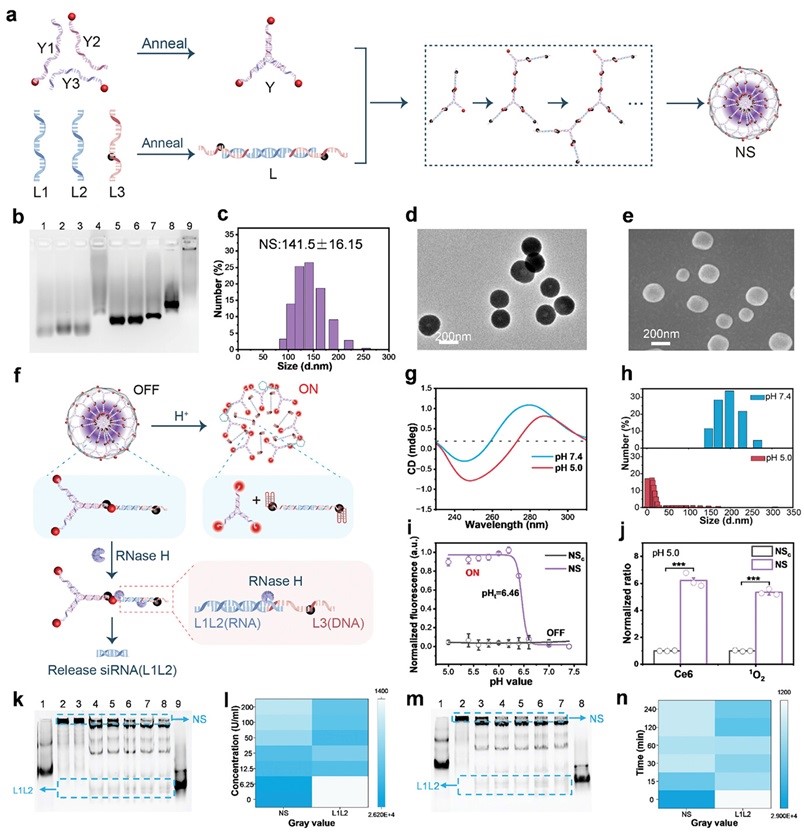
图2. NS的自组装和解组装。
作者首先对NS的自组装和解组装进行了研究,如图2b所示,琼脂糖凝胶电泳验证了NS的逐步组装过程。动态光散射分析显示NS的平均粒径约为141 nm(图2c)。透射电子显微镜(图2d)和扫描电子显微镜(图2e)显示NS呈球形且相对均匀。接着探究了酸和RNase H介导的NS解组装(图2f)。结果表明,NS在酸性条件下可以形成i-motif结构(图2g),粒径减小(图2h),荧光恢复(图2i),产生单线态氧(图2j)。随后,对RNase H介导的NS解组装进行了研究,结果表明,NS在RNase H的介导下可解组装,释放siRNA,且解组装是RNase H浓度依赖和时间依赖的(图2k-m)。上述结果表明,在酸和RNase H存在下,NS可以解组装以激活光敏剂和释放PD-L1 siRNA。
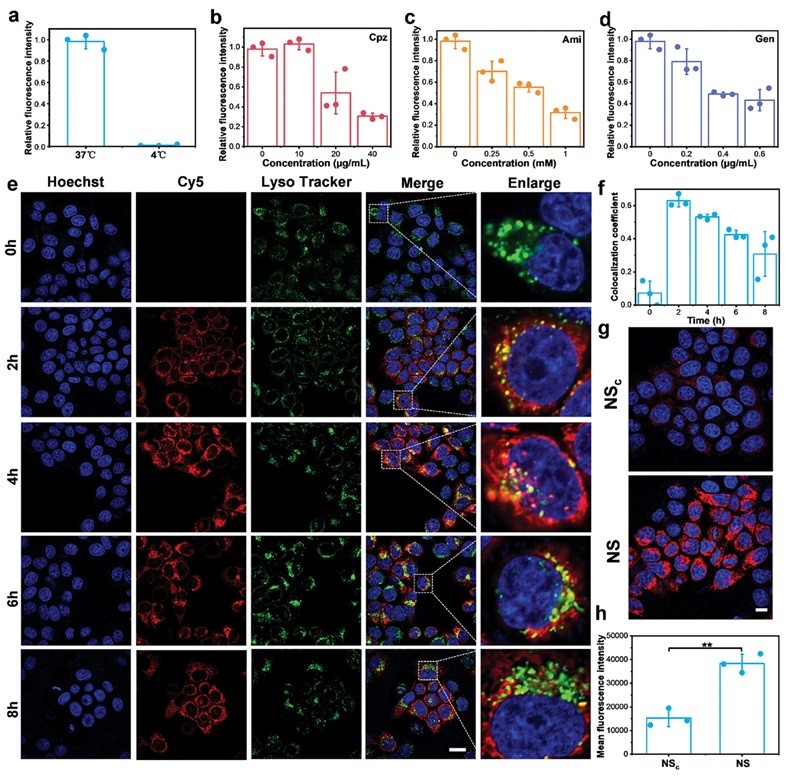
图3. 细胞摄取和溶酶体逃逸。
接下来研究了NS的细胞摄取途径。结果表明,NS的细胞摄取是一个能量依赖性过程,依赖于巨胞饮、网格蛋白介导的内吞和小窝介导的内吞(图3a-d)。内吞作用途径表明NS可以通过溶酶体途径易位到细胞质中。随后进行了NS的溶酶体逃逸分析,结果表明,NS可以由溶酶体中逃逸至细胞质以避免溶酶体中的酶促降解(图3e-f)。另外,NS和NSc与细胞孵育相同时间后,结果显示,NS的激活程度显著高于NSc(图3g-h)。
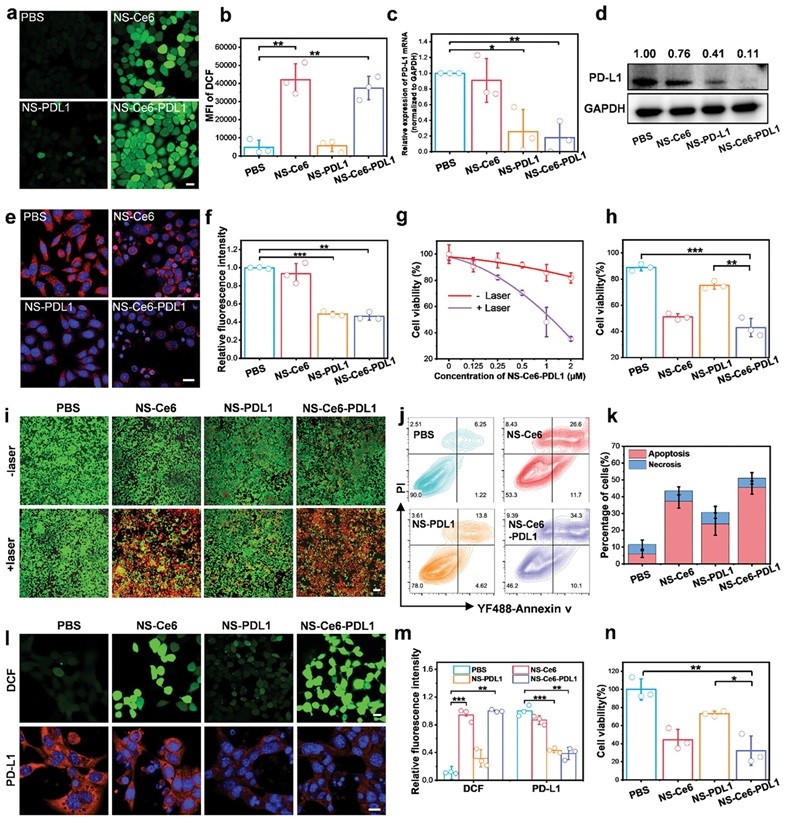
图4. 体外癌细胞杀伤作用。
进一步评估了NS在细胞内的1O2产生和PD-L1沉默效果,结果表明NS-Ce6和NS-Ce6-PDL1组处理的细胞在激光照射后产生明显的1O2(图4a-b)。RT-qPCR、WB和免疫荧光结果表明NS-PDL1和NS-Ce6-PDL1组的细胞内PD-L1表达显著下调(图4c-f)。细胞活力结果显示在激光照射下,NS-Ce6-PDL1以剂量依赖性方式显著诱导细胞死亡(图4g)。随后细胞活力、活/死细胞染色和细胞凋亡结果表明NS-Ce6-PDL1组表现出最强的癌细胞杀伤效果(图4h-k)。为了研究NS-Ce6-PDL1在沉默PD-L1表达和诱导光毒性癌细胞杀伤中的普适性,使用小鼠来源的乳腺癌细胞(4T1)进行了类似的实验。结果表明,NS-Ce6-PDL1同样可以在4T1癌细胞中产生ROS、下调PD-L1表达,发挥有效的癌细胞杀伤作用(图4l-n)。
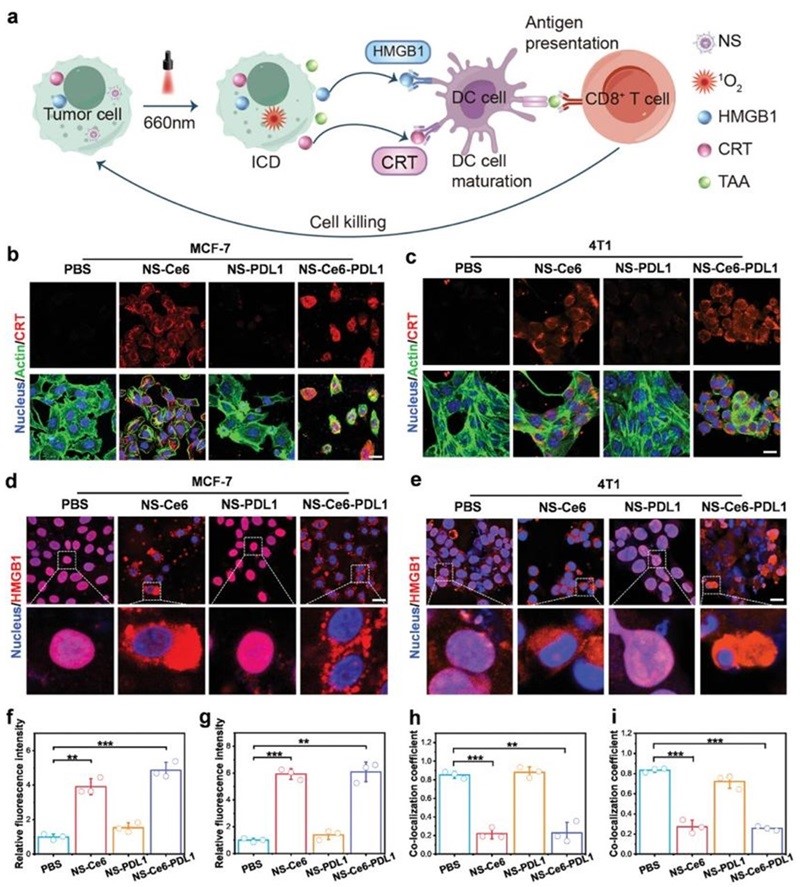
图5. 体外诱导免疫原性细胞死亡。
NS-Ce6-PDL1处理的肿瘤细胞暴露在激光下以产生1O2,除了直接杀死肿瘤细胞外,它还可以通过诱导ICD来进一步触发免疫反应(图5a)。在此过程中,光疗杀死的肿瘤细胞可以释放TAAs和损伤相关分子模式(DAMP)。DAMP充当刺激免疫系统的“危险”信号,诱导DC成熟。它促进DC呈递TAAs和T细胞的激活,从而启动细胞毒性T细胞(CD8+)对肿瘤细胞的攻击。为了评估NS-Ce6-PDL1在癌细胞中诱导ICD的能力,检测了关键DAMP的释放或暴露,包括CRT和HMGB1。结果表明,在MCF-7细胞和4T1细胞中,PDT介导的细胞杀伤诱导了CRT和HMGB1的释放,证实了PDT介导的免疫原性细胞死亡的发生(图5b-i)。
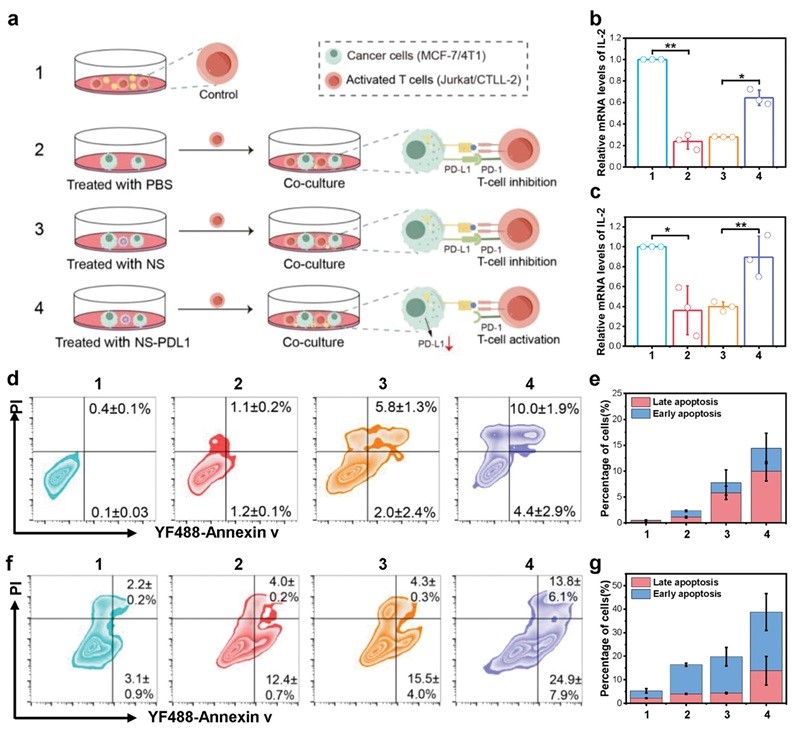
图6. 体外促进T细胞活化和杀伤。
为了研究NS介导的siRNA释放是否可以沉默PD-L1表达,从而促进T细胞活化和癌细胞杀伤,对癌细胞和T细胞进行了体外共培养实验。如图6a所示,设置了四组:第1组仅由活化的T细胞组成,可以释放大量的白细胞介素-2(IL-2),并作为对照。第2组、第3组和第4组是分别用PBS、NS和NS-PDL1预处理的癌细胞,然后与活化的T细胞共培养。这些预处理导致不同程度的T细胞活化和IL-2释放。作者测量了两种共培养模型(MCF-7和Jurkat、4T1和CTLL-2)中的IL-2水平以评估T细胞活化。结果显示共培养之后的T细胞中的的IL-2水平降低,但这种降低可以通过肿瘤细胞的NS-PDL1处理来逆转(图6b-c)。为了评估NS-PDL1对T细胞介导的肿瘤细胞杀伤的影响,进行了细胞凋亡分析,结果显示两组共培养模型中,NS-PDL1处理后的癌细胞中的细胞凋亡率最高(图6d-g)。这些结果表明,NS-PDL1通过下调癌细胞中的PD-L1来逆转免疫抑制,从而促进T细胞活化并增强T细胞抗肿瘤活性。

图7.体内协同抗肿瘤免疫。
接下来,在4T1荷瘤小鼠模型中监测关键免疫细胞,以研究基于NS-Ce6-PDL1的免疫疗法的协同效应(图7a)。ICD诱导的TAAs可被未成熟的DC摄取和吞噬,导致DC成熟。随后,成熟的DC将TAAs呈递给淋巴结中的T细胞,并激活T细胞。因此,在注射不同制剂后,我们检测了4T1荷瘤小鼠的腹股沟淋巴结的成熟DC的频率(图7b-c)。结果显示,NS-Ce6-PDL1组表现出最高的DC成熟频率。这说明与单一疗法相比,联合疗法显著促进了DC成熟。T细胞活化后,CD8+可浸润肿瘤组织,并通过分泌干扰素γ(IFN-γ)、颗粒酶和穿孔素等有毒细胞因子杀死肿瘤细胞。因此,我们进一步提取肿瘤浸润淋巴细胞,测量浸润的CD8+细胞(图7d-e)和CD8+ T细胞中IFN-γ的表达(图7f-g)。结果显示,联合治疗组(NS-Ce6 -PDL1)肿瘤组织中CD8+细胞和CD8+/IFN-γ+双阳性T细胞的频率显著高于其他治疗组。这些结果表明,与单一疗法相比,基于NS的PIT/ICB联合疗法可以诱导更强的免疫反应,表明其具有增强抗肿瘤疗效的潜力。
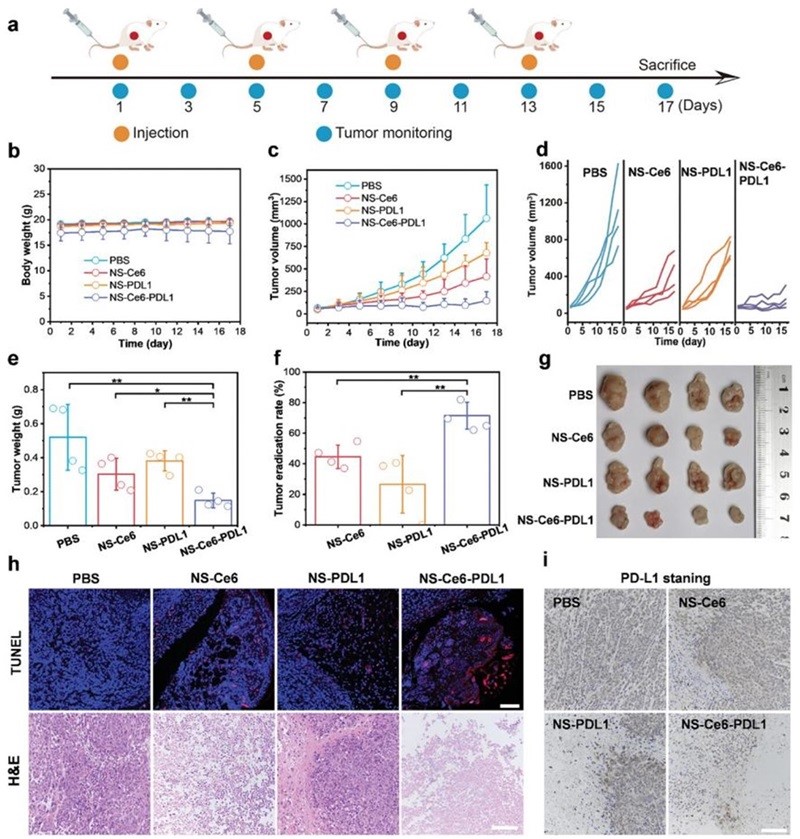
图8. 体内协同抗肿瘤作用。
最后在4T1荷瘤小鼠体内研究协同肿瘤治疗效果,结果显示,在治疗期间小鼠的体重没有显著变化,表明不同的制剂在生物学上是安全的(图8b)。肿瘤生长曲线(图8c-d)、肿瘤质量(图8e)结果显示,联合治疗组显示出最好的肿瘤抑制效果,肿瘤消除率达到65%(图8f)。随后,对肿瘤切片进行了组织化学分析,结果显示联合治疗在肿瘤细胞凋亡、肿瘤细胞杀伤和PD-L1表达下调方面均表现出显著优势(图8h-i)。这些结果表明,NS-Ce6-PDL1显著增强抗肿瘤免疫反应,协同提高抗肿瘤疗效。
相关研究成果发表在Advanced Science,论文的第一作者为博士研究生陈余,通讯作者为湖南大学化学化工学院黄晋教授。该研究工作得到国家自然科学基金和湖南省自然科学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Sequentially activated smart DNA nanospheres for photoimmunotherapy and immune checkpoint blockade
Yu Chen, Yu Guo, Wen Chen, Jiahao Fan, Jiacheng Li, Jiajia Song, Xiaohai Yang, Kemin Wang, Jin Huang*
Adv. Sci., 2024, DOI: 10.1002/advs.202410632
研究团队简介

黄晋,湖南大学化学化工学院教授,博士生导师,教育部青年长江学者,湖南省杰出青年基金获得者,湖南大学岳麓学者。研究兴趣是DNA纳米材料及其生物医学应用。先后主持和参与国家及省部级科研项目近20项,已在国际学术期刊上发表论文200余篇,总引用次数超过10000次(H因子55),获发明专利8项。
https://www.x-mol.com/university/faculty/66377
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号