物构所房新强课题组JACS:β,γ-不饱和-α-二酮的不对称转移氢化
注:文末有本文科研思路分析
不对称转移氢化(ATH)技术,凭借其温和的反应条件、简便的操作流程以及无需特殊反应器的优势,赢得了全球学术界和工业界研究人员的密切关注。通过采用半三明治结构的双功能催化剂,科研人员已成功实现了多种前手性酮(诸如芳基/烷基酮、α-取代芳基酮、α-取代环酮及炔酮)的不对称转移氢化。然而,与之大相径庭的是,烯酮,尤其是非环状烯酮的高选择性转移氢化仍是一道亟待跨越的难关。其面临的挑战主要包括:一是反应的区域选择性难以掌控,活化的双键易进行1,4-还原,导致产物多为两种或三种的混合物;二是反应的非对映选择性和对映选择性难以调控(图1a)。在此情境下,若不对称转移氢化的底物为共轭α-二酮,则情况更为复杂。烯酮与二酮单元的同时存在,使得转移氢化的区域选择性控制变得异常艰难,同时,如何精准调控单次、双次乃至三次氢化,也成为了此类反应中的一大棘手问题(图1b)。
中国科学院福建物质结构研究所房新强(点击查看介绍)课题组的一个主要研究方向是1,2-二酮的选择性转化反应研究。近日,该课题组突破了共轭α-二酮在不对称转移氢化领域的选择性难题,不仅实现了高度的区域选择性、对映选择性及非对映选择性,还一举高效地制备出了四种手性α-羟基酮和四种手性1,2-二醇(图1c)。这些产物在有机合成、药物创新研发以及先进材料科学等多个关键领域,均为不可或缺的中间体。值得注意的是,尽管不对称转移氢化技术在合成化学中扮演着重要角色,但能够同时制备多种高光学纯度的α-羟基酮与1,2-二醇的方法却尚未报道。此次研究中,他们发现底物的取代基模式在调控反应路径、实现产物多样性方面发挥了至关重要的作用。他们还成功完成了sordariol及其三种密切相关天然产物的全合成,并通过深入的机理研究与DFT计算,首次揭示了前所未有的独特路径,为相关领域的研究开辟了新的视野。
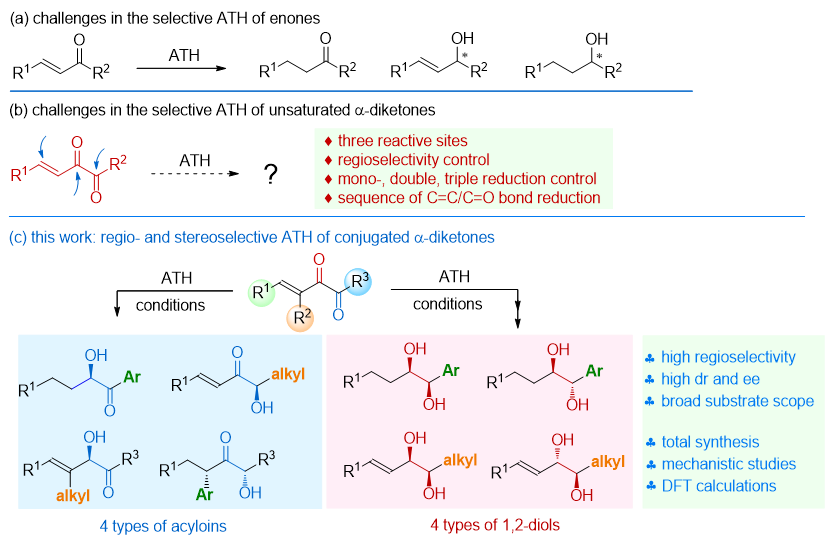
图1. 研究背景介绍。图片来源:J. Am. Chem. Soc.
底物适用范围研究表明,当底物的苯环上引入给电子取代基或拉电子取代基时,对反应几乎没有影响,都能以较高的收率和ee值得到产物。当R2基团为烷基或者烯基时,反应也能顺利地进行。γ,γ-二取代底物也能很好地适应反应条件并得到相应的产物。产物2s和2t的绝对构型通过X-射线单晶衍射证实,其他产物的绝对构型通过类比的方式得到(图2)。
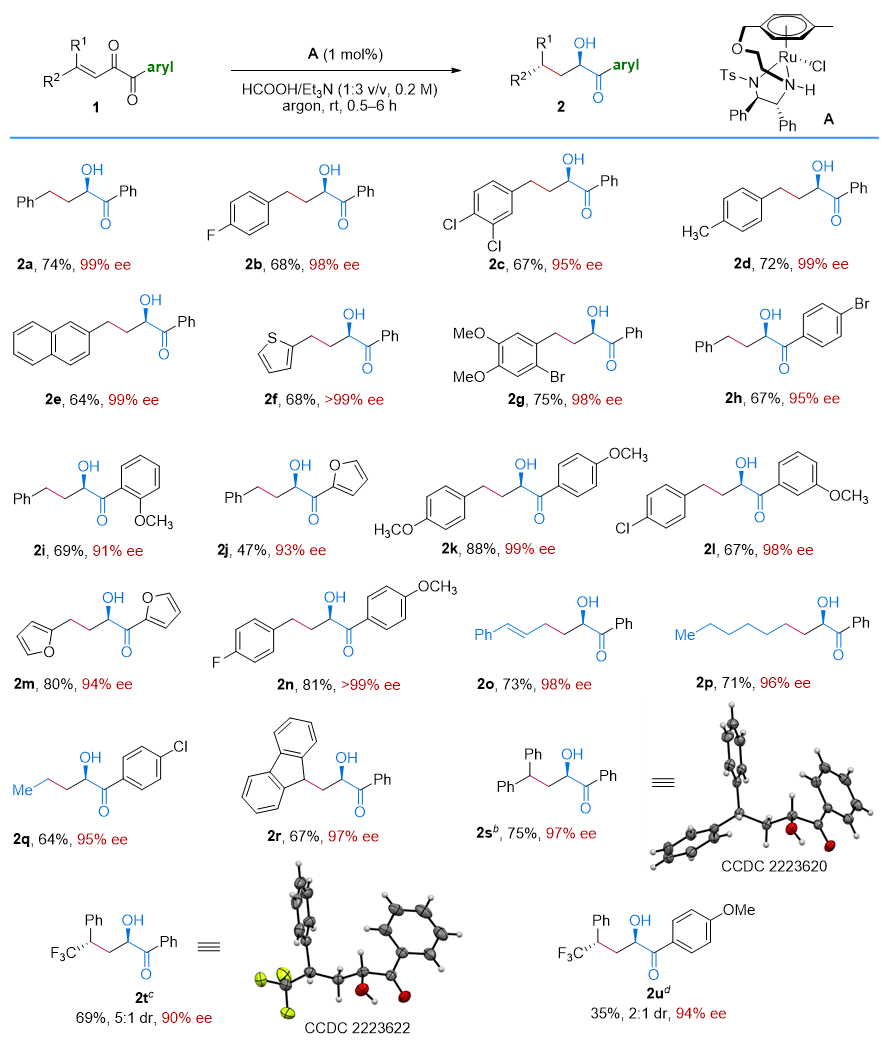
图2. 芳基二酮的不对称转移氢化。图片来源:J. Am. Chem. Soc.
令人惊讶的是,在相同的反应条件下,烷基二酮底物进行氢化可以得到完全不同的α-羟基烯酮类产物(图3a)。5b的绝对构型通过使用Mosher酯的方法确定为R型。当具有β-烷基取代基的共轭α-二酮在相同的反应条件下进行反应时,再次生成了一种新型产物α-羟基-β,γ-不饱和酮(图3b)。他们通过将6a的HPLC谱图与已知方法获得的谱图进行比较,确认了该化合物的绝对构型为R型。而6g的绝对构型则通过Mosher酯方法确定为S型。
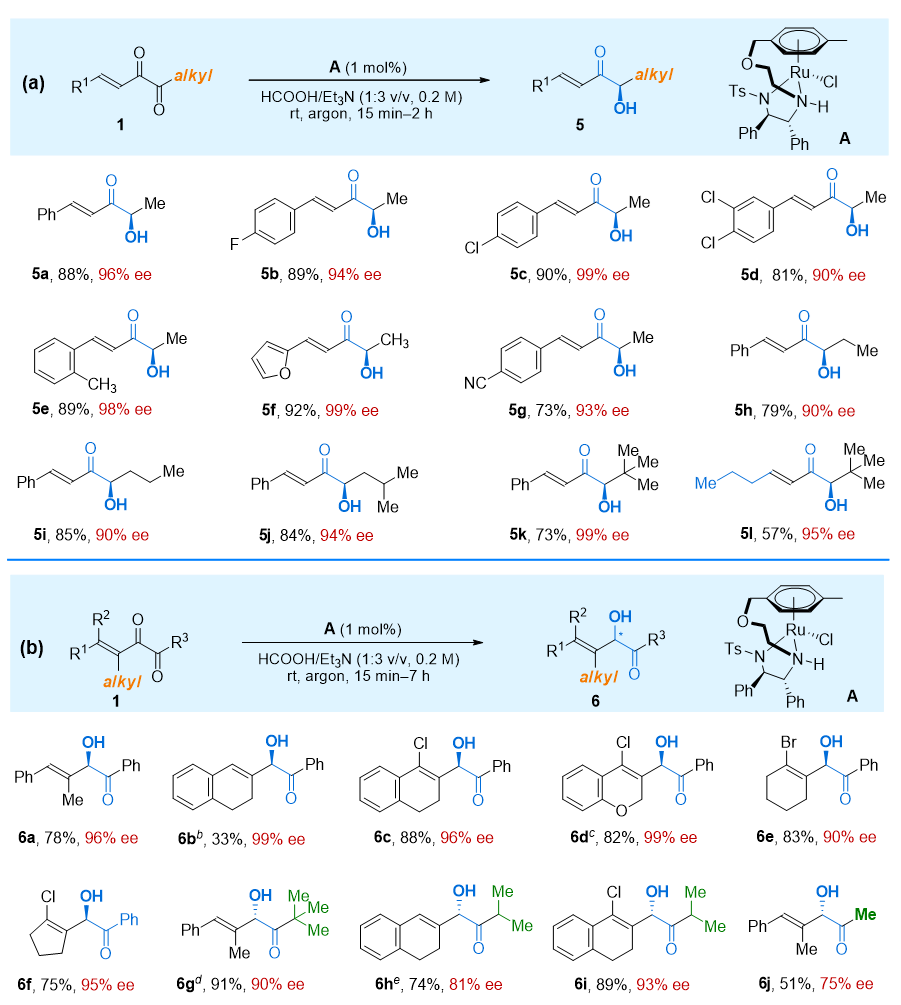
图3. 烷基二酮以及β-烷基取代二酮的转移氢化。图片来源:J. Am. Chem. Soc.
随后,他们进一步测试了β-芳基取代共轭α-二酮的反应性,在重新优化了反应条件之后,成功地获得了第四种类型的产物,即α-羟基-α'-芳基酮(图4)。值得注意的是,化合物7i和7j具有反式构型,而其他产物则具有顺式构型。这一发现进一步扩展了该类反应的应用范围,并揭示了在不同取代基的影响下,反应可以导向生成结构多样的化合物。
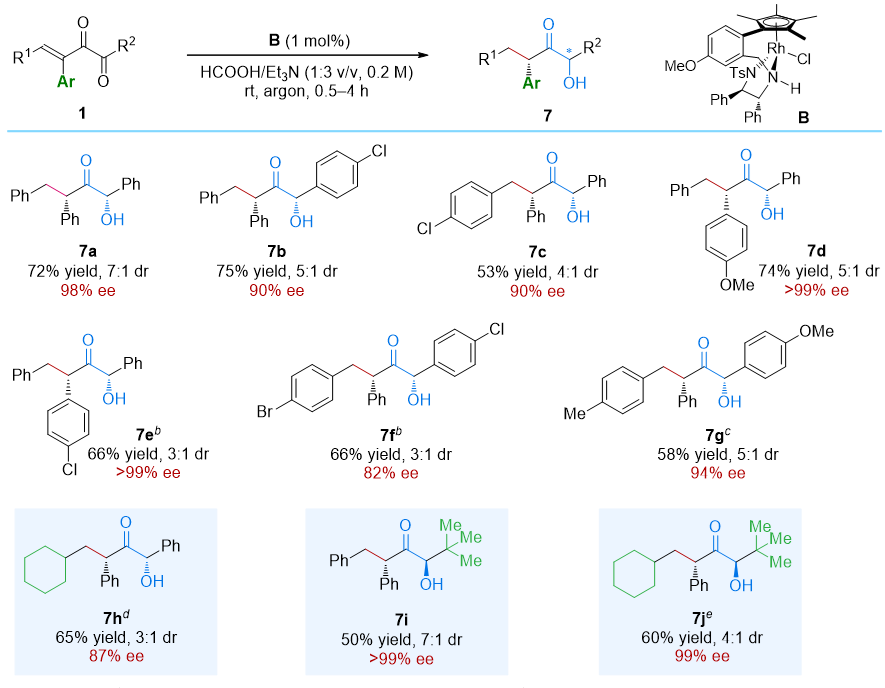
图4. 硼代炔酮和硼代烯酮的转移氢化。图片来源:J. Am. Chem. Soc.
此外,当反应体系中加入Ti(OiPr)4作为添加剂时,芳基二酮类底物的两个羰基和一个烯基可以完全氢化,以较高的非对映选择性和对映选择性得到顺式二醇类产物(图5a)。而手性α-羟基酮2在催化剂B的作用下进行非对映选择性氢化时,则能够高效地生成反式二醇(图5b)。4c和4g的绝对构型通过X射线单晶衍射确定。相应地,通过比较二醇3的核磁谱图,可以推断出二醇3的相对构型。
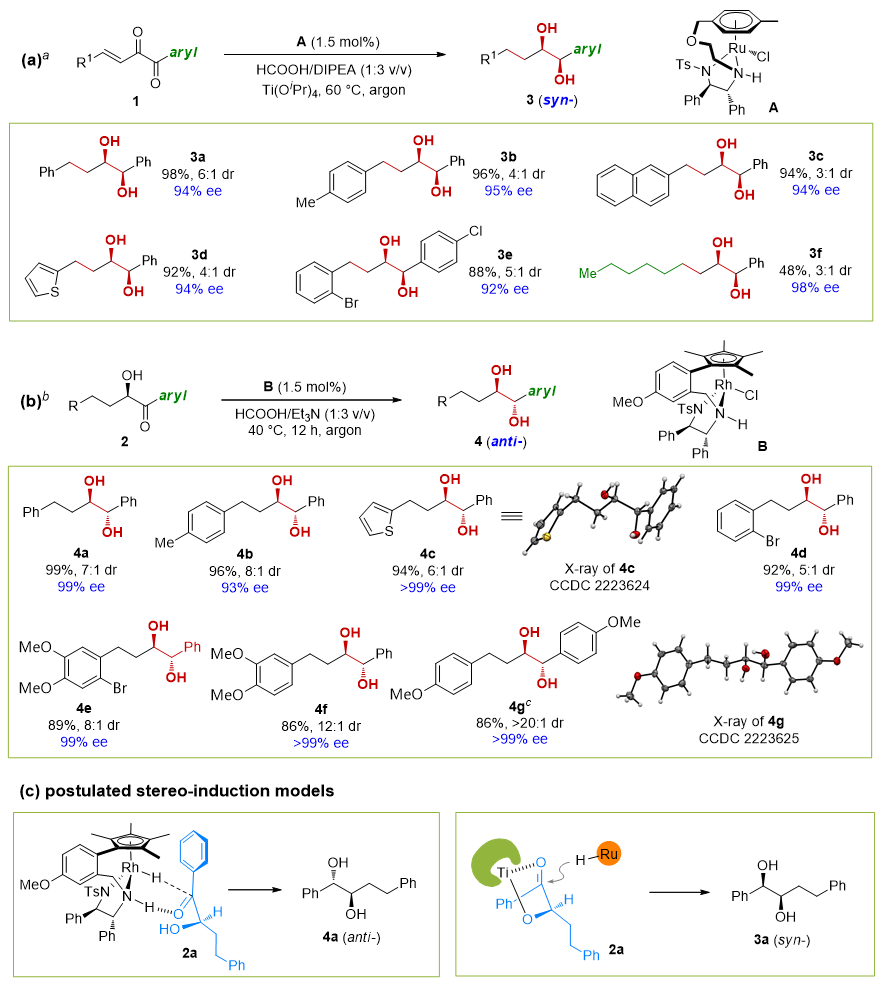
图5. 顺式二醇和反式二醇的生成。图片来源:J. Am. Chem. Soc.
当使用α-羟基烯酮5作为底物进一步还原时,反应可以在不同的条件下分别得到具有烯基单元的顺式和反式二醇(图6)。
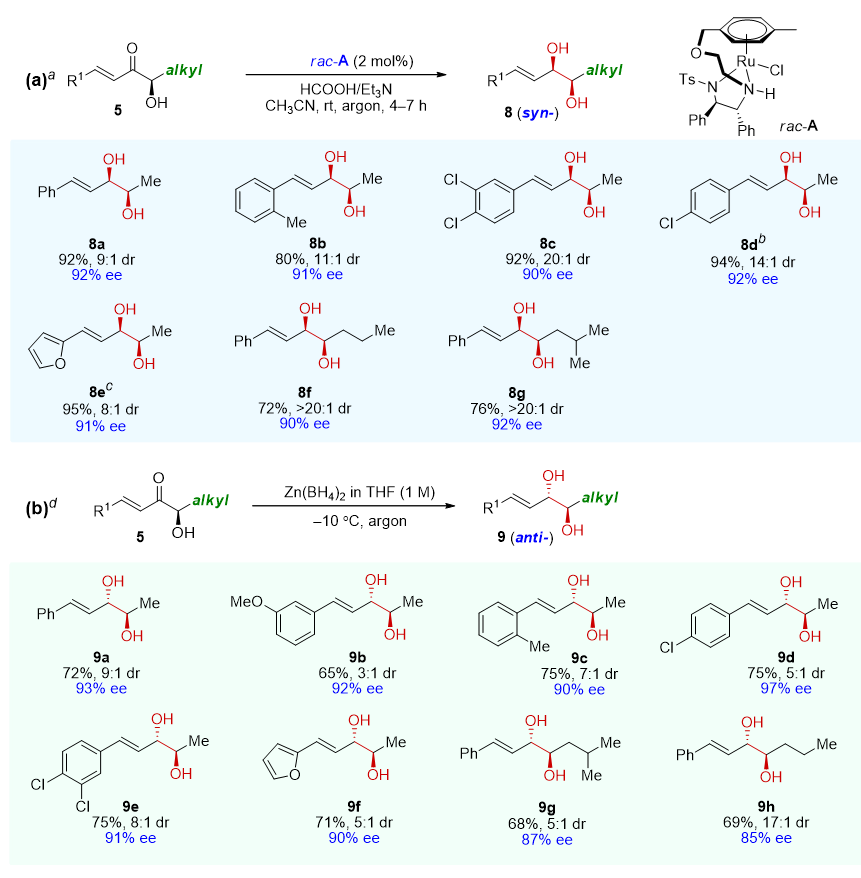
图6. 顺式烯基二醇和反式烯基二醇的生成。图片来源:J. Am. Chem. Soc.
反应产物可以进行进一步转化,并方便地制备一系列天然产物如sordarial、12-methoxy sordariol、sordariol和agropyrenol等(图7)。
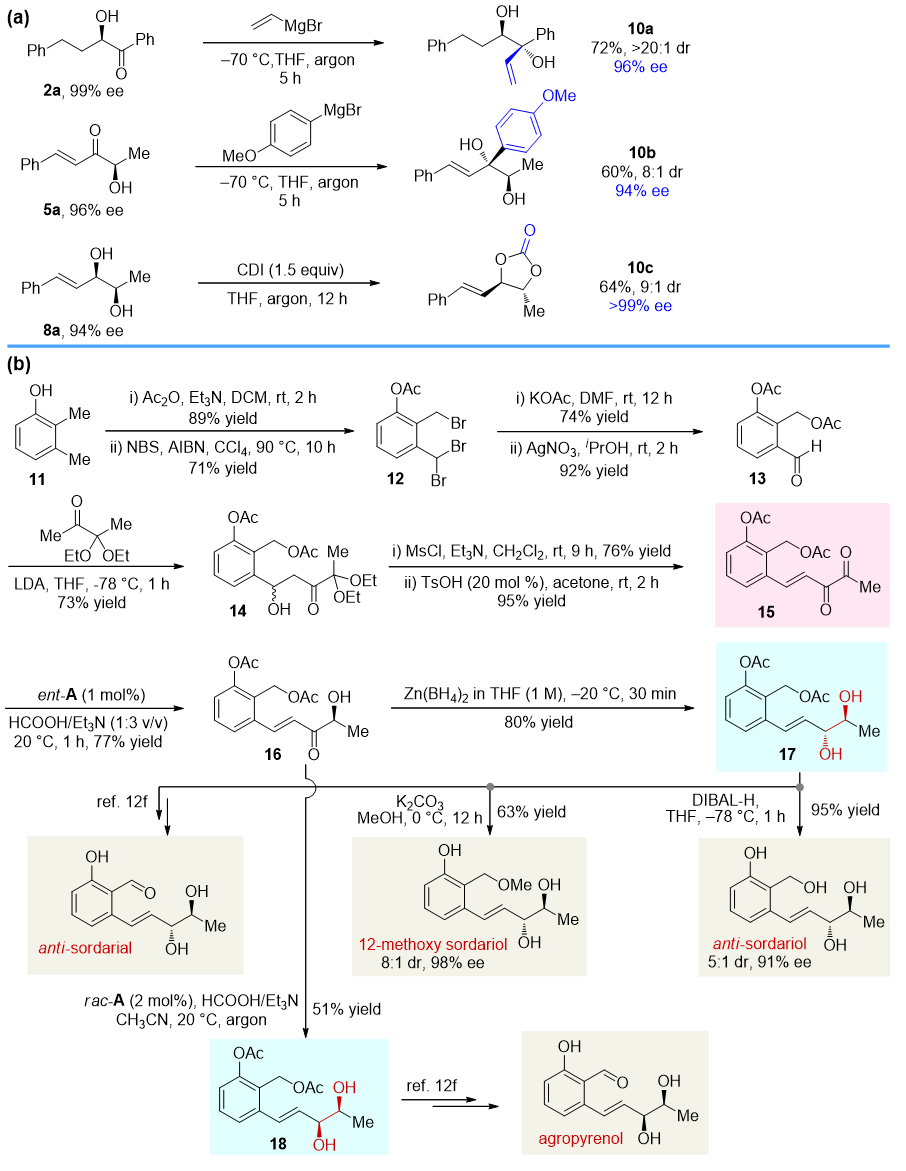
图7. 合成应用及天然产物和药物分子制备。图片来源:J. Am. Chem. Soc.
经过详尽的机理探究,并结合DFT计算,他们成功地揭示了反应活性差异的内在根源,同时指明了底物中芳香族取代基与脂肪族取代基各自独特且不同的作用机制(图8)。
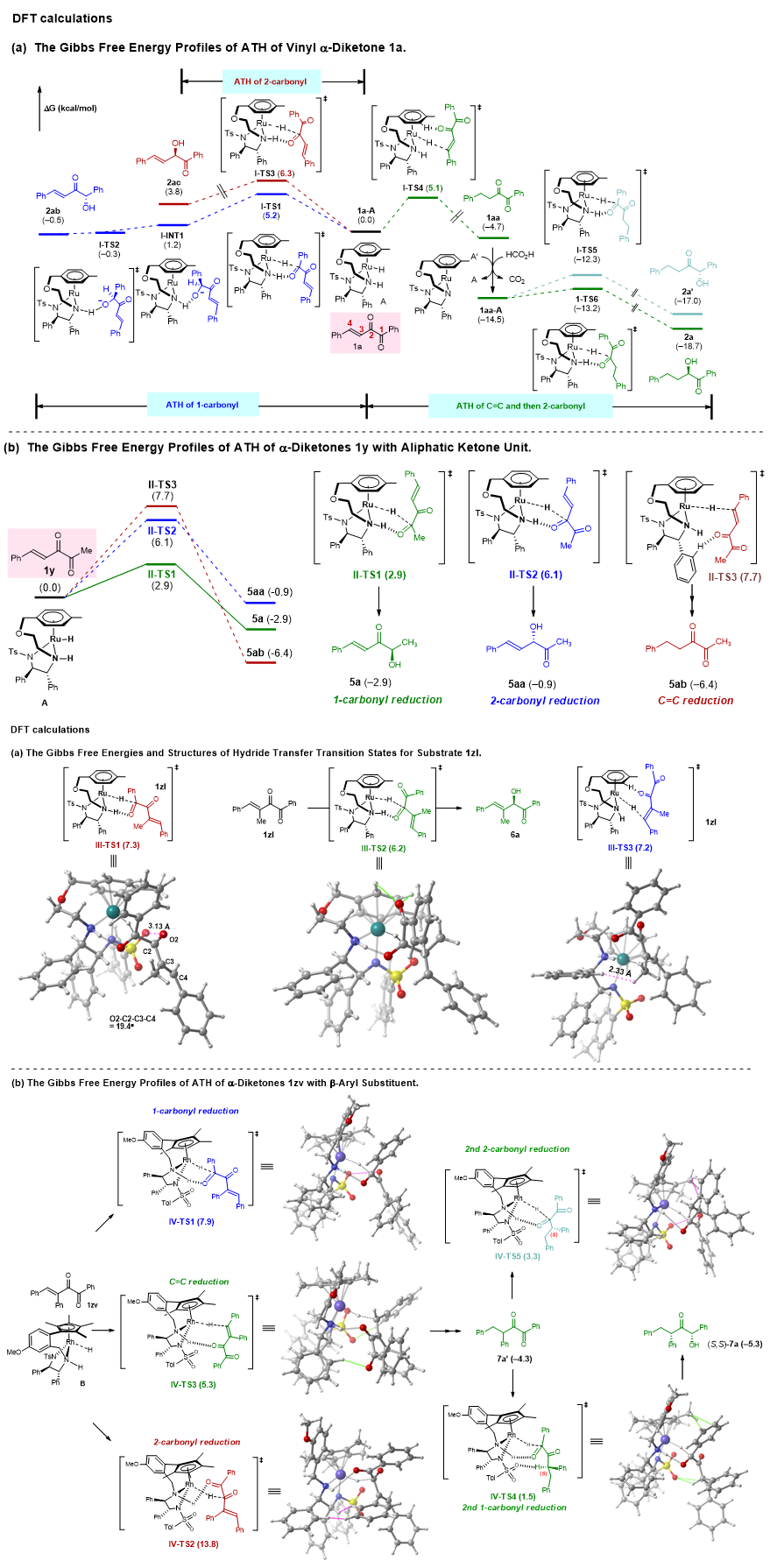
图8. 单还原产物详细机理研究。图片来源:J. Am. Chem. Soc.
相关成果于近期发表于J. Am. Chem. Soc.,博士生赵志飞和董文楠是论文的共同第一作者,物构所房新强研究员和合肥工业大学张琪副研究员(计算支持)为共同通讯作者。这一工作得到了国家自然科学基金、福建省自然科学基金、中科院先导项目、海西院十四五计划的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Asymmetric Transfer Hydrogenation of β,γ-Unsaturated α-Diketones
Zhifei Zhao,⊥ Wennan Dong,⊥ Jinggong Liu, Shuang Yang, Andrej Emanuel Cotman, Qi Zhang,* and Xinqiang Fang*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c11070
导师介绍
房新强
https://www.x-mol.com/university/faculty/22977
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:我们课题组集中于酮醇酯类分子的催化转化,先后在相关的动力学拆分、1,2-二酮的选择性转化、yne-allylic取代等方向进行了系统性的工作。针对消旋1,2-二酮的不对称转移氢化我们已经取得了一些成果,所以自然就想到更具难度的不饱和1,2-二酮的不对称转移氢化的研究。在两个羰基选择性的难度之上再增加了一个活化双键,这样反应就有双键和两个羰基的选择性氢化以及单、双、三氢化的问题。如果能解决这些选择性的调控,那将会是很有意义的。
Q:研究过程中遇到哪些挑战?
A:底物根据取代基性质的不同展现出完全不同的区域选择性以及单氢化和双氢化的选择性。所以如何解释这些选择性的根源是最有难度的。我们通过大量机理实验和计算研究,总结分析出了各类选择性的原因。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:产物是四种α-羟基酮和四种1,2-二醇,都是很有用的有机合成中间体。另外我们也实现了相关生物活性分子的简洁合成,所以对相关的药物研究是有潜在的应用价值的。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!









































 京公网安备 11010802027423号
京公网安备 11010802027423号