轴手性β-芳基铱卟啉络合物催化高效合成β-手性三级胺
叔胺广泛分布于药物、生物碱类天然产物、功能性材料、配体以及催化剂之中。氮原子相邻的C−H键的直接官能化为合成结构多样的叔胺开辟了广阔的途径。这一过程可以通过从简单的胺出发构建复杂的胺类化合物,或者在后期对复杂的胺(例如生物碱)进行修饰来实现。在不对称合成领域,金属催化的叔胺与卡宾前体的直接C(sp3)−H键烷基化反应尤为引人注目。然而,该领域面临两大主要挑战(见图1):首先,胺对卡宾中心的亲核进攻形成氮叶立德的竞争反应,尤其在脂肪族叔胺中更为显著,这使得C−H键的活化变得困难;其次,不同类型的C−H键,如伯或仲C(sp3)−H键以及C(sp2)−H键(在芳香胺中,苯环上氮原子对位的C−H键被活化)可能导致选择性问题。为了克服这些挑战,开发能够精准区分不同类型C−H键之间能垒差异的新型催化剂显得尤为迫切。
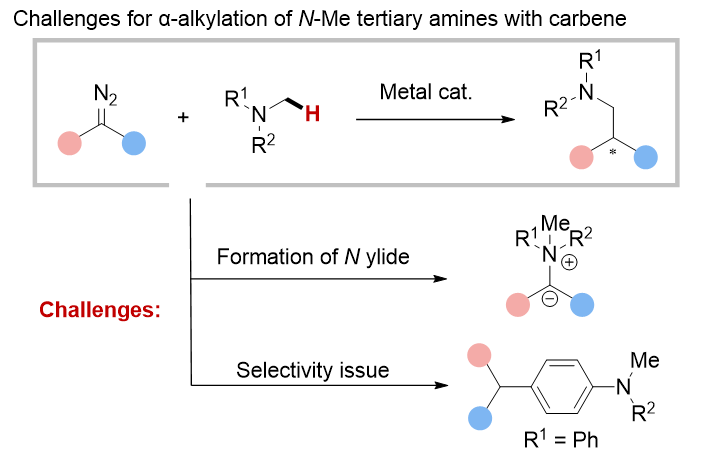
图1. N-甲基叔胺α烷基化的挑战
近日,同济大学的郑生财研究员(点击查看介绍)和赵晓明教授(点击查看介绍)领导的研究团队基于他们先前报道的原创C4-对称轴手性β-芳基金属卟啉配体(Angew. Chem. Int. Ed. 2024, 63, e202404329),成功辅助铱催化剂实现了N-甲基叔胺的伯C(sp3)−H键烷基化反应,展现出卓越的位点选择性和对映选择性。该反应不仅产率高、对映选择性出色,而且底物适用范围广泛,对官能团的容忍性也很强。特别是在对手性生物碱荷包牡丹碱的后期修饰中,催化剂展现出了高度的非对映选择性,充分证明了轴手性β-芳基铱卟啉催化剂在立体发散合成具有N-甲基结构的手性天然产物方面的巨大潜力(见图2)。
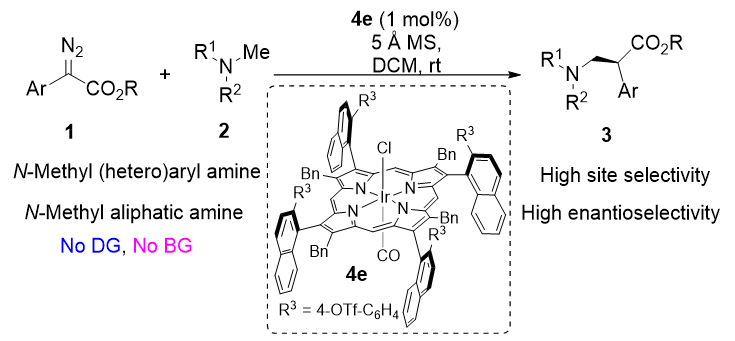
图2. 本篇工作
作者选择了2,2,2-三氯乙基(TCE)重氮乙酸酯(1aa)和N,N-二甲基苯胺(2a)为模板反应底物,以铱卟啉Ir(Por*)(CO)(Cl)(4a)为催化剂、5Å分子筛(5Å MS)为添加剂和在二氯甲烷(DCM)中室温(rt)下开展研究(见图3)。该反应在N-Me活化中展现出显著的选择性,最终以85%的产率和36%的对映选择性(ee)获得产物3aaa。催化剂中轴手性芳基邻位的位阻对反应的对映选择性起着至关重要的作用。通过对催化剂的精细调控以及溶剂和底物的筛选,确定了最佳反应条件:催化剂4e(1 mol%)、1aa(0.1 mmol)、2a(0.2 mmol)、5Å MS(100 mg)和DCM(0.1 M),在氩气保护下于室温条件下反应,最终以92%的产率和94%的ee得到产物3aaa。
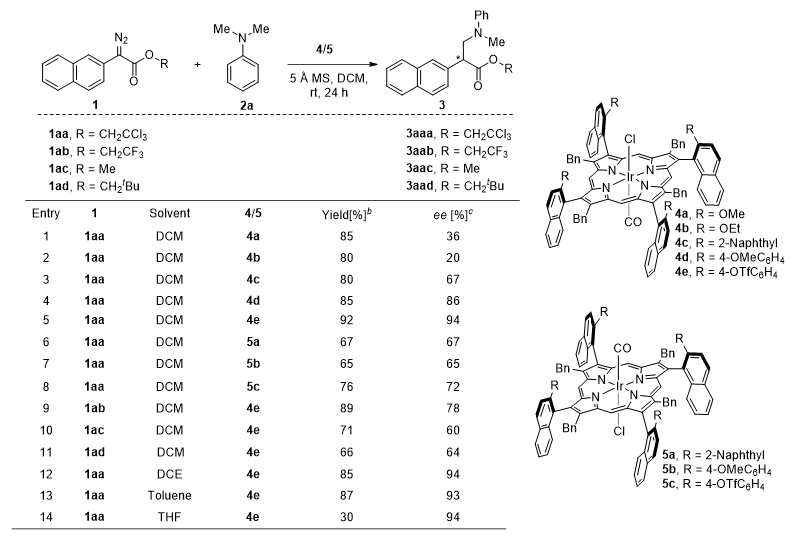
图3. 条件筛选
在最佳反应条件下,研究团队探索了N,N-二甲基苯胺(2a)在N-Me烷基化反应中各种重氮底物的适用范围(见图4)。结果显示,无论是供电子基团还是吸电子基团,2,2,2-三氯乙基芳基重氮乙酸酯的苯基环上所得到的产物均以高产率和优异的对映选择性获得。值得注意的是,未检测到C(sp2)−H键烷基化产物。此外,含有芴基和杂环的重氮化合物也适用于该反应,均表现出高收率和良好的对映选择性。
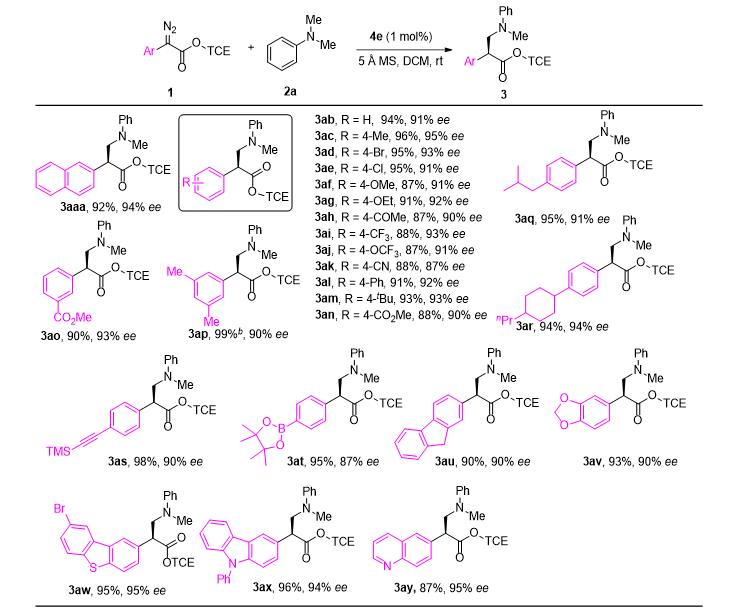
图4. 底物拓展
作者考察了各种N-甲基叔胺2与1aa的烷基化底物范围(图5),发现具有不同取代基N,N-二甲基苯胺,不受其位阻或电子性质的影响,均能以优秀的收率及对映选择性得到目标产物。不对称的N-甲基-N-烷基芳基胺2l-2n也适用于反应,以高产率(85%-90%)和高对映选择性(95%-96% ee)得到产物3bl-3bn。除此之外,N-甲基四氢喹啉、吲哚啉衍生物、N-甲基杂芳胺和未保护的N-甲基烷基叔胺底物也都有高的收率(60%-94%)和对映选择性(88%-98% ee)。
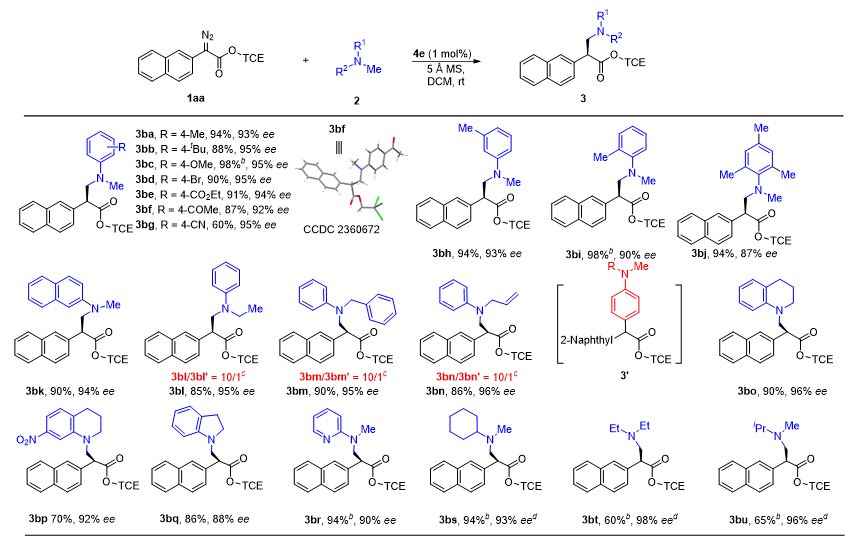
图5. 底物拓展
作者将这一创新方法应用于N-甲基生物碱天然产物,例如荷包牡丹碱的后期修饰(见图6)。当采用外消旋的四苯基铱卟啉(Ir-TPP)催化剂时,反应顺利进行,成功合成了3bv和3bw的非对映异构体混合物,总产率达到了76%,非对映选择性为2/1 dr。进一步地,在手性催化剂4e的作用下,以77%的产率成功获得了3bv,并且实现了大于20/1 dr的高非对映选择性。使用催化剂4e的对映异构体(ent-4e)时,同样能够以高非对映选择性和产率获得3bw。这些结果与双铑催化体系相比(其非对映选择性最高仅为2.3/1 dr),展现出了明显的优越性。
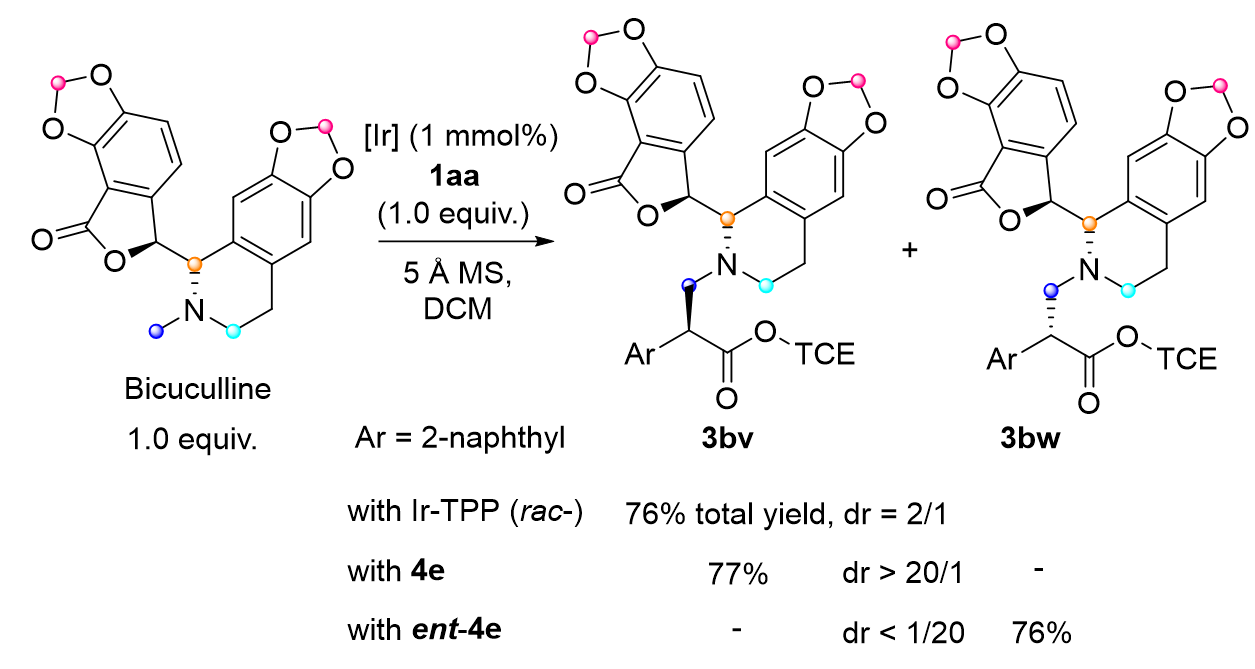
图6. 生物碱后修饰
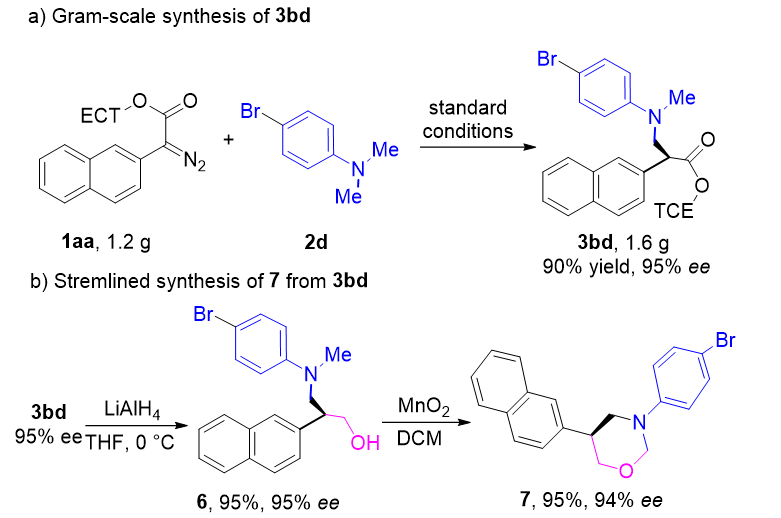
图7. 底物衍生化
为了进一步验证所合成的β-手性叔胺的合成价值,首先作者对1aa与2d进行了克级放大实验(1.2 g),成功以90%的收率(1.6 g)合成了3bd,同时保持了95% ee的对映体选择性(见图7a)。再者,3bd能够轻松地以95%的高收率还原为相应的氨基醇6,对映选择性得到了保持。化合物6可以进一步高效地转化为有用的手性1,3-噁嗪烷7(见图7b)。
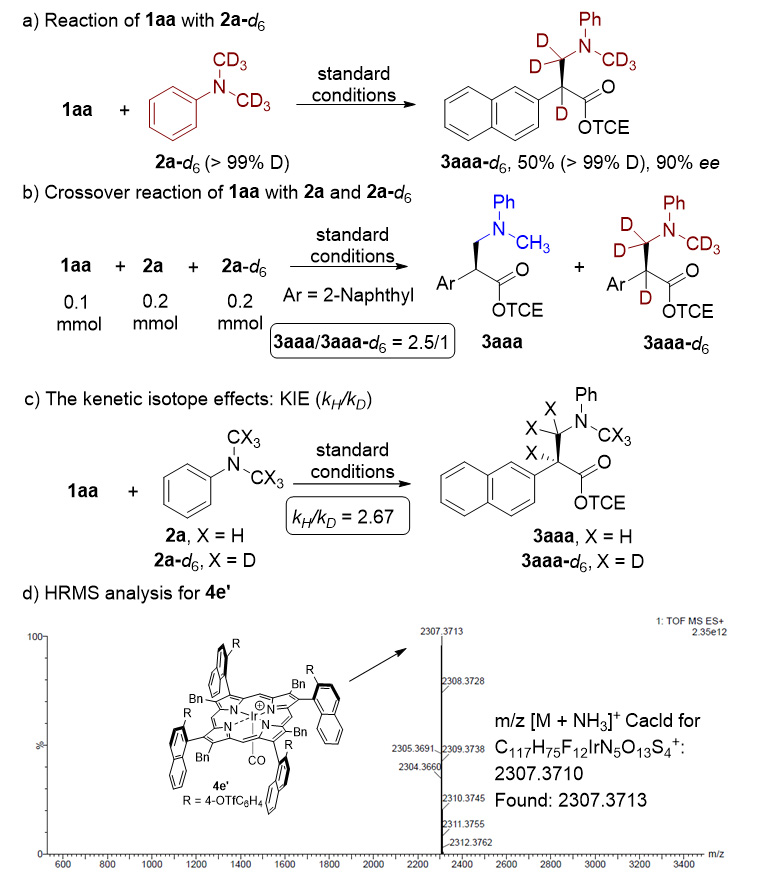
图8. 机理控制实验
为了阐明反应机理,作者进行一系列控制实验。首先,使用重氮化合物(1aa)与氘代苯胺(2a-d6)反应,氮原子附近的氘原子完全移动到手性位置,得到氘代产物3aaa-d6(图8a)。通过氘代交叉实验以2.5/1的比例分别形成产物3aaa和3aaa-d6,在2a和2a-d6中没有观察到交叉的转化(图8b)。这些结果表明,卡宾插入C(sp3)−H键可能是一个协同过程。此外关于动力学同位素效应的详细实验(KIE),得到KIE(kH/kD)值为2.67(图8c),这表明反应C-H键插入是反应的决速步骤。尽管未能成功通过用当量的铱催化(4e)与重氮化合物(1ad)直接反应获得铱卡宾中间体,但是,反应后回收的催化剂得到一种新的铱卟啉物种,通过HRMS鉴定为阳离子铱络合物,作者认为其可能是催化反应的实际催化物种(图8d)。
结合控制实验,作者提出了一个可能性的机理(图9)。首先,重氮化合物(1)和催化剂Ir(Por*)(CO)(Cl)(4/5)发生配体交换,N2离去生成铱卡宾物种Int A,随后与三级胺中的C−H键活化形成过渡态Int B。α−N初级C−H键的协同氢转移到手性中心,得到手性叔胺3和阳离子铱卟啉,完成催化循环。
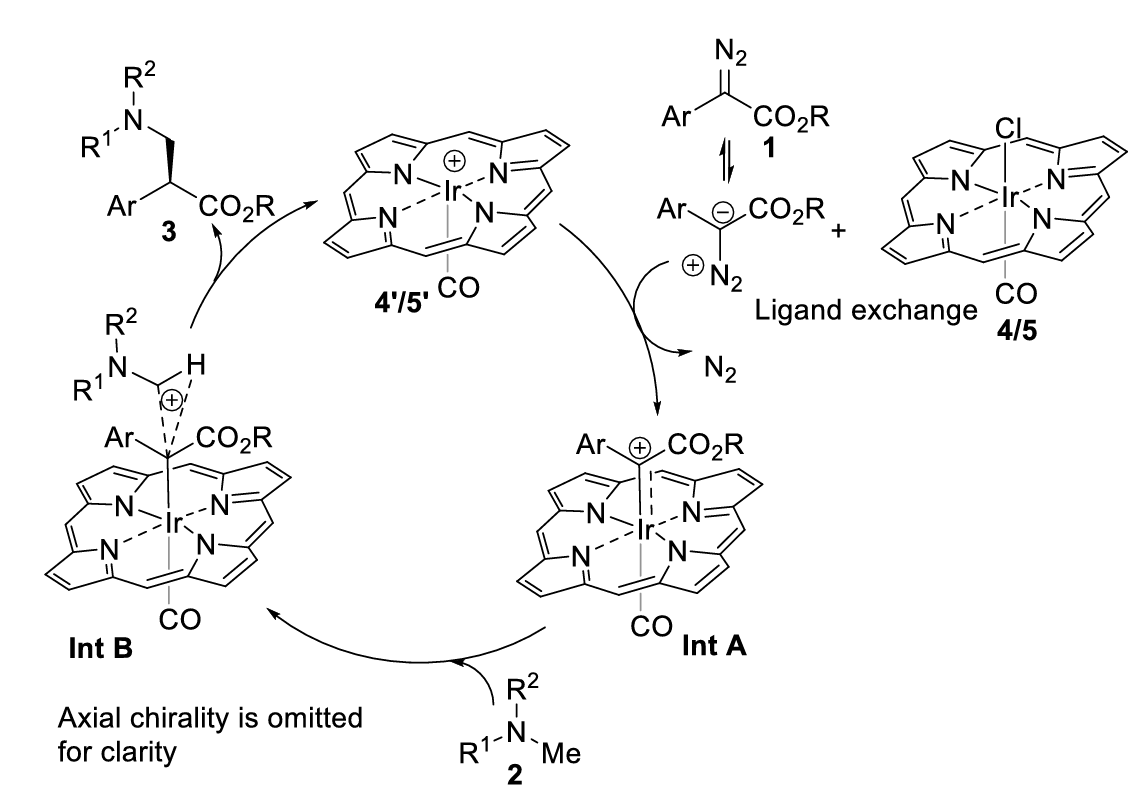
图9. 可能的机理
综上所述,作者报道了一种通过轴手性β-芳基铱卟啉催化N-Me C(sp3)−H键烷基化高产率高对映选择性合成β-手性叔胺的方法。未保护的含N-甲基的芳胺或脂肪族胺都能适用与该反应。对手性天然生物碱的后修饰,体现出铱卟啉的高度非对映选择性。该方法在对具有N-甲基结构的手性生物碱天然产物立体发散衍生方面的拥有着巨大潜力。
相关研究发表在J. Am. Chem. Soc.期刊上,同济大学郑生财研究员和赵晓明教授为共同通讯作者。同济大学博士研究生袁珊珊为文章的第一作者。课题组李圣雨,蔺亚洲同学对实验也提供了帮助。同济大学(中央高校基本科研业务费专项资金项目)和国家自然科学基金委员会(NSFC 22171213)为工作提供了资金支持。萍乡学院柯华老师对化合物单晶进行了测试和解析。最后,感谢来自大湾区大学的李忠良教授和余鹏教授的一些建设性讨论。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Alkylation of Primary C(sp3)−H Bonds in N-Methyl Tertiary Amine Enabled by Iridium Complex of Axially Chiral β-Aryl Porphyrins
Shanshan Yuan, Sheng-Yu Li, Xiao-Ming Zhao*, Ya-Zhou Lin, Sheng-Cai Zheng*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c12449
导师介绍
郑生财
https://www.x-mol.com/university/faculty/378997
赵晓明
https://www.x-mol.com/university/faculty/13433
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Nat. Chem.:烷基叔胺的γ-C(sp3)–H键芳基化 2020-02-24
-
铱催化脂肪胺的β-选择性C(sp3)−H键硅化反应 2019-02-15
-
C₄-对称轴手性β-芳基卟啉设计与合成及其金属铱络合物的不对称催化应用 2024-05-13
-
铱催化的不对称还原胺化合成手性β-芳基胺 2016-06-16







































 京公网安备 11010802027423号
京公网安备 11010802027423号