可见光驱动1,3-硼迁移高效合成α-叔胺
α-叔胺作为药物分子和生物活性分子的重要骨架,其合成一直是合成化学研究的热点。传统的N-叔烷基化反应往往受到底物空间位阻大、反应活化能垒高等因素的限制。为了解决这些问题,中国科学院上海有机化学研究所陈以昀(点击查看介绍)课题组与郑州大学蓝宇(点击查看介绍)课题组近日在这一领域取得了重要突破,首次实现了可见光驱动的1,3-硼迁移至酮亚胺,高效构建了N-叔烷基化产物(图1)。
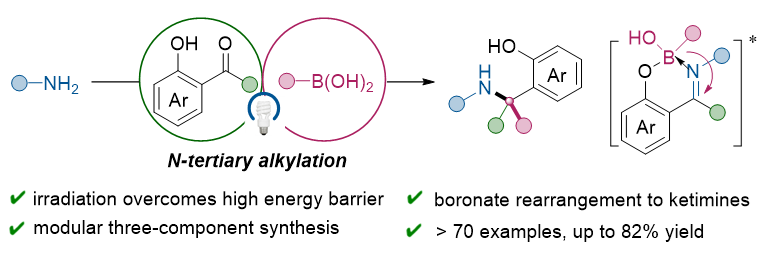
图1. 可见光驱动1,3-硼迁移:高效合成α-叔胺新方法
α-叔胺作为药物分子和生物活性分子的重要组成部分,其合成一直备受关注。N-叔烷基化反应是构建α-叔胺结构的经典方法,但传统方法因底物空间位阻大,面临反应能垒高、副反应多等挑战。因此,开发高效、简便的N-叔烷基化新方法具有重要意义。有机硼酸因其易得、环境友好等特点,在有机合成中得到了广泛应用。相比于传统的过渡金属催化硼酸偶联反应,硼迁移反应无需过渡金属,具有操作简便的优势。经典的Petasis反应通过1,4-硼迁移至高活性的醛亚胺阳离子,实现了三组分N-仲烷基化反应。然而,由于酮亚胺的反应活性低,传统的Petasis反应无法实现酮亚胺的硼迁移(图2a)。本研究首次实现了可见光驱动的1,3-硼迁移至酮亚胺的三组分N-叔烷基化反应,底物范围适用于烷基、芳基和烯基硼酸。研究发现,反应原位生成的苯酚酮亚胺螯合的四配位硼复合物在可见光照射下跃迁至激发态,促进了区域选择性的1,3-硼迁移,高效合成了一系列结构新颖的邻羟基α-叔苄胺类化合物(图2b)。
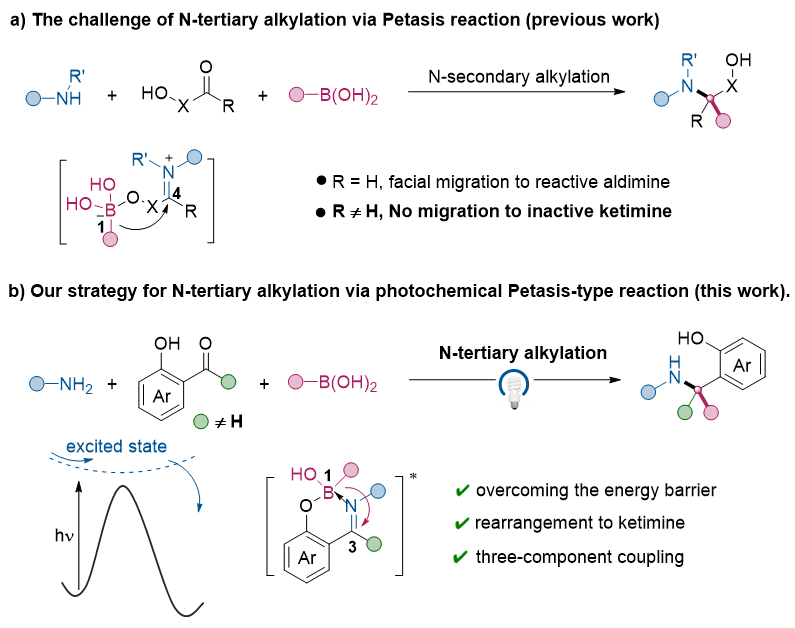
图2. 光化学1,3-硼迁移实现三组分N-叔烷基化反应
陈以昀课题组在有机硼的光化学反应研究领域深耕多年,取得了卓著的成就。自2014年起,该课题组率先发展了基于环状三价碘试剂BI-OH的可见光催化体系,实现了烷基硼酸的氧化及一系列生物相容的交叉偶联反应(J. Am. Chem. Soc. 2014, 136, 2280; Angew. Chem., Int. Ed. 2015, 54, 1881; Chin. J. Chem. 2018, 36, 1209)。随后,他们巧妙设计了烷基硼酸与酮酸的分子复合物,在可见光激发下实现了直接的酮酸加成反应,并解决了自由基羰基加成反应的可逆性难题(J. Am. Chem. Soc. 2019, 141, 16237)。在此基础上,该课题组将研究重点转向了四配位硼的光化学性质,特别是激发态硼迁移反应。通过系统研究各种酮类和有机硼酸形成的四配位硼络合物,他们首次成功实现了1,3-二酮与有机硼酸形成的四配位硼络合物在可见光激发下的选择性1,3-硼迁移,高效构建了一系列具有重要应用价值的β-羰基叔醇化合物(Angew. Chem. Int. Ed. 2024, e202316481),文章被评为当月阅读量最多文章。
在课题组前期光化学硼迁移至酮反应的基础上,本研究创新性地设计了脂肪胺、邻苯酚酮和有机硼酸的三组分偶联反应。研究发现,邻苯酚酮亚胺与三乙基硼原位形成的苯酚酮亚胺螯合四配位硼复合物,在蓝光激发下发生选择性1,3-硼迁移,得到α-叔胺产物3(图3a)。在证实1,3-硼迁移至酮亚胺的反应性可行之后,作者进一步将该反应拓展至烷基伯胺、邻苯酚酮和硼酸的三组分反应以实现N-叔烷基化(图3b)。随后,作者对底物范围进行了考察(图3c)。该反应可以较好地兼容连有杂环(吡啶、吲哚、吗啉等)和亲电基团(氰基等)的伯胺底物,此外,大宗工业原料甲胺等也可以顺利发生N-叔烷基化反应。邻羟基芳基酮的芳环上的取代基(不同电性取代和不同位置取代)不会影响反应的顺利进行,同时,不同链长的烷基酮也能较好地参与反应。各种一级烷基和二级烷基硼酸均能顺利发生反应,芳基和烯基硼试剂也能以中等的收率得到目标产物。总的来说,该反应具有广泛的底物普适性,能够兼容多种结构的烷基伯胺、邻苯酚酮以及烷基、芳基和烯基硼酸,可以模块化地合成结构多样的邻羟基苄胺类化合物,并表现出优异的化学选择性和官能团耐受性。
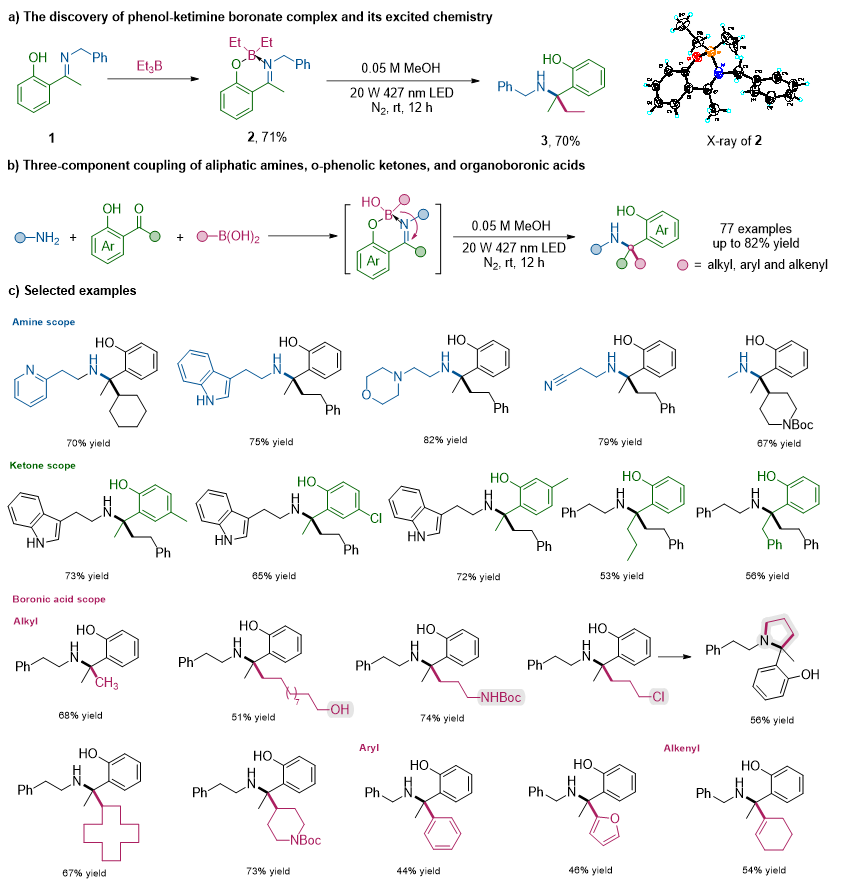
图3. 三组分N-叔烷基化反应的发现及底物拓展
紧接着,作者对反应机理进行了深入的研究。自由基钟和自由基淬灭实验有力地排除了自由基加成机理(图4a-b),氧气淬灭实验说明该反应经历三线态途径(图4c)。M06-2X/6-31G*密度泛函理论(DFT)计算表明,可见光激发苯酚酮亚胺螯合的四配位硼复合物至激发态后,有效克服了基态1,3-硼迁移至酮亚胺的高能垒(51.3 kcal/mol,图4d),从而促进了分子内重排。基于以上机理实验,作者提出可能得反应机理(图4e)。首先烷基伯胺与邻羟基芳基酮缩合形成酮亚胺,其与硼酸原位配位络合形成四配位硼中间体I,其经光激发得到单线态I-S1,再经历系间窜越得到三线态的中间体I-T1,再发生1,3-迁移至酮亚胺位点得到中间体II,该中间体原位水解脱除无机硼酸即可得到N-叔烷基化产物。
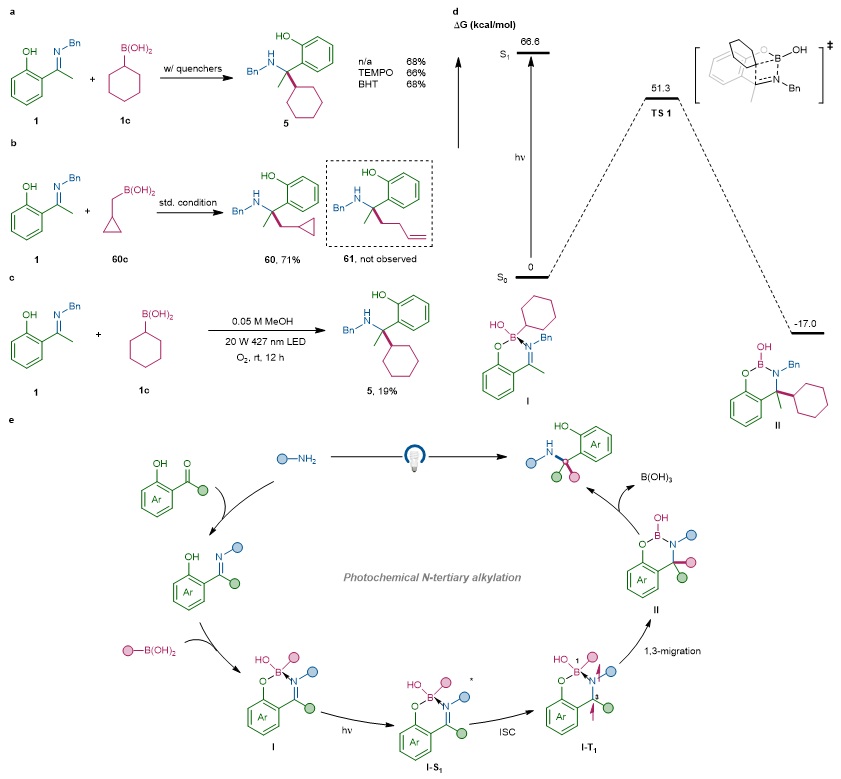
图4. 机理研究
最后,作者考察该方法在合成中的应用价值。反应可以进行克级规模的制备,产物也可进一步与亲电试剂发生环化反应得到各种有价值的氮杂环化合物(图5a)。此外,该方法成功应用于多种复杂生物活性分子和药物分子类似物(油胺、香叶胺、多巴胺衍生物、莫沙必利前体、阿托伐他汀前体、去乙酰基利奈唑胺、血清素以及阿莫地平等)的后期修饰,展示了其在药物发现和合成中的巨大潜力,被评审专家评价具有Click反应的特点(图5b)。反应也可以通过季碳中心的引入实现赖氨酸和酪氨酸、血清素和雌酮的偶联,为复杂生物活性分子的构建提供了新的思路(图5c)。作者进一步将该反应用于芬地林和阿莫地喹类似物的合成,期望通过季碳中心的引入提高生物活性(图5d-e)
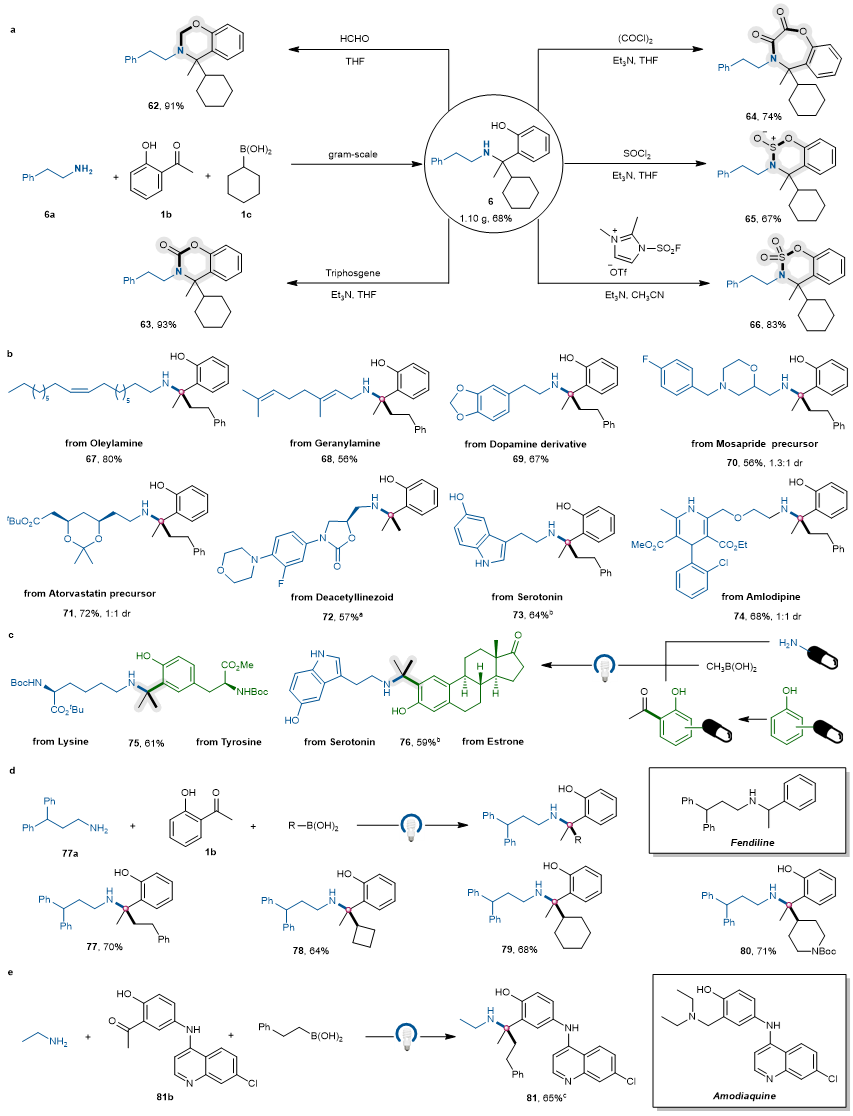
图5. 合成应用
综上所述,该研究首次揭示了激发态四配位硼复合物迁移至酮亚胺的光化学转化,为传统热化学四配位硼迁移无法实现的化学转化提供了全新的解决思路。该反应无需任何添加试剂,反应条件温和,具有较好的官能团兼容性和化学选择性,可以模块化地合成有价值的α-叔胺化合物。这一发现有望在药物化学、材料化学和化学生物学等领域开辟新的研究方向。
该研究成果发表于《自然通讯》 (Nature Communications),上海有机所博士研究生邹鹏、郑州大学博士研究生付东民和上海有机所硕士研究生王昊阳为共同第一作者,上海有机所陈以昀研究员和郑州大学蓝宇教授为共同通讯作者。该研究得到了国家自然科学基金委重点项目、中国科学院战略性先导科技专项、和生命过程小分子调控全国重点实验室的大力支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical 1,3-Boronate Rearrangement Enables Three-Component N-alkylation for α-tertiary Hydroxybenzylamine Synthesis
Peng Zou1, Dongmin Fu1, Haoyang Wang1, Ruoyu Sun, Yu Lan*, and Yiyun Chen*
Nat. Commun. 2024, 15, 10234. DOI: 10.1038/s41467-024-54165-6
导师介绍
蓝宇
https://www.x-mol.com/university/faculty/18642
陈以昀
https://www.x-mol.com/university/faculty/15580
陈以昀课题组主页:

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号