靶向谷胱甘肽过氧化物酶4纳米抗体作为新型的铁死亡诱导剂
铁死亡是近年来定义的一种新型细胞死亡形式,其特征是由不受限制的脂质过氧化和随后的膜损伤导致的铁依赖性细胞死亡。越来越多的研究表明,铁死亡在肿瘤、神经退行性疾病和组织缺血再灌注损伤等病理过程中发挥着重要作用。谷胱甘肽过氧化物酶4(Glutathione peroxidase 4, GPX4)是细胞铁死亡的关键靶点,经药物治疗的肿瘤细胞耐药株的生存高度依赖GPX4,因此GPX4抑制剂被视为解决肿瘤耐药问题的重要途径。但GPX4的活性位点附近结构相对扁平,是一个较难成药的靶点,开发GPX4的小分子抑制剂具有非常大的挑战。目前GPX4的小分子抑制剂大多存在生物利用度低、选择性较差等问题,亟需开发新型GPX4抑制剂。
基于此,中国海洋大学医药学院邱雪团队、王勇团队和华南农业大学徐振林团队在Chemical Science 在线发表研究论文,成功开发了一种可以靶向GPX4并诱导肿瘤细胞发生铁死亡的纳米抗体,这一成果显示了纳米抗体抑制剂在抗肿瘤治疗方面的应用潜力,为铁死亡相关的抗肿瘤治疗提供了新思路,为传统难以成药的靶点提供了新的纳米抗体研究范例。
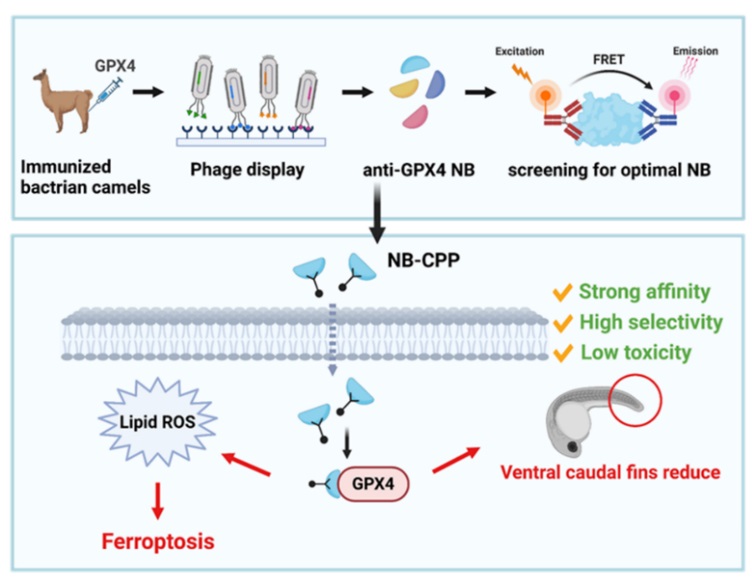
Scheme 1. Flowchart of the preparation of NB and its mechanism of inducing ferroptosis in cells. Image sourced from Chemical Science.
本研究通过构建噬菌体展示文库筛选靶向GPX4纳米抗体,并利用细胞穿膜肽作为辅助手段,通过正构调节直接抑制GPX4活性的策略开发具有诱导细胞铁死亡活性的纳米抗体(Scheme 1)。
首先,利用通过异源表达制备AllCys(-)GPX4U46C重组蛋白作为免疫原,选用健康双峰驼进行多次免疫实验。通过酶联免疫吸附试验确定双峰驼体内产生有效的纳米抗体后,在其外周血的淋巴细胞中提取纳米抗体相关基因,并使用该基因库构建纳米抗体噬菌体文库。经生物淘筛筛选出特异性靶向GPX4的纳米抗体菌株,通过测序解析其基因序列并对其氨基酸序列进行分析。本研究共筛选出7种在CDR3区域具有不同氨基酸序列的纳米抗体,并通过大肠杆菌系统表达后得到了4种溶解度较好且表达量较高的纳米抗体,即4C、5C、5F和12E。随后研究者采用置换型的荧光共振能量转移(Förster Resonance Energy Transfer, FRET)和表面等离子共振(Surface Plasmon Resonance, SPR)等技术评价纳米抗体与GPX4的特异性结合(Figure 1)。结果表明4C、5C、5F和12E等四种纳米抗体均与GPX4具有很高的亲和力,其中经SPR测得的亲和力分别为5.8 nM、4.3 nM、4.1 nM和11.2 nM。
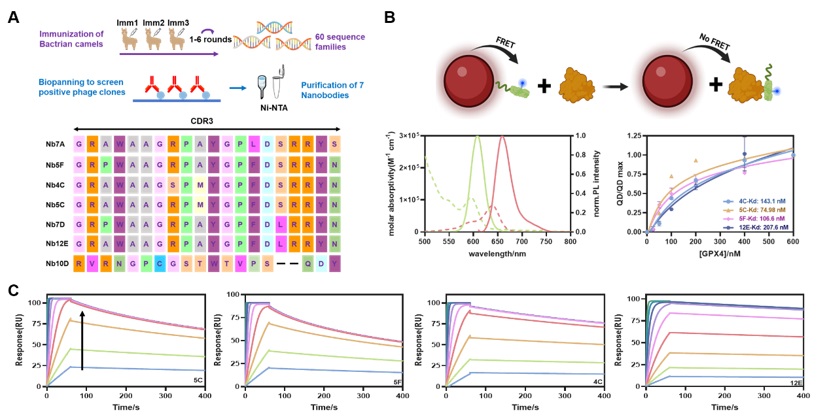
Figure 1. A, Flowchart of anti-GPX4 NB screening and amino acid sequences of NBs with different CDR3 domains. B, QD-to-dye FRET assay to determine the GPX4 affinities of NBs. Down-left: absorption (dotted) and FL emission (solid) spectra of QD605 and Cy5-NHS. Down-right: saturation binding curve of GPX4 and NBs by QD-to-Cy5 FRET assay. C, Kinetic binding curves of GPX4 and NBs determined by SPR. The arrow indicated the concentrations of NBs increased from 1.95 nM to 500 nM. Image sourced from Chemical Science.
在成功筛选获得具有高亲和力的纳米抗体后,研究者利用多种生物物理或生物化学技术手段考察纳米抗体的结合位点。首先,利用“三明治夹心”FRET技术筛选能够结合在GPX4活性位点并具有潜在抑制GPX4活性功能的纳米抗体。FRET供体Cy3通过N-羟基琥珀酰亚胺(NHS)基团随机标记到纳米抗体表面的氨基上,而RSL3/ML162 等GPX4小分子抑制剂经Cy5衍生化可以作为FRET受体发挥FRET示踪剂的作用。如果纳米抗体和小分子抑制剂RSL3/ML162结合在GPX4的不同位点,即可形成Cy3-NB-GPX4-RSL3-Cy5三元复合物,继而产生FRET信号。若二者竞争结合在GPX4的同一位点则难以形成三元复合物,表现为没有FRET信号或者较低的FRET信号(Figure 2)。实验结果表明,纳米抗体12E和5C较难形成三元复合物,推测12E和5C与RSL3或ML162在GPX4的结合位点比较接近,可能结合在GPX4的活性位点。
随后研究者通过分子对接,分子动力学模拟及GPX4突变等实验证实了上述推论。分子对接结果表明,纳米抗体12E(蓝色)和5C(黄色)均覆盖在GPX4的活性位点,分子动力学模拟显示纳米抗体12E与GPX4形成的复合物具有更高的稳定性。之后通过对GPX4的活性位点、靠近活性位点以及远离活性位点的氨基酸簇上进行突变,利用时间分辨FRET和SPR等技术检测GPX4突变体与12E的亲和力,结果表明在GPX4活性位点突变的突变体几乎丧失了与12E的结合能力(Figure 2)。以上直接或间接的分析结果表明,纳米抗体12E以高亲和力结合在GPX4的活性位点,并具有潜在的抑制GPX4活性并诱发细胞铁死亡的功能。
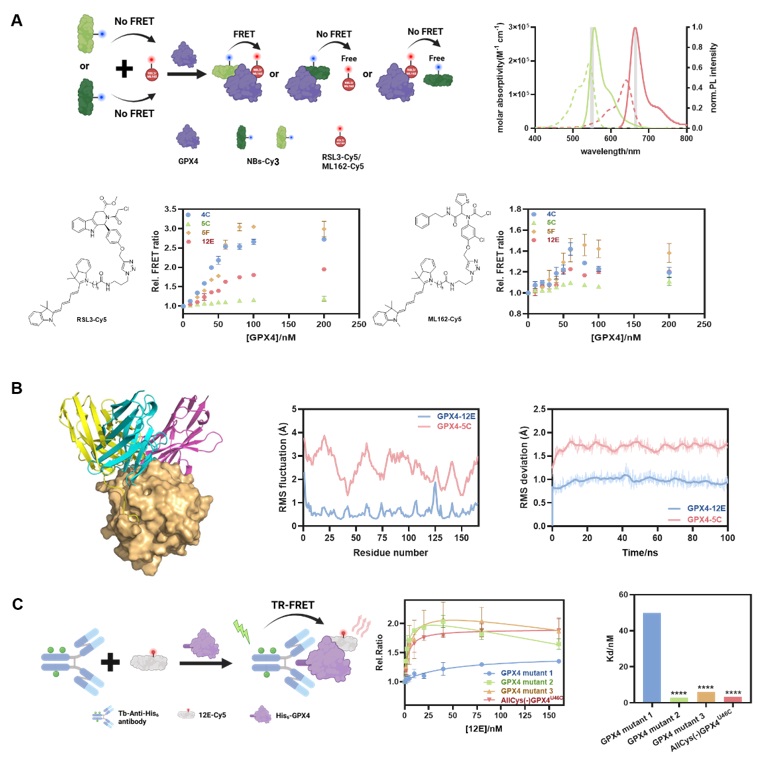
Figure 2. FRET measurement of the formation of NB-GPX4-RSL3 ternary complex. Up-left: schematic representation of the FRET assay. Up-right: absorption (dotted) and emission (solid) spectra of Cy3-NHS (green) and Cy5-NHS (red). Down: FRET responses of GPX4 to different combinations of RSL3-Cy5 (left) /ML162-Cy5 (right) and four NBs. B, Molecular modeling and molecular dynamics simulation. Left: molecular modeling of GPX4 and NBs 12E (blue), 4C (purple) and 5C (yellow). Middle and right: RMSF and RMSD of GPX4-12E and GPX4-5C complexes. C, TR-FRET measurement for the affinity tests of GPX4 mutants and 12E. Left: schematic representation of the TR-FRET measurement. Middle: affinity binding curves of GPX4 mutants and 12E via TR-FRET. Right: the Kd values of GPX4 mutants and 12E via TR-FRET. Image sourced from Chemical Science.
为了验证以上推断,研究者将纳米抗体12E递送到细胞内,并测试了其诱导细胞铁死亡的能力。在纳米抗体的C端融合表达能够辅助其进入细胞的穿膜肽R10(NB-R10),使用Cy5对NB-R10表面氨基进行随机标记,随后将NB-R10-Cy5和一种硫代硝基苯甲酸偶联的富精氨酸的小肽TNB-R10共孵育细胞,共聚焦成像结果表明NB-R10能够成功被人正常肝细胞(L-02)、人肾癌细胞(OS-RC-2)和人神经母细胞瘤细胞(SH-SY5Y)等细胞摄取。细胞活力测试结果显示,12E-R10具有较强的细胞铁死亡诱导活性(IC50=0.56 μM),并且这种诱导活性可以被铁死亡抑制剂Fer-1逆转。更重要的是,12E-R10对正常细胞L-02的毒性较小,表现出良好的细胞选择性。其它的铁死亡相关生物学指标检测结果显示,12E-R10孵育细胞后,胞内的丙二醛(MDA)和前列腺素合成酶2(PTGS2)mRNA水平均显著升高;此外,12E-R10可以明显抑制外源和内源的GPX4WT的活性,以上细胞和分子水平的测试说明12E-R10通过直接抑制GPX4的活性诱发了细胞的铁死亡(Figure 3)。
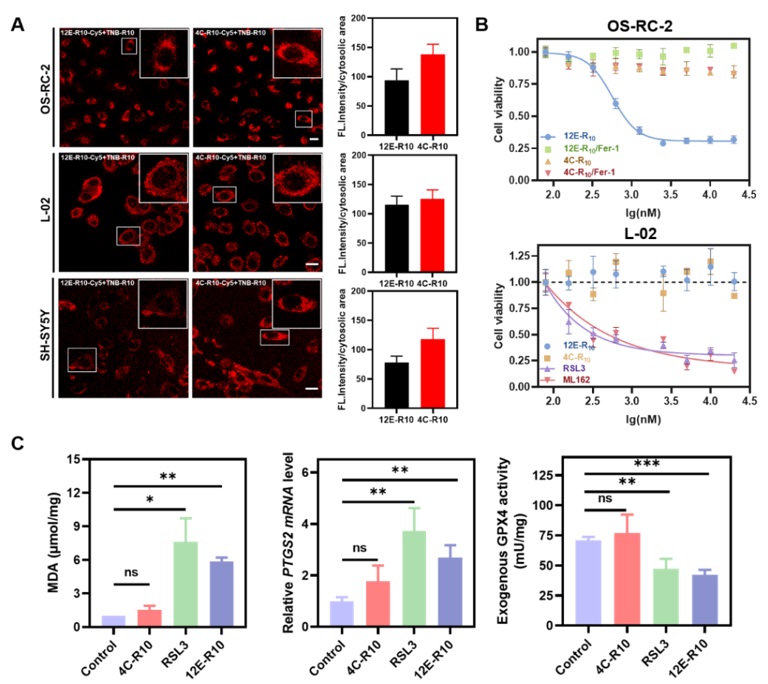
Figure 3. Intracellular delivery efficiency of NB-R10 fusion protein with TBN-R10 additives. CLSM images of OS-RC-2 cells, L-02 cells and SH-SY5Y cells incubated with 5 μM 12E-R10-Cy5 or 4C-R10-Cy5 and 10 μM TNB-R10 for 1 h at 37 ℃. B, Viabilities of OS-RC-2 cells and L-02 cells incubated with 12E-R10/4C-R10 and 10 μM TNB-R10 with or without the presence of ferrostatin-1 for 12 hrs at 37 ℃. C, Bio-evaluations of ferroptosis related parameters. Left: MDA assay. Middle: PTGS2 mRNA detection. Right: exogenous GPX4WT activity. Image sourced from Chemical Science.
除此之外,12E在模式动物斑马鱼体内表现出靶向GPX4的高选择性和专一性以及良好的安全性,突显了纳米抗体在GPX4相关机制研究和药物开发的巨大潜力,也为传统难以成药的靶点提供了新的纳米抗体研究范例。
中国海洋大学医药学院博士研究生李鑫雨为论文第一作者,中国海洋大学邱雪教授、王勇教授、华南农业大学徐振林教授为共同通讯作者。本工作得到了青岛海洋科技中心科技创新项目,山东省泰山学者青年专家项目、山东省优青、国家自然基金青年科学基金等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A potent and selective anti-glutathione peroxidase 4 nanobody as a ferroptosis inducer
Xinyu Li, Yaru Li, Aowei Xie, Fenglin Chen, Jing Wang, Jianfeng Zhou, Ximing Xu, Zhenlin Xu*, Yong Wang*, Xue Qiu*
Chem. Sci., 2024, DOI: 10.1039/d4sc05448b
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
电荷转移多功能纳米粒子肿瘤铁死亡和NIR-II光热治疗性能研究 2021-01-25
-
Fe2+供给再生纳米药物用于肿瘤细胞特异性铁死亡治疗 2019-01-11
-
诱导肿瘤细胞凋亡-铁死亡的铱(III)纳米双光子光敏剂 2022-06-01
-
ML162 derivatives incorporating a naphthoquinone unit as ferroptosis/apoptosis inducers: Design, synthesis, anti-cancer activity, and drug-resistance reversal evaluationEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-04-06 ,DOI:10.1016/j.ejmech.2024.116387Furong Ma, Yulong Li, Maohua Cai, Wenyan Yang, Zumei Wu, Jinyun Dong, Jiang-Jiang Qin
-
A potent GPX4 degrader to induce ferroptosis in HT1080 cellsEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2023-12-31 ,DOI:10.1016/j.ejmech.2023.116110Haoze Song, Jing Liang, Yuanyuan Guo, Yang Liu, Kuiru Sa, Guohong Yan, Wen Xu, Wei Xu, Lixia Chen, Hua Li
-
Discovery of ML210-Based glutathione peroxidase 4 (GPX4) degrader inducing ferroptosis of human cancer cellsEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2023-04-07 ,DOI:10.1016/j.ejmech.2023.115343Han Wang, Chao Wang, Bingru Li, Cangxin Zheng, Guoquan Liu, Zhenming Liu, Liangren Zhang, Ping Xu
-
Evodiamine Exhibits Anti-Bladder Cancer Activity by Suppression of Glutathione Peroxidase 4 and Induction of Ferroptosis.International Journal of Molecular Sciences (IF 4.9) Pub Date : 2023-03-23 ,DOI:10.3390/ijms24076021Che-Yuan Hu,Hung-Tsung Wu,Yan-Shen Shan,Chung-Teng Wang,Gia-Shing Shieh,Chao-Liang Wu,Horng-Yih Ou








































 京公网安备 11010802027423号
京公网安备 11010802027423号