Science:光/磷重塑羧酸骨架
羧酸是一类在药品和精细化学品生产中用途广泛的原料。然而,与它们有关的直接光化学反应的研究尚不充分,部分原因在于它们的光激发过程能量需求高(吸收边缘在远紫外范围内)且量子效率低。与羧酸相比,同样含有羰基的酮类和醛类化合物的光化学转化研究就更受关注,历史可以追溯到Norrish小组(1937)首次报道光激发酮以及Yang小组(1958)观察到激发态酮发生快速裂解。特别值得一提的是,光促进羰基化合物的[2+2]环加成反应(如:Paterno-Büchi和DeMayo反应)广泛已经应用于复杂分子的合成。然而,这种光激发策略却面临着以下挑战(图1A):1)如何控制α-裂解——会驱动C-C键均裂并产生两种自由基物种(Norrish I型);2)可能会发生氢原子转移(HAT)过程并生成副产物烯醇和烯烃(Norrish II型)。尽管化学家利用能量转移策略来激发不饱和体系的碳-碳双键以形成三线态双自由基,但是羧酸衍生物羰基的能量转移过程需要更高的能量,进而阻碍了这一途径。
日前,美国西北大学的Karl A. Scheidt教授(点击查看介绍)课题组利用光/磷协同催化策略,成功地实现了羧酸骨架的多样性重塑(包括:环化、缩环、扩环,图1C),并高效合成了具有广泛生物活性的α-羟基和氨基膦酸酯(图1D)。此外,机理研究揭示了酰基膦酸酯中间体的光物理性质,而密度泛函理论(DFT)计算阐明了反应的选择性和过渡态能垒等机理问题。相关成果发表在Science 上。
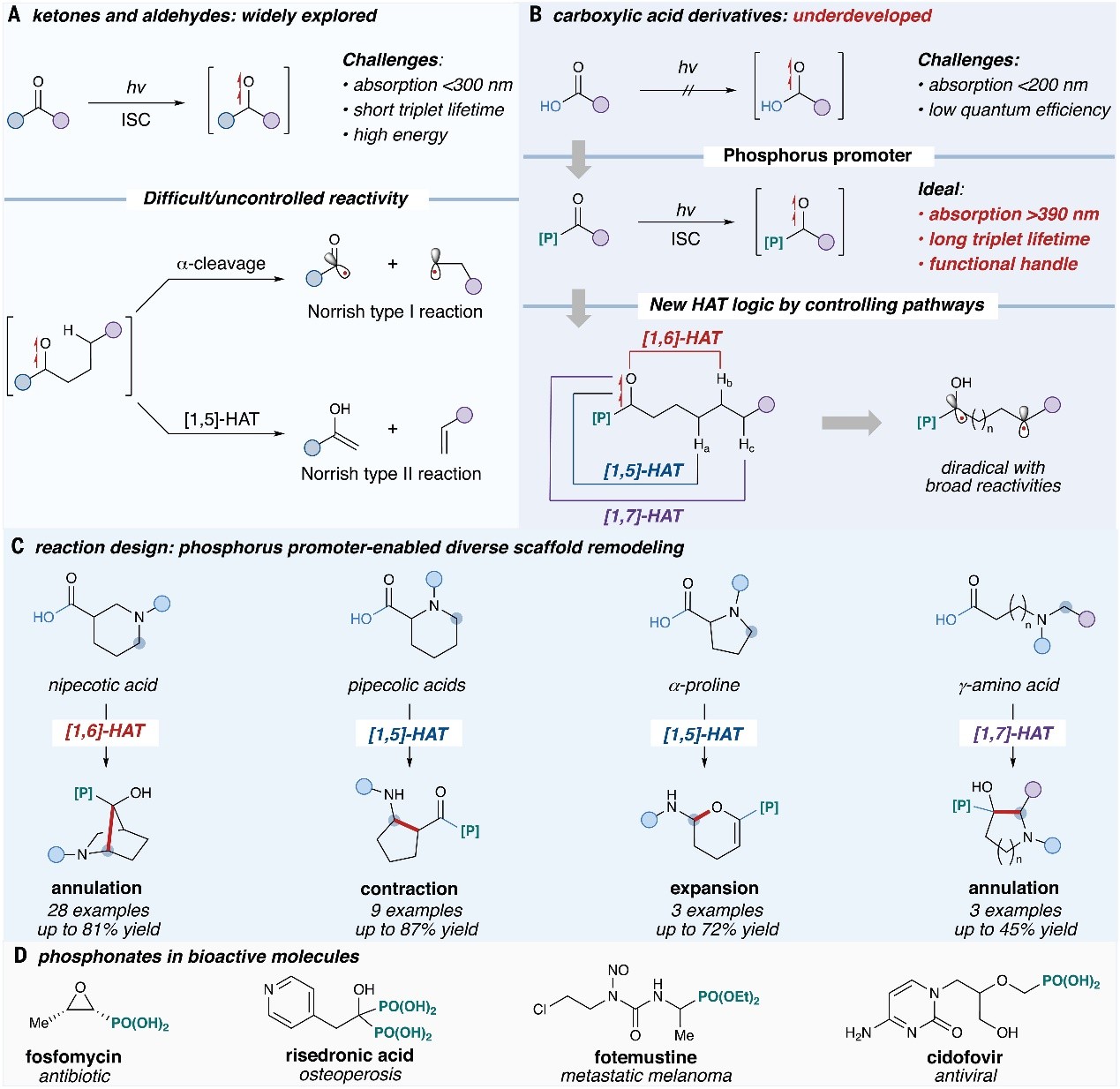
图1. 可见光下羧酸骨架的重塑。图片来源:Science
如图2A所示,该反应的具体过程如下:以多种羧酸为底物,在草酰氯和亚磷酸三甲酯的活化下生成酰基磷酸酯,再在光激发下生成单线态双自由基,然后发生系间窜越得到三重态激发态。对于β-和γ-氨基酸,生成的三重态双自由基会分别经历选择性[1,6]-HAT或[1,7]-HAT过程并形成[1,5]-双自由基、[1,6]-双自由基中间体,其经分子内自由基偶联和环化过程形成相应产物。此外,α-脯氨酸倾向于经历[1,5]-HAT过程并得到[1,4]-双自由基中间体,再经C-N键均裂生成含亚胺和烯醇的物种,随后发生O-亲核加成形成相应的扩环产物;而哌啶酸经相同的策略形成含亚胺和烯醇的中间体,经Mannich反应形成最终的缩环产物。随后,作者选择酰基膦酸酯1a为模板底物对反应条件进行优化(图2B),结果显示非极性溶剂能以高产率和中等的非对映选择性获得所需产物,而极性溶剂却以中等的转化率获得相应产物,特别是该过程能从羧酸出发以三步、66%的总产率获得2.4 g 2a且无需柱色谱纯化。此外,羧酸底物上其它保护基(如:N-Ns(1b)、N-Fmoc(1c)和大位阻N-trisyl(1d))也能顺利实现这一转化,并且大位阻基团有助于提高反应的非对映选择性。另一方面,一系列对照实验证明光对于双自由基物种的产生至关重要(图2C),具体而言:1)向反应中加入自由基清除剂(如:TEMPO)会显著降低总产率,进而支持了单电子过程;2)在三重态淬灭剂氧气的存在下进行反应时产率有所降低。值得注意的是,向反应中加入10.0 equiv水并不会阻碍所需产物的形成。

图2. 反应设计和条件筛选。图片来源:Science
在最优条件下,作者对该反应的底物范围进行了考察(图3),结果显示苯环上带有不同电性基团的β-氨基酸(2e-2j)以及萘基(2k)、呋喃(2l)、线性烷基(2m-2o)、炔丙基(2p)、烯丙基(2q)、环丙烷(2r)、环己烷(2s)和四氢-2H-吡喃(2t)取代的β-氨基酸均能兼容该反应,以中等至较好的产率和非对映选择性获得所需产物,特别是环丙烷取代的底物仅生成环化产物(2r),这说明五元环的形成比环丙烷的开环更快。其次,β-羟基酸和β-硫代酸衍生物可有效转化为相应的四氢呋喃(2u)和四氢噻吩(2v)骨架,同时氨甲环酸(2w)、阿塔鲁伦(2x)、水杨酸衍生物(3a-3b)甚至环状β-氨基酸(如:哌啶甲酸(3c)、β-脯氨酸(3d))也能顺利实现这一转化,特别是3c和3d分别形成了更复杂的[2,2,1]或[2,1,1]桥环骨架。值得一提的是,该反应还能实现更具挑战性的[1,7]-HAT过程,尽管反应产率有所降低(3e-3g)。另外,α-羟基膦酸酯可在温和条件下与另一亲核试剂在ipso位或与亲电试剂在α位进行反应,并分别得到相应产物6(产率:79%)和7(产率:76%)。

图3. 底物拓展一。图片来源:Science
随后,作者研究了环状α-氨基酸的骨架重塑(图4),即通过磷促进剂诱导选择性[1,5]-HAT过程,而且在Mannich反应或O-亲核加成反应之前利用该过程可实现缩环或扩环。若亲核试剂在光照前引入,则形成相应的酰胺,但是酰胺在相同的光化学条件下不能转化为缩环产物。进一步研究发现四氢异喹啉(4a)、哌嗪(4b)、吗啉(4c)和硫代吗啉(4d)衍生物均可实现这一转化,并以中等至较好的产率(52-83%)和非对映选择性(4.5:1->20:1 d.r.)获得相应的缩环产物。其次,将手性磷酸(R)-TRIP催化剂引入反应体系后能以优异的对映选择性(93% ee)获得cis-2-氨基-1-环戊烷羧酸衍生物(4e),同时手性二取代哌啶进行反应时也能以优异的转化率和非对映选择性获得三取代环戊烷产物4i,并通过X-射线衍射分析确定其绝对构型。另外,在最后一步加入不同功能的亲核试剂后能实现阿莫沙平(4f)、L-Phe(4g)和D-核糖内酯(4h)的后期修饰。值得一提的是,以α-脯氨酸衍生物为原料,作者还实现了扩环反应并以良好的产率获得相应产物5a-5c,特别是产物5a能以5 mmol规模进行制备。
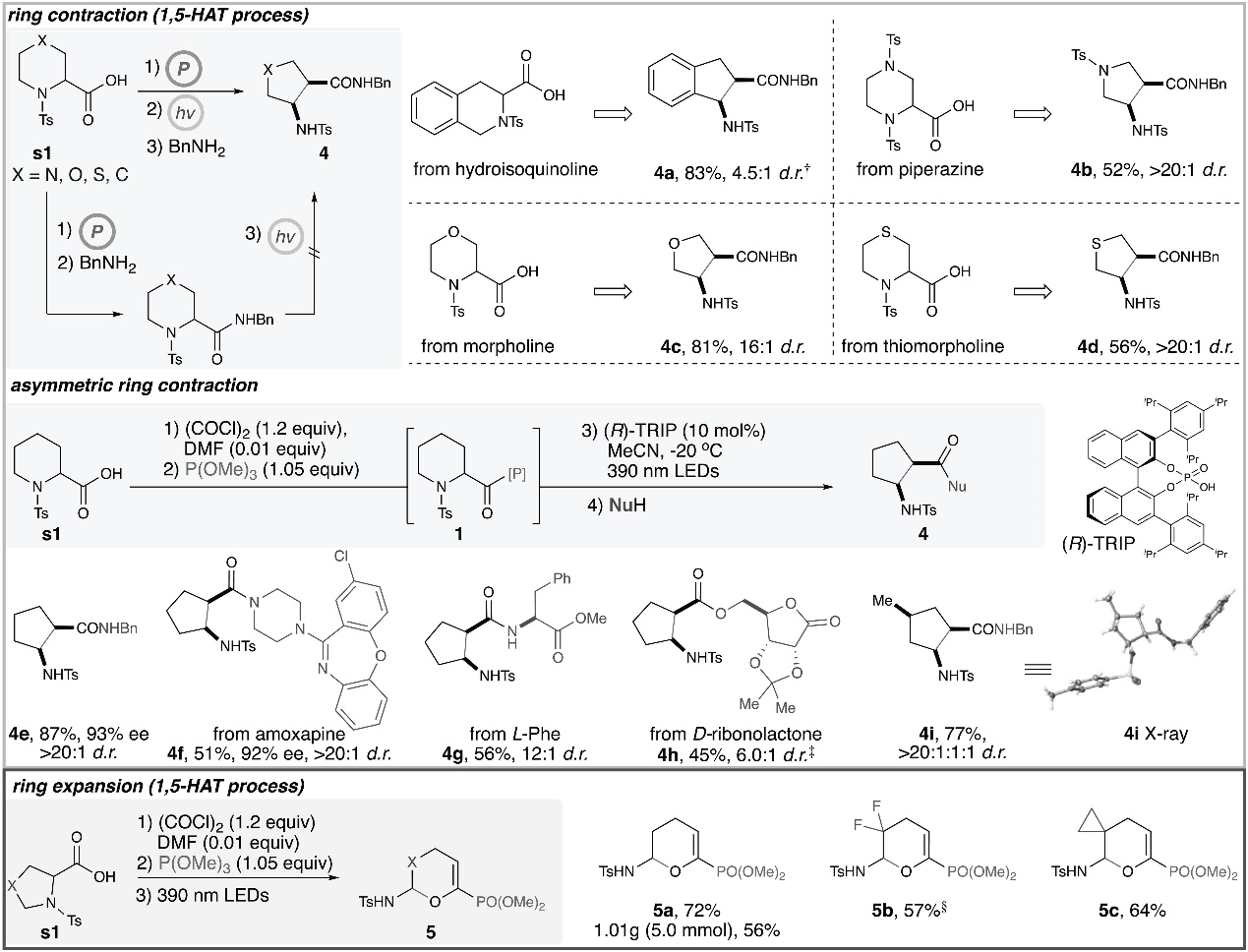
图4. 底物拓展二。图片来源:Science
为了进一步探究反应机理,作者进行了一系列实验,具体而言:1)与酮S1-3a、酯S1-3b和游离羧酸S1-3c相比,酰基膦酸酯中间体S1-3d进行反应时紫外可见吸收光谱发生红移(图5A),这表明S1-3d无需光敏剂即可在可见光下直接被激发;2)瞬态吸收光谱表明酰基膦酸酯S1-3d将三重态双自由基的半衰期显著提高至785±4 ns,而酮物种S1-3a的半衰期仅为195±2 ns,进而可推测二苯基膦酰基自由基比二甲氧基膦酰基自由基更稳定。因此,酰基氧化膦更倾向于Norrish type I 途径,而酰基膦酸酯S1-3d仅经历HAT过程。其次,密度泛函理论(DFT)计算表明该反应的第一步可能是酰基膦酸酯1d在390 nm波长光照下被激发(图5B),然后进行系间窜越(ISC)并生成三重激发态1d*。为了研究HAT步骤中控制选择性的因素,作者探索了中间体1d*参与的不同HAT途径,发现自旋密度显著集中在氧原子上,这与最低能量HAT步骤中选择性形成O-H键相一致。与观察到的高区域选择性一致,[1,6]-HAT通过TS1(从1d*→TS1只有7.0 kcal/mol)以较小的能垒形成热力学上更稳定的苄基[1,5]-双自由基A(-11.2 kcal/mol),可以经历不可逆的自由基-自由基C-C键偶联生成产物2d。相反,分别通过TS2和TS3进行的替代[1,4]-HAT和[1,5]-HAT途径的能垒明显比[1,6]-HAT过程更高(>3 kcal/mol)。尽管B自由基([1,3]-HAT)的形成在热力学上是有利的(-7.1 kcal/mol),但是[1,6]-HAT过程在动力学和热力学上均有利,这可能是由于环状过渡态的张力较小且所得的自由基中间体离域程度更大。最后,作者还研究了1d*中酰基碳通过TS1′形成C-H键的可能性,但由于TS1′的能垒远高于TS1(18.8 vs 7.0 kcal/mol),进而排除了这种可能性。
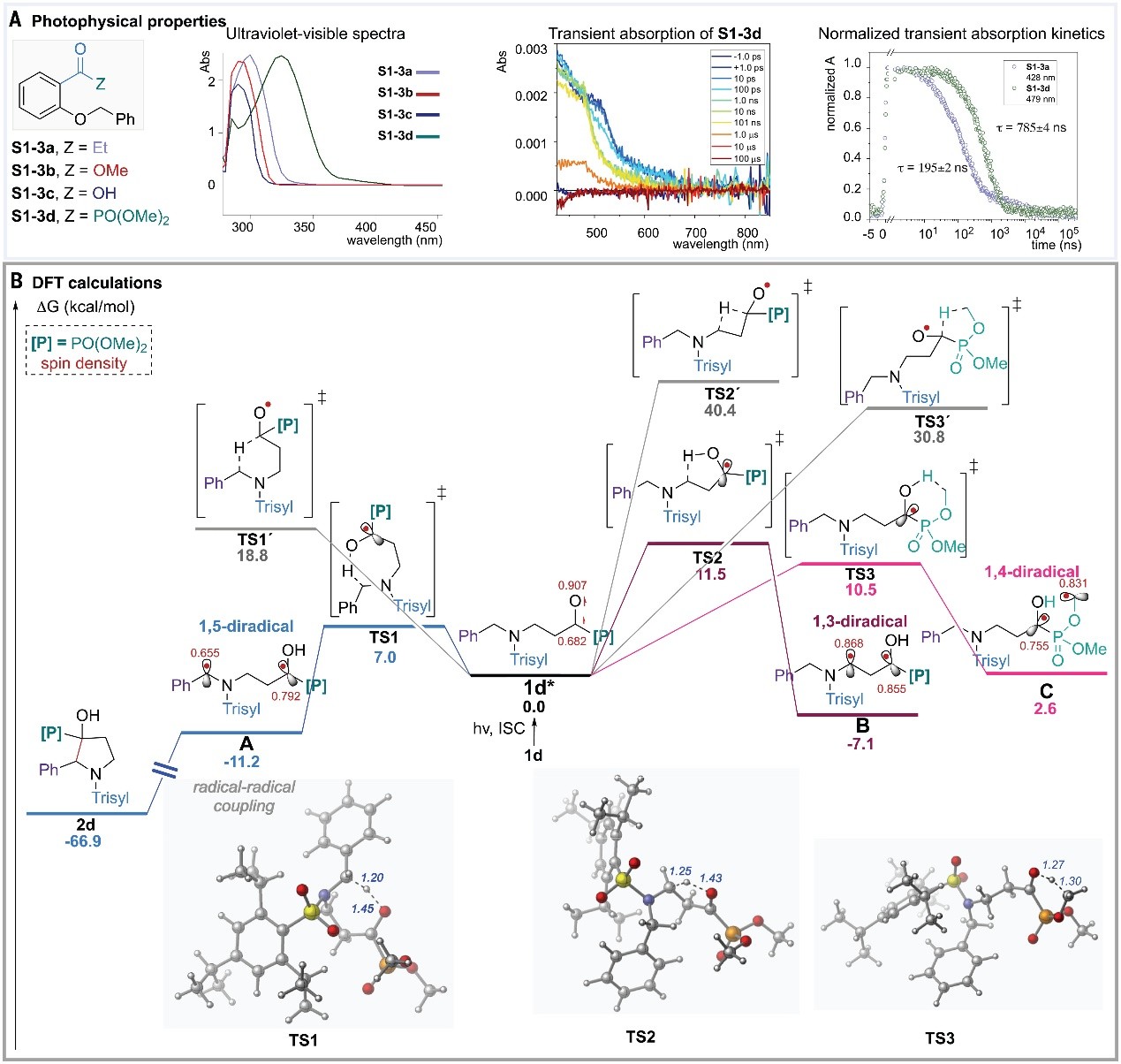
图5. 机理研究。图片来源: Science
总结
Scheidt教授团队利用光/磷协同催化策略,成功地实现了羧酸骨架的多样性重塑(包括:环化、缩环、扩环),并有效地合成了具有广泛生物活性的α-羟基和氨基膦酸酯。此外,机理研究揭示了酰基膦酸酯中间体的光物理性质,而DFT 计算阐明了反应的选择性和过渡态能垒等机理问题。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photochemical phosphorus-enabled scaffold remodeling of carboxylic acids
Qiupeng Peng, Meemie U. Hwang, Ángel Rentería-Gómez, Poulami Mukherjee, Ryan M. Young,Yunfan Qiu, Michael R. Wasielewski, Osvaldo Gutierrez, Karl A. Scheidt
Science, 2024, 385, 1471-1477. DOI: 10.1126/science.adr0771
导师介绍
Karl A. Scheidt
https://www.x-mol.com/university/faculty/396
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号