基于氢原子转移的I-型光动力治疗光敏剂设计
光动力治疗(PDT)通过光敏剂在特定波长光照射下敏化分子氧生成活性氧,从而杀灭肿瘤细胞。与传统II-型光敏剂产生的单线态氧不同,I-型光敏剂在生成活性氧的同时,能通过电子/氢原子转移直接破坏生物分子,从而表现出更好的乏氧适应性。因此,I-型光敏剂的设计与开发成为近年来PDT领域的研究重点。
在此背景下,北京师范大学杨清正(点击查看介绍)团队提出了两种I-型光敏剂的设计策略:第一,抑制能量传递,通常是通过降低光敏剂的三重态能级低于基态氧到单线态氧所需要的能量,从而阻断能量传递途径,增强电子转移(Angew. Chem. Int. Ed. 2021, 60, 19912)。第二,利用分子组装对分子间电子转移的促进作用,提高电子转移效率(Angew. Chem. Int. Ed. 2024, 63, e202318783; J. Am. Chem. Soc. 2023, 145, 4081; Nat. Commun. 2022, 13, 6179; Chem. Sci. 2022, 13, 595)。但是,引入电子供体在提升电子转移能力的同时,也降低了体系对生物分子的氧化能力,这一特性在一定程度上限制了电子转移路径在PDT中的应用。
与电子转移不同,氢原子转移(HAT)可以通过攫取氢原子直接氧化生物分子,不受氧化还原电位的限制,具有更高的反应活性和广泛的底物适应性。因此,HAT途径在高效I-型光敏剂的开发中具有巨大潜力。基于此,杨清正团队开发了一种基于氢原子转移(HAT)机制的I-型光敏剂,能够在光照下同时产生超氧阴离子自由基和碳自由基,从而增强光动力治疗效果。光敏剂由3,5-位芴基取代的BODIPY衍生物与苄基修饰的三苯胺(TPA)基团通过共价连接而成,光照条件下发生分子内单电子转移,产生BODIPY−•和TPA+•中间体,其中,BODIPY−•将电子转移给氧气生成O2−•,TPA+•通过脱质子生成碳自由基,进而攫取氢原子氧化生物底物,完成催化循环。
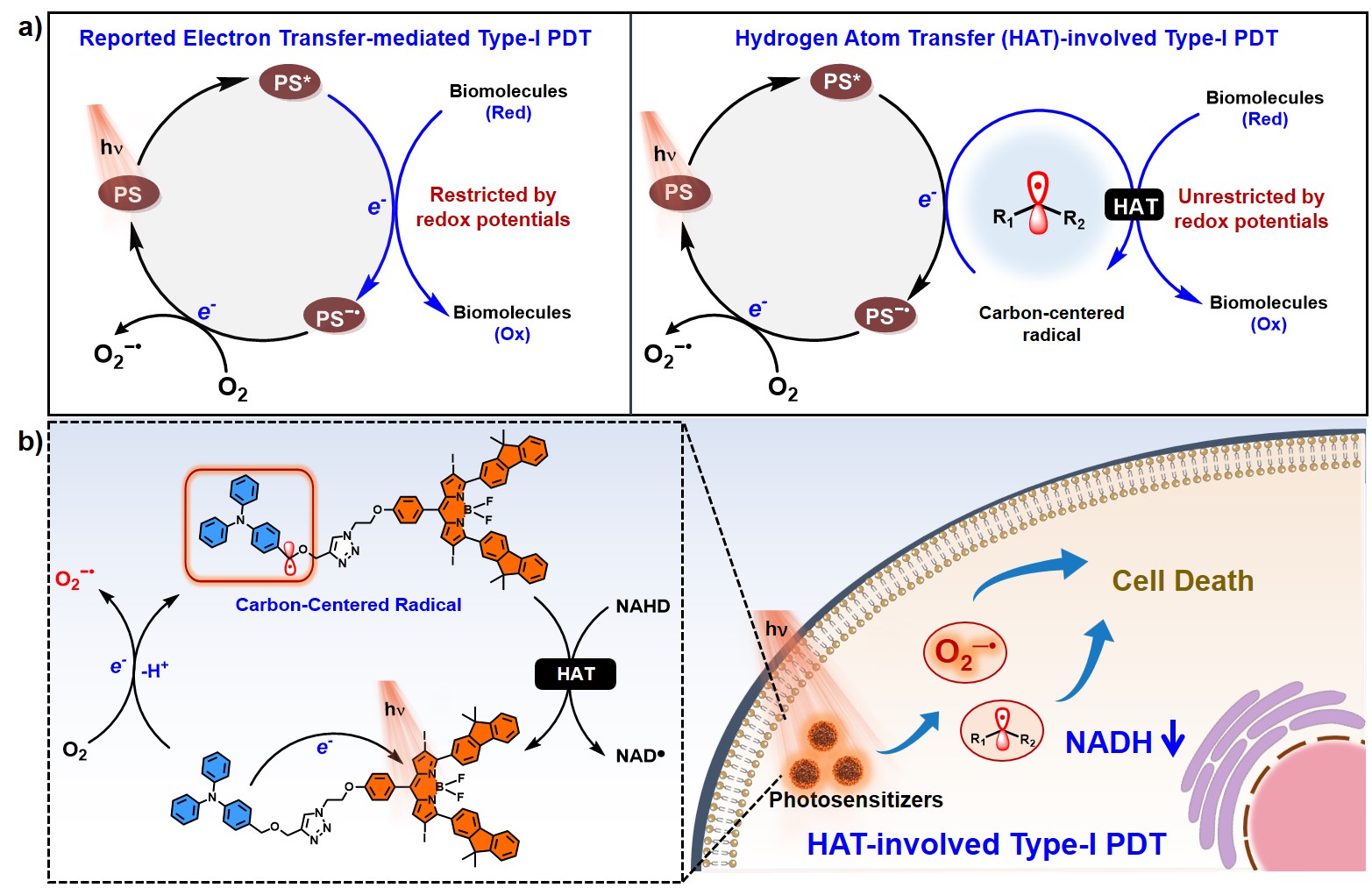
该工作系统研究了光敏剂的电子/氢原子转移机制、碳自由基的产生、活性氧生成能力以及对生物分子氧化性能等,并通过体内外实验验证了其PDT效果。研究结果表明,该光敏剂即使在乏氧条件下仍具有显著的光细胞毒性,并在小鼠肿瘤模型中表现出优异的抗肿瘤效果。氢原子转移机制的引入,为I-型光敏剂的设计提供了新的思路,为光动力治疗在复杂生物环境下的应用带来了新的可能和机遇。
这一成果近期发表在Angew. Chem. Int. Ed.上,文章的第一作者是北京师范大学硕士研究生范卓,通讯作者是滕坤旭博士和杨清正教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The Photodynamic Agent Designed by Involvement of Hydrogen Atom Transfer for Enhancing Photodynamic Therapy
Zhuo Fan, Kun-Xu Teng*, Yuan-Yuan Xu, Li-Ya Niu and Qing-Zheng Yang*
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202413595
导师介绍
杨清正
https://www.x-mol.com/groups/qingzheng_yang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号