中南大学张斗&潘灏团队IM研究论文:基于BaTiO3铁电催化作用的新型鞋垫促进感染伤口愈合:抗菌效应和血管生成分析
本文来源于Interdisciplinary Materials, 欢迎浏览!
论文信息
Q. Liu, X. Liu, L. Fan, X. Bai, H. Pan, H. Luo, D. Zhang, H. Huang, C. Bowen. Ferroelectric catalytic BaTiO3-based composite insoles to promote healing of infected wounds: Analysis of antibacterial efficacy and angiogenesis. Interdiscip. Mater. 2024; 3(5). doi: 10.1002/idm2.12194
摘要
为了预防可能导致严重感染的足部问题,迫切需要开发新的足部抗菌方法。然而,目前大多数商业化解决方案使用化学消毒剂,这与长期保持足部微生态平衡相冲突,可能对皮肤健康造成负面影响,包括频繁使用化学消毒剂和可能导致的皮肤干燥及过敏。因此,用于足底的新型抗菌技术的开发显得尤为迫切,不仅需要长期的足部抑菌,还需关注到如何解决特殊情况下的伤口感染问题。面对传统治疗方案在抗菌效率和促进伤口愈合方面的限制,中南大学粉末冶金研究院张斗教授团队与中南大学湘雅口腔医学院潘灏副主任医师团队合作,将BaTiO3(BT)铁电材料嵌入PDMS弹性材料中,利用压电催化效应促进抗菌和愈合,设计出一种易于构型、结构稳定且生物相容性良好的铁电复合材料。通过研究发现,PDMS-BT产生的活性氧(ROS)能够增加细菌的氧化应激,从而降低其活性和生物膜形成速率。此外,PDMS-BT产生的电场能够影响伤口内源性电场,进而增强TGF-β和CD31的表达和分泌,促进成纤维细胞的迁移和血管生成。该复合材料具有成本低、常温工作性能好,还具有优异的柔韧性和轻量化优势,有助于扩展压电材料在抗菌及医学特色化等领域的应用范围。中南大学粉末冶金研究院博士研究生刘琼和中南大学湘雅口腔医学院硕士研究生刘旭丹为本文共同第一作者。
主要内容
细菌是地球上最古老的生命形式之一,分布广泛,对人类健康具有重要的双重影响。有益细菌对人体生态平衡至关重要,而致病菌则可能引起严重健康问题,特别是在足部健康方面。根据世界卫生组织的报告,细菌感染是全球面临的重大健康挑战之一,其给公共卫生带来的负担不容忽视。有效地清除细菌生物膜、抑制细菌生长对于抗感染治疗至关重要。然而,传统治疗方法,包括外科手术清创和抗生素治疗,由于可能导致组织损伤、细菌耐药性增加等问题,其应用受到了限制。随着对这些局限性的日益认识,科研人员和医疗卫生专家正寻找更为有效且低风险的替代治疗策略。最近,压电材料的特殊属性引起了研究者的关注,其中包括其在受到机械压力时产生的电场及感应电荷。这些特性为医学领域提供了新的研究方向和治疗可能性。具体来说,压电材料在无需外加药物的情况下,在力的作用下通过产生的电场和感应电荷与外界环境反应生成自由基,抑制细菌生长和生物膜的形成,同时促进受损软组织的修复与再生。这种新型治疗方式展示了无药物、高生物相容性以及自驱动的特点,预示着抗菌和再生医学应用的改革创新。
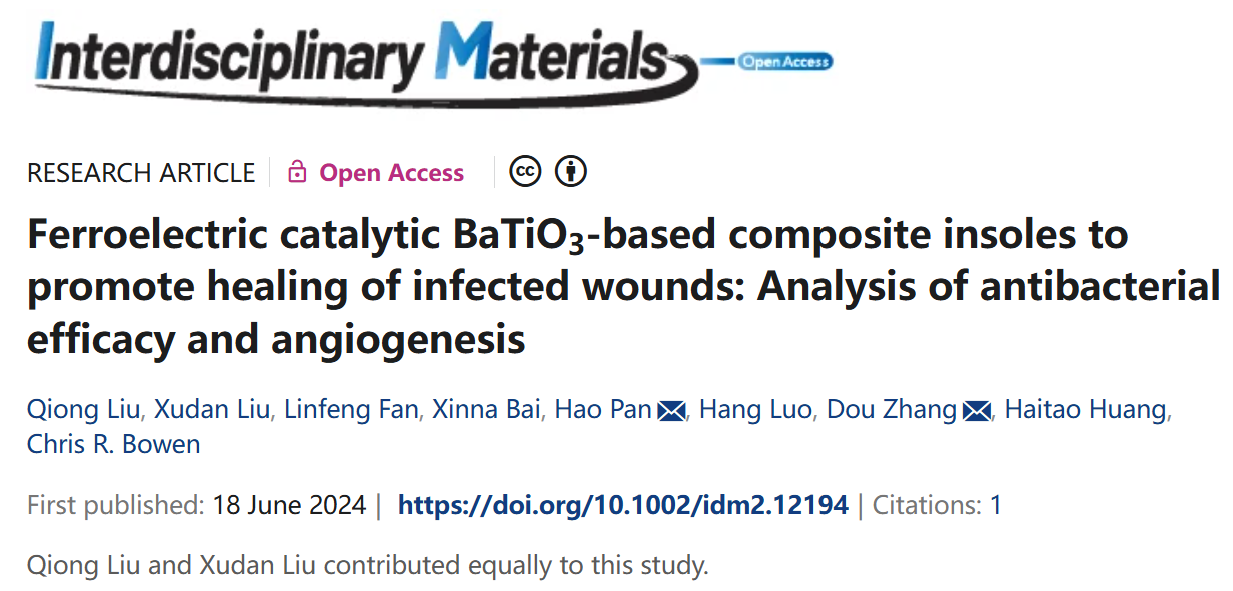
扫描电子显微镜(SEM)显示了制备的PDMS鞋垫的微观结构,表面呈粗糙并具有脊状结构。PDMS基质中包裹的BT纳米颗粒主要为不规则球形,平均粒径为0.6-1.0微米,如图1B所示。X射线衍射数据(图1C)表明,PDMS和PDMS-BT复合材料显示出钛酸钡为四方结构(PDF#81-2203)。PDMS-BT的高分辨X射线光电子能谱(XPS)数据(图1D)显示了PDMS材料的碳和氧成分,以及Si 2p峰的四个组分,分别对应于Si-O、Si-N和SiOx键。FTIR光谱(图1E)确认了PDMS-BT复合材料的结构。
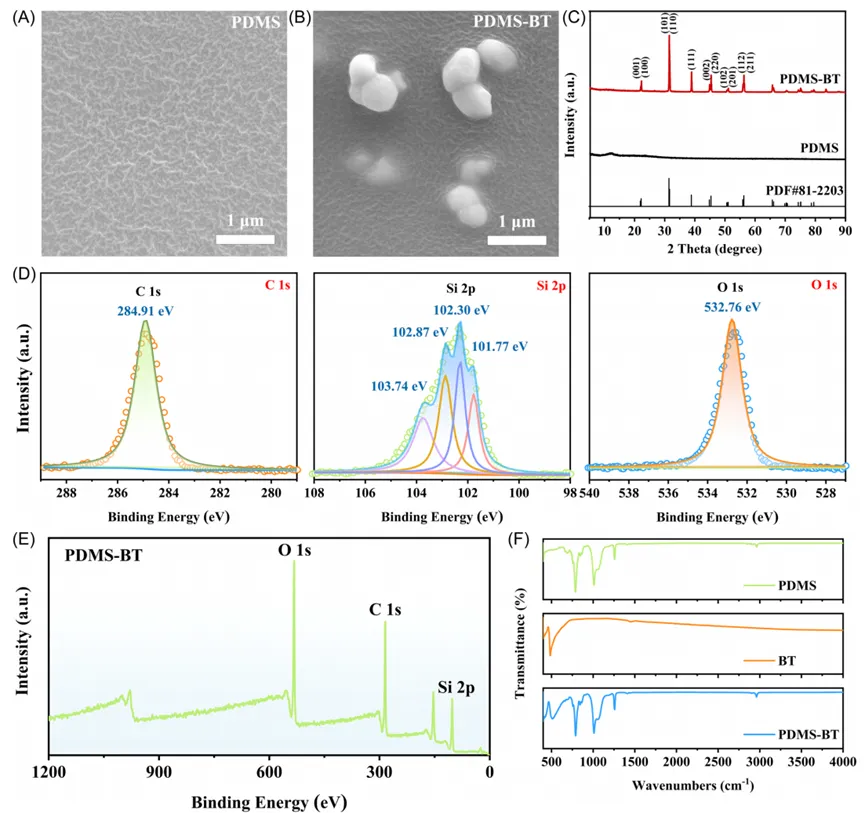
图1 (A) 聚二甲基硅烷(PDMS)和(B) PDMS-BT的扫描电子显微镜(SEM)图像。(C) PDMS和PDMS-BT的X射线衍射图。(D) C 1S、Si 2P、O 1S的高分辨X射线光电子能谱和(E) PDMS-BT的全谱。(F) PDMS、BT和PDMS-BT的傅里叶变换红外光谱(FTIR)。
在评估PDMS-BT的细胞毒性时,我们选择了HaCat细胞和L929细胞,用活/死染色方法评价了其毒性。48h后,所有组的细胞均呈健康形态,活细胞数保持在95%以上。CCK-8实验显示,PDMS-BT组的细胞存活率在培养1、3、5天后与对照组无显著差异,均在80%以上。PDMS-BT材料具有低细胞毒性,归因于其良好的生物相容性。皮肤刺激性实验结果显示,PDMS-BT对皮肤接触无红斑或浮肿的迹象,未显示炎性病变或组织病理学异常。
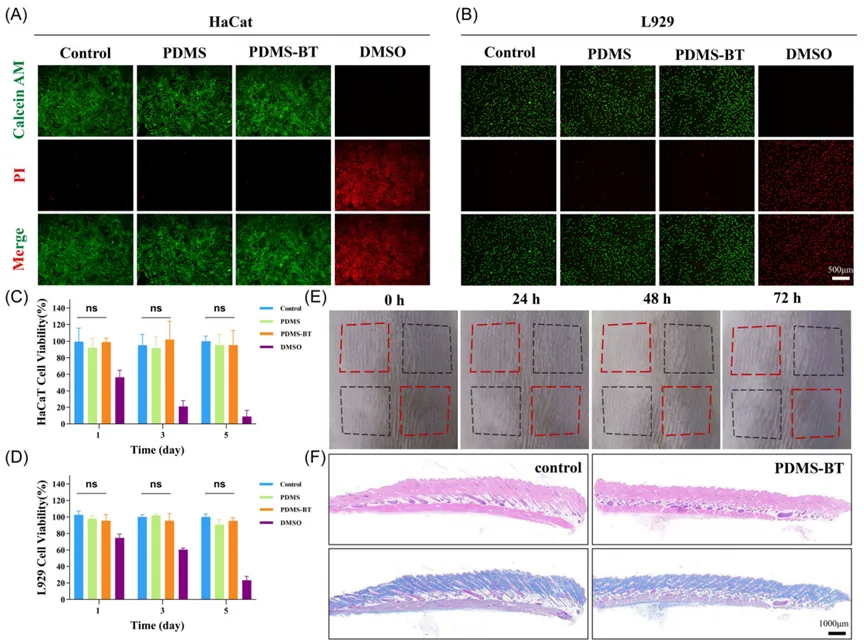
图2 细胞毒性和皮肤刺激性。(A) HaCat细胞和(B) L929细胞经不同处理后的活/死染色。CCK-8法检测(C) HaCat细胞和(D) L929细胞的存活率。将PDMS-BT膜涂于大鼠无毛皮肤表面,超声刺激后,(E) 获得具有代表性的皮肤图像,(F) 72小时后进行病理学评估。
为了研究不同样本对L929细胞迁移能力的影响,采用了划痕试验(图3A)。共孵育24小时后,对照组、PDMS组和PDMS-BT组的细胞愈合率分别为69.40±4.32%、72.07±6.70%和89.72±2.26%,如图3B所示。使用小管形成实验评估了不同样本对HUVECs血管生成潜能的影响(图3C),通过计算管数和连接数来量化管网形成(图3D)。PDMS-BT孵育的HUVECs显示出显著增强的血管生成能力,相比对照组和PDMS组增加了20%以上。这表明,PDMS-BT在超声刺激下不仅对细胞活力具有高生物相容性,还在体外促进了L929细胞的迁移和HUVECs的血管生成活性。PDMS-BT复合材料在动态外力作用下产生的小电场能够调节细胞的活性、极性和迁移,进而影响细胞的迁移和血管生成能力。
图3 体外迁移和血管生成。(A) 不同时间L929伤口划痕愈合试验的代表性图像。(B) L929细胞迁移量的测定。(C) 不同浓度的HUVECs与Matrigel孵育4h后,在Matrigel上形成管状细胞。(D) 随机选择的区域中的小管数量和连接数量。
为了评估PDMS-BT材料的抗菌性能,选择了大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)作为模型菌株。采用琼脂平板计数法测定菌落数量,并发现超声处理PDMS-BT组20分钟后,大肠杆菌和金黄色葡萄球菌的存活率分别为44.7%和24.0%,显著低于对照组和PDMS组。机械冲击1小时后,金黄色葡萄球菌的生存率仅为28.2%,冲击2小时后降至11.1%,大肠杆菌也显示类似趋势。长时间机械应力后的抗菌测试结果表明,PDMS-BT保持了对生物膜的破坏能力,减少了细菌活性约75%。这些发现表明,PDMS-BT材料在超声刺激和机械冲击下表现出优异的抗菌性能,其电荷分离和电势分布可能影响了细菌表面电荷平衡,从而减少了生物膜的形成和细菌的存活。
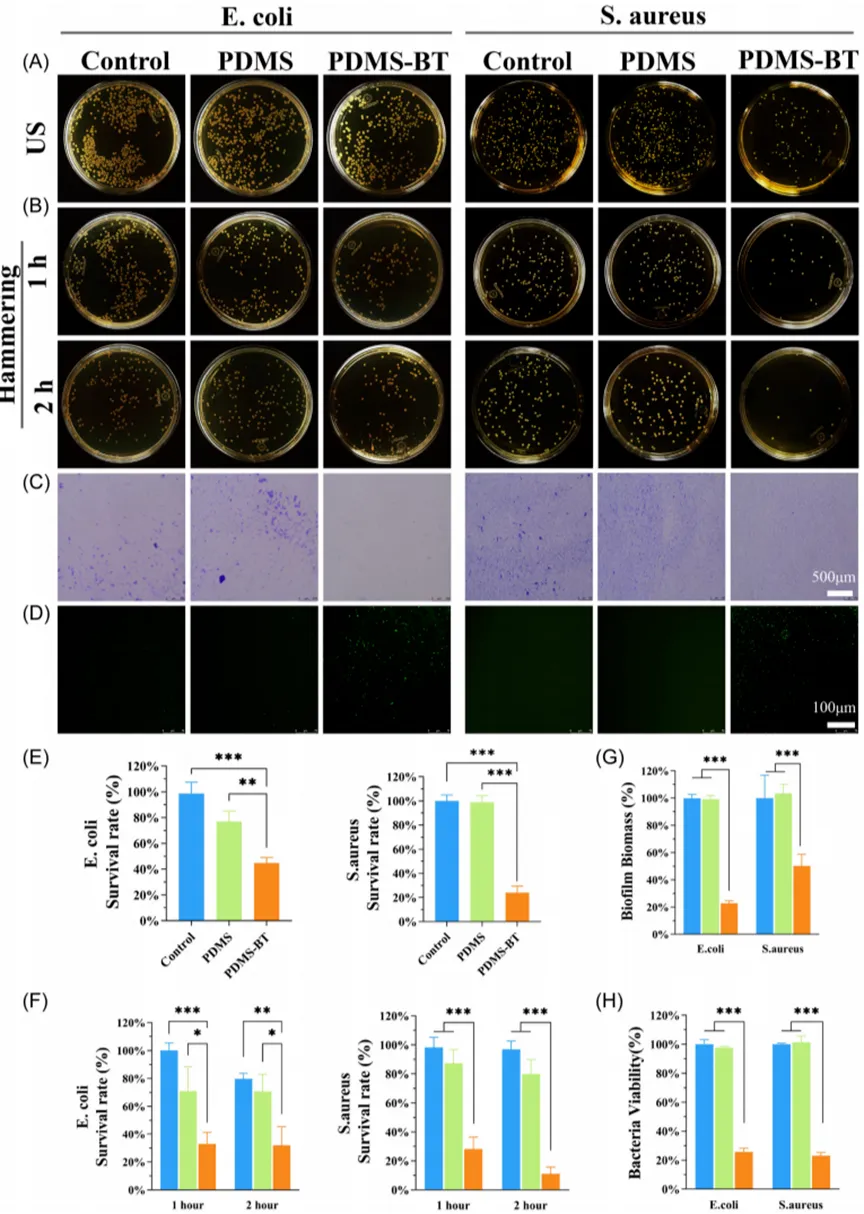
图4 PDMS - BT的体外抗菌活性。(A) 不同超声(US)处理的大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)菌落的代表性图像。(B) 不同样品经往复机械冲击1 h/2 h后大肠杆菌和金黄色葡萄球菌菌落的代表性图像。(C) 结晶紫染色生物膜的代表性图像和(G)大肠杆菌和金黄色葡萄球菌的生物膜生物量。(D) 细菌生物膜中活性氧的荧光检测。(E) (A)细菌存活率的定量分析。(F) (B)细菌存活率的定量分析。(H) 金黄色葡萄球菌和大肠杆菌在表面的活性。
为评估PDMS-BT材料的抗菌性能,设计了大鼠背部创面愈合模型,模拟人体创面感染情况。PDMS-BT组在体内显示出显著的抗感染能力,有效减轻了创面感染,经标准拭子培养和琼脂平板计数验证。PDMS-BT组在创面修复过程中表现出更快的皮肤再生速度和更小的伤口面积,第9天的创面面积仅为6.0±2.5%,显著低于对照组和PDMS组的18.9±2.6%和20.3±3.6%。这表明PDMS-BT材料在体内具有优异的抗菌和促进愈合效果,适用于模拟创面感染的临床应用。
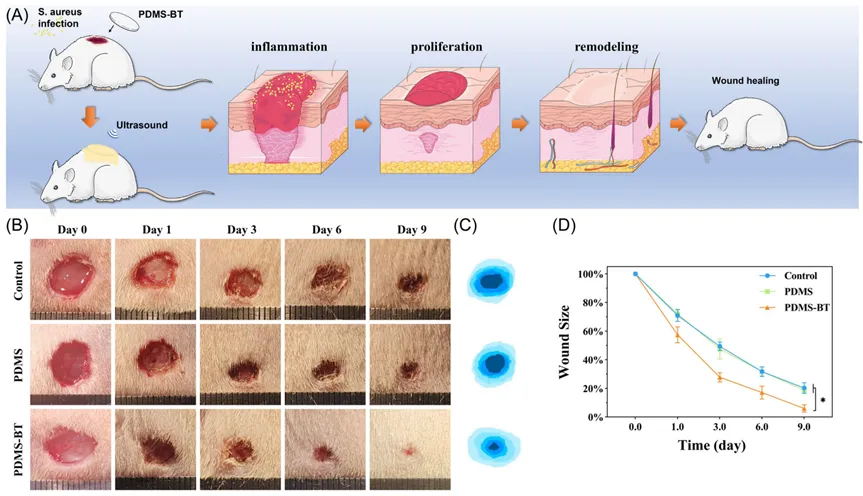
图5 (A) PDMS - BT治疗大鼠感染性伤口示意图。(B) 治疗过程中不同时间感染伤口的代表性照片。(C) 9天内伤口愈合轨迹示意图。(D) 不同时间点相对创面面积定量数据。
为了进一步分析表皮再生和创面修复过程,我们对创面部位新形成的组织进行了H&E染色(图6A)。PDMS-BT组显示出皮肤下组织中丰富的毛囊形成,第9天时表皮厚度显著增加,新形成的毛囊数量明显较多(图6C)。Masson染色显示,PDMS-BT组肉芽组织宽度显著小于对照组和PDMS组(图6B)。此外,PDMS-BT组表现出更高的胶原沉积率(44.3±8.0%),胶原沉积更有组织性(图6E)。创面感染会抑制成纤维细胞的增殖和迁移,延缓愈合速度,并阻碍新血管形成,影响血液供应和氧气输送。PDMS-BT可能通过增加TGF-β的表达和调节血管内皮细胞(CD31阳性)来促进成纤维细胞活化、胶原合成以及血管生成。这些结果表明PDMS-BT在促进创面修复过程中的生物学机制及其在临床应用中的潜力。
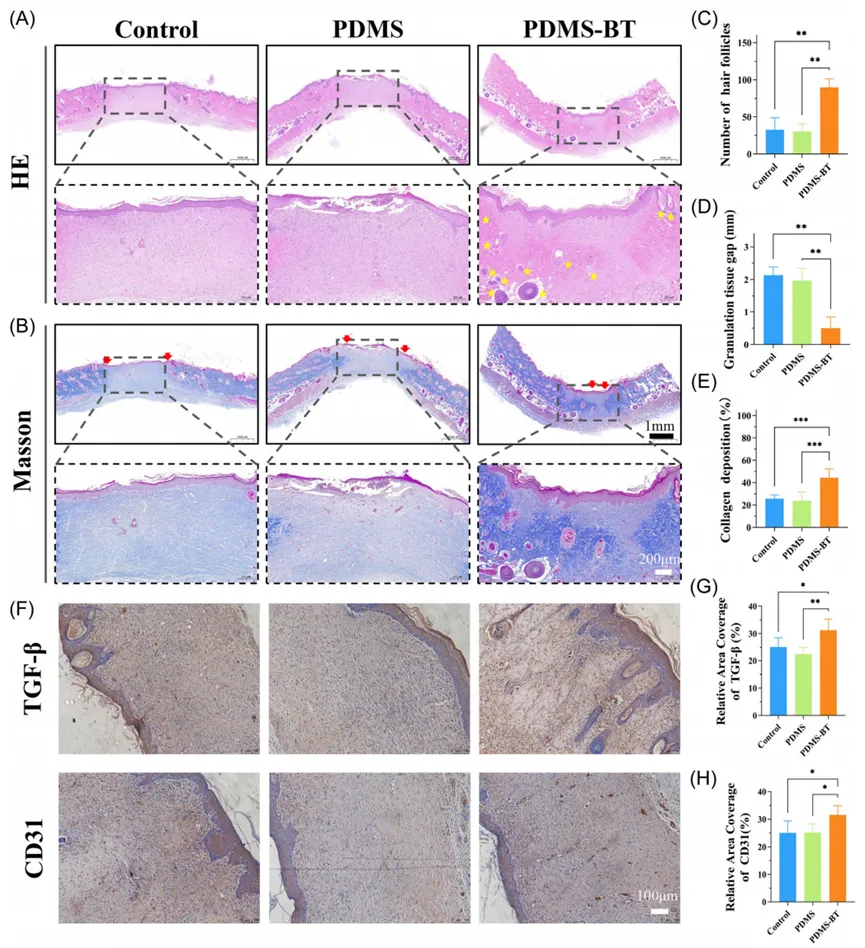
图6 PDMS - BT对胶原沉积和血管生成影响的体内研究。(A) 苏木精和伊红染色的不同组伤口组织切片的代表性图像。(B) Masson染色不同组创面组织切片的代表性图像。毛囊用黄色星形标记,两个红色箭头代表肉芽组织间隙。定量(C) 毛囊计数,(D) 肉芽组织间隙,(E) 胶原沉积。(F) TGF‐β和CD31的代表性免疫组化图像。(G) TGF - β和(H) CD31相对覆盖面积的定量数据。
采用有限元模型(FEM)预测了PDMS-BT鞋垫在行走条件下的铁电势生成情况。内底表面均匀受力时,PDMS-BT鞋垫中BT纳米颗粒在边缘附近由于受到固定鞋底的影响而表现出较小的表面应力。铁电电压有限元结果显示,在完全底面接触的情况下,PDMS-BT鞋垫产生约14.4 V的铁电电压。通过原子力显微镜(AFM)和压电响应力显微镜(PFM)验证了BT纳米颗粒的铁电特性、表面电势。
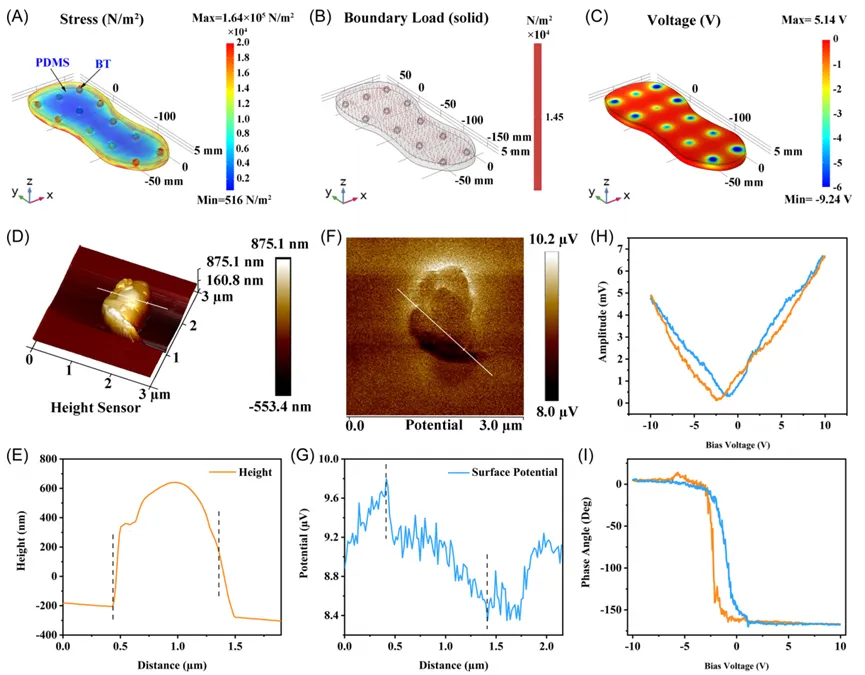
图7 (A) PDMS - BT在z方向受力下的有限元模型仿真结果。(B) 相应的边界载荷谱和(C) 衬底处形成的压电电压。钛酸钡(BT)的压电和铁电表征:(D) 原子力显微镜的三维拓扑图像和(E) 相应的高度曲线,(F) 开尔文探针力显微镜相图和(G) 相应的表面电位分布,(H) 压电响应力显微镜(PFM)振幅蝴蝶环和(I) PFM相滞后环。
综上所述,我们开发了一种利用铁电催化作用促进感染伤口愈合的抗菌鞋垫。PDMS-BT铁电复合材料受到机械压力时产生电场及感应电荷,即通过铁电催化作用产生ROS,显著降低细菌活性和生物膜形成。此外,PDMS-BT的铁电场增强了创面内的TGF-β和CD31表达,加速了成纤维细胞迁移和血管生成,导致创面愈合速度显著提高。这种铁电抗菌鞋垫能够在行走过程中响应足部压力,是一种具有稳定性、生物相容性和成本效益的新型生物材料。
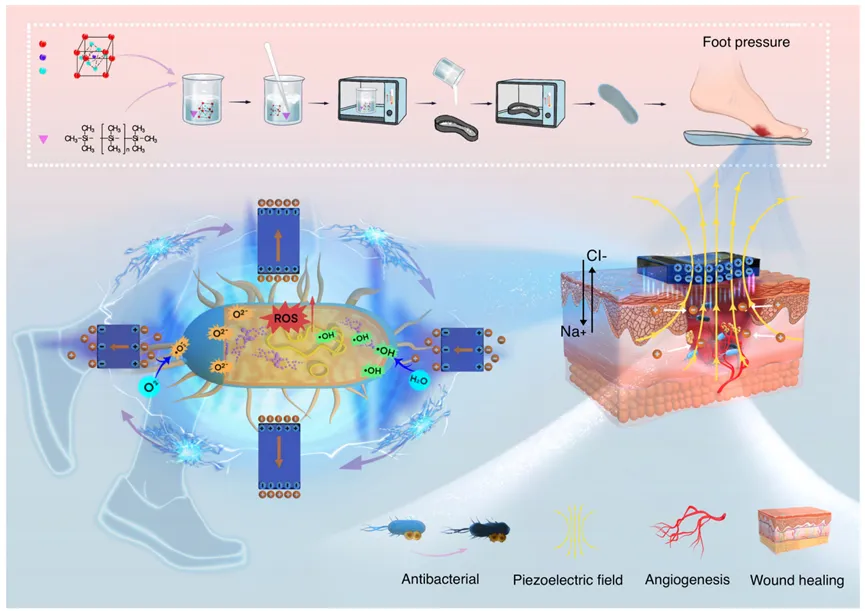
图8 用于伤口愈合的铁电催化抗菌鞋垫的设计与制备示意图。
期刊简介

Interdisciplinary Materials(交叉学科材料)是由Wiley出版集团与武汉理工大学联合创办的开放获取式高水平学术期刊。主编为张清杰院士和傅正义院士。30位国际杰出学者和45位两院院士作为期刊的编辑委员会委员。Interdisciplinary Materials 是国际上聚焦材料与其它学科交叉前沿发起出版的首本“交叉学科材料”领域高水平期刊,旨在发表材料学科与物理、化学、数学、力学、生物、能源、环境、信息等学科交叉研究的最新成果。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号