Science:十个C-H键官能团化反应,一个天然产物全合成
副标题:基于C-H键官能团化的(–)-cylindrocyclophane A全合成
C-H键在包括药物合成前体的各种有机分子中大量存在,它们通常比较惰性,相对不太容易活化。正因如此,C-H键活化被不少人称为有机化学中的“圣杯”,备受化学家的关注。在过去的几十年里,催化领域的快速发展使得C-H键的直接官能团化成为可能,尤其是过渡金属催化的C-H键官能团化方向取得了长足进步。C-H键官能团化策略也被广泛应用于天然产物的全合成和复杂结构的后期修饰,例如:雷晓光团队利用连续C-H键官能团化反应实现了(-)-incarviatone A的全合成(J. Am. Chem. Soc., 2015, 137, 11946-11949)。如图1A所示,(-)-Cylindrocyclophane A是一种22元、C2对称的[7.7]对环芳烷类天然产物,具有双间苯二酚官能团和六个立体中心。它独特的化学结构和特殊的生物活性引起了众多研究者的兴趣,此前的合成尝试大多使用传统的化学转化(如:烯烃复分解、Horner-Wadsworth-Emmons反应、Ramberg-Bäcklund环二聚化策略)来构建大环骨架,同时利用其它几种众所周知的转化来构建每个立体中心,总体上来看合成步骤比较繁琐、总产率低,难以令人满意。
近日,美国埃默里大学的Huw M. L. Davies教授(点击查看介绍)和加州理工学院的Brian M. Stoltz教授(点击查看介绍)等研究者从廉价易得的原料出发,通过10个C-H键官能团化反应构建了6个C-C键和4个C-O键,以高产率、高区域、高对映和高非对映选择性实现了(-)-cylindrocyclophane A的全合成(共17步/19步,图1B)。具体来说,手性四羧酸二铑催化剂能实现一级/二级C-H键官能团化,配合钯催化的C(sp2)-C(sp2)键交叉偶联可以快速构建大环核心和所有手性中心,而钯催化的四重C(sp2)-H键乙酰氧基化反应则安装了双间苯二酚部分。相关成果发表在Science 上。
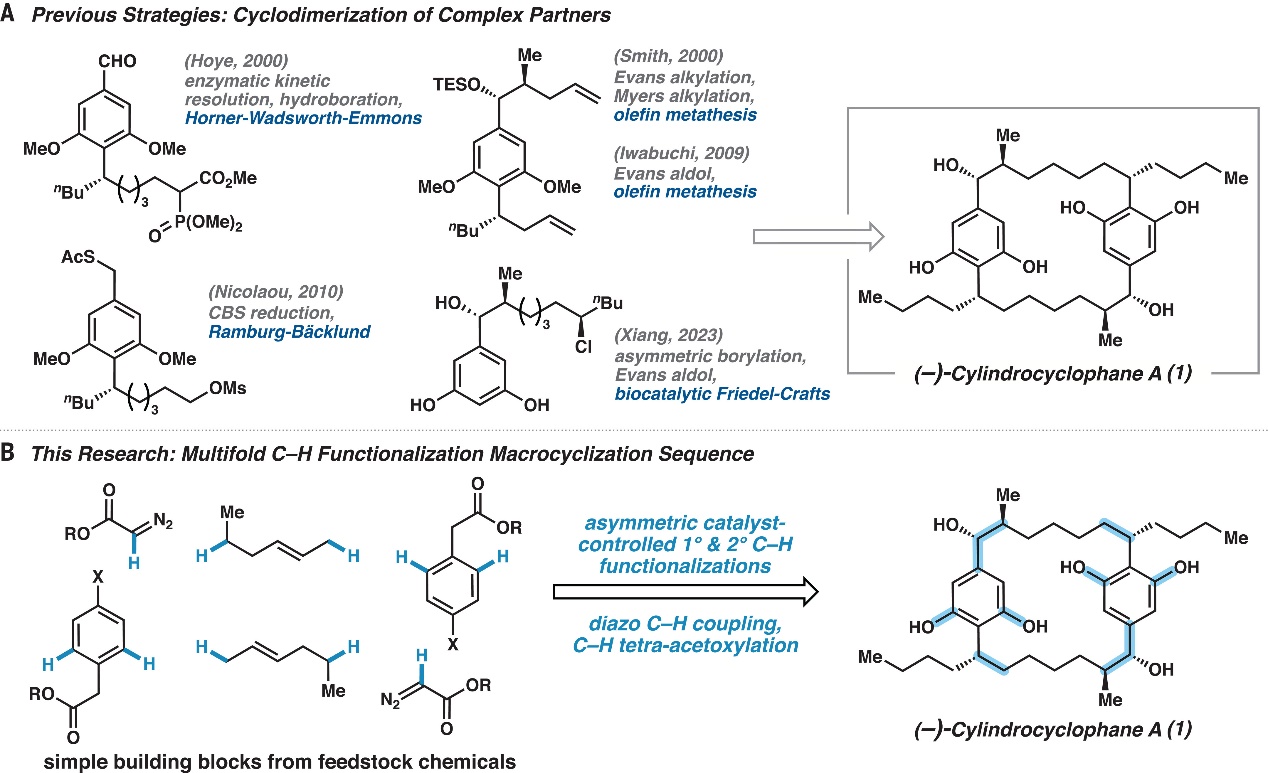
图1. (–)-cylindrocyclophane A的合成策略。图片来源:Science
如图2所示,作者对(-)-cylindrocyclophane A(1)进行了逆合成分析:即1可以通过双酰胺2与合适亲核试剂的加成得到,而2则是通过对环芳烷3的四重Weinreb酰胺导向的C-H键乙酰氧基化引入2,6-间苯二酚官能团,这样能降低复杂性并调节芳基的反应性。随后,大环3 C1处乙酸酯和C7处苄酰胺可以经由正交保护的大环四酯4制备而成,4能通过铑催化重氮酯5的二级C(sp3)-H键官能团化得到,5则是通过钯催化芳基卤化物6与重氮醋酸酯的C-H键官能团化制备而成。最后,芳基卤化物6可能是由铑(II)催化芳基重氮乙酸酯和己烯的一级C-H键官能团化生成。
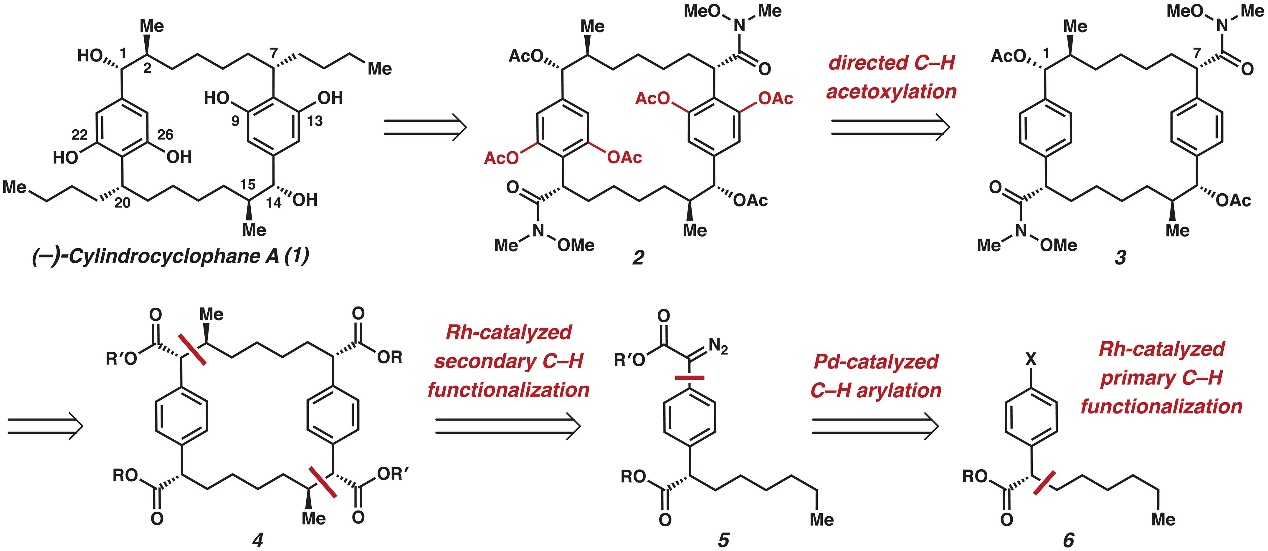
图2. (–)-cylindrocyclophane A的逆合成分析。图片来源:Science
接下来,作者从芳基重氮乙酸酯7和trans-2-己烯8出发(图3A),经大位阻Rh2(R-p-PhTPCP)4催化的区域和对映选择性一级C-H键官能团化,以73%的产率和96% ee值得到trans-烯烃9,9在Crabtree催化剂的作用下进行氢化反应以定量产率得到碘化物10,其与重氮酯11进行钯催化的C(sp2)-C(sp2)键交叉偶联反应并得到芳基重氮乙酸酯12。随后,作者研究了芳基重氮乙酸酯12的环二聚化,发现Rh2(R-2-Cl-5-BrTPCP)4能以中等产率(19%)和非对映选择性(6:1 dr)获得大环四酯15(图3B),X-射线衍射分析证实了其绝对和相对构型。尽管这种一锅法反应能够一步构建天然产物的[7,7]对环芳烷核心以及四个新的立体中心,但是该过程产率较低并需要高效液相色谱纯化。为此,作者发展了逐步策略来组装大环15,具体而言:12在Rh2(R-2-Cl-5-BrTPCP)4的作用下与3 equiv碘化物10进行反应,以68%的产率、>20:1 rr、19:1 dr获得芳基碘化物13,13与重氮酯11进行钯催化的交叉偶联反应并得到大环前体14(产率:77%),其在Rh2(R-2-Cl-5-BrTPCP)4的作用下进行关环反应便可以70%的产率、8:1 dr生成大环15,特别是该过程能以>1.2 mmol规模进行制备且能从粗反应混合物中重结晶分离出单一的非对映异构体15。与芳基碘化物13的形成相比,大环化的整体非对映选择性较低是由于Horeau效应所致,其中不完美的不对称诱导会产生非对映异构体而非对映异构体混合物。综上,从芳基重氮乙酸酯7出发,经过直接环二聚化(四步总产率12%)或逐步大环化(六步总产率23%)过程合成了大环15,从而有效构建了大环核心和六个立体中心。
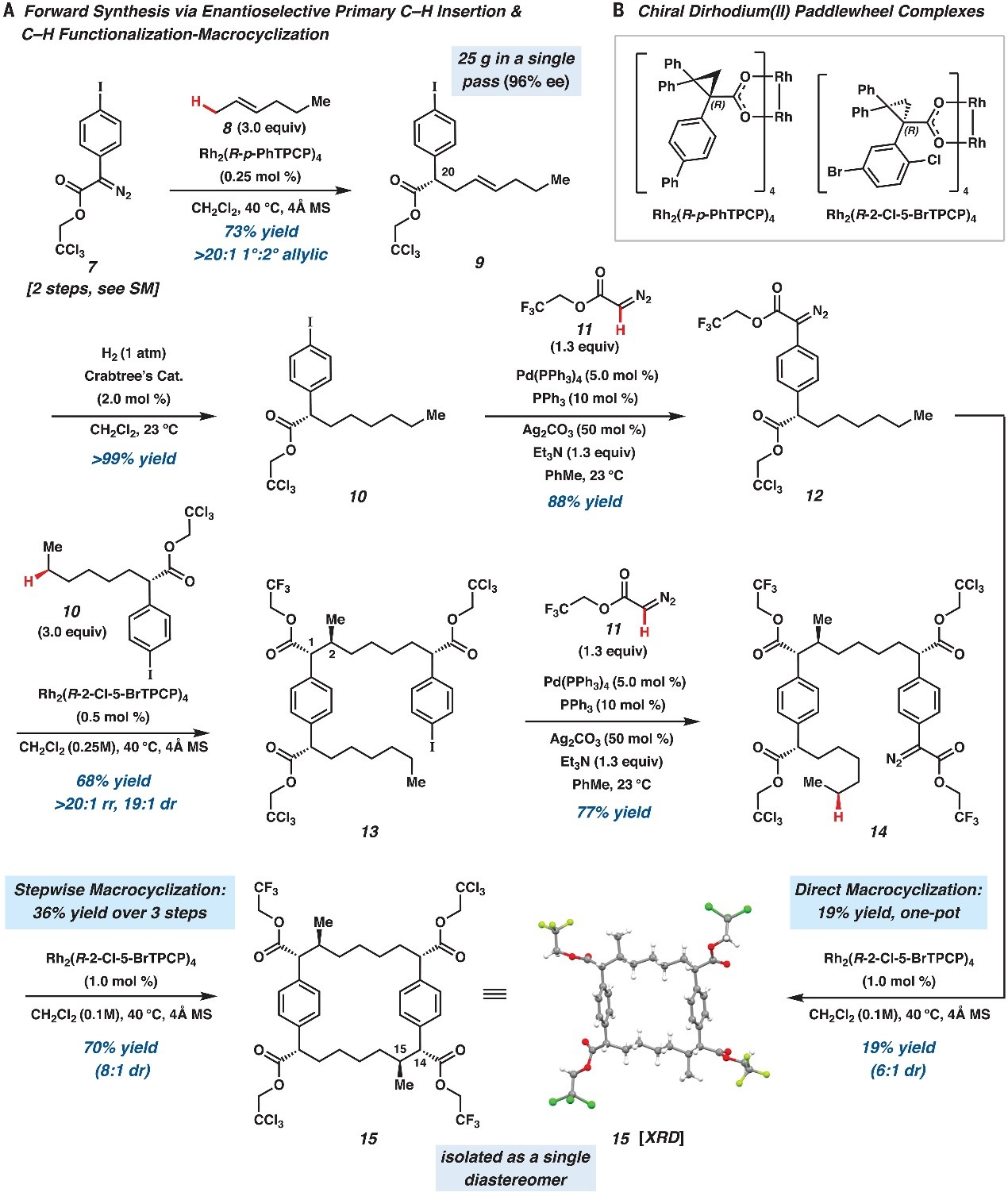
图3. 中间体15的合成。图片来源:Science
接下来,大环15经两步转化以85%的产率将三氯乙酯化学选择性地转化为双Weinreb酰胺16(图4),16在LiOH•H2O的作用下水解三氟乙酯并得到双羧酸17,其通过光催化脱羧乙酰氧基化反应转化为双苄基乙酸酯3。随后,作者利用余金权教授课题组开发的条件(Pd(OAc)2/5-(三氟甲基)吡啶-3-磺酸配体)实现了酰胺导向的四重C(sp2)-H键乙酰氧基化反应并以60%的产率得到大环化合物2。最后,作者尝试用过量丙基格氏试剂处理双Weinreb酰胺2以安装两个丙基侧链,但是该过程会影响亲核加成和后续的脱酰化;而用过量二异丁基氢化铝处理2时得到的产物混合物无法转化为最终的天然产物1,作者推测这可能是由于原位生成了酚氧化物环化到Weinreb酰胺上。为此,作者将酚乙酸酯进行化学选择性脱酰、甲基化反应,以两步、64%的产率得到四甲基醚18,18经DIBAL-H还原、Wittig烯化反应转化为单一的异构体——双烯烃19,其经氢化还原、Hoye发展的脱甲基化反应便可实现(-)-cylindrocyclophane A(1)的全合成,总共17步/19步。
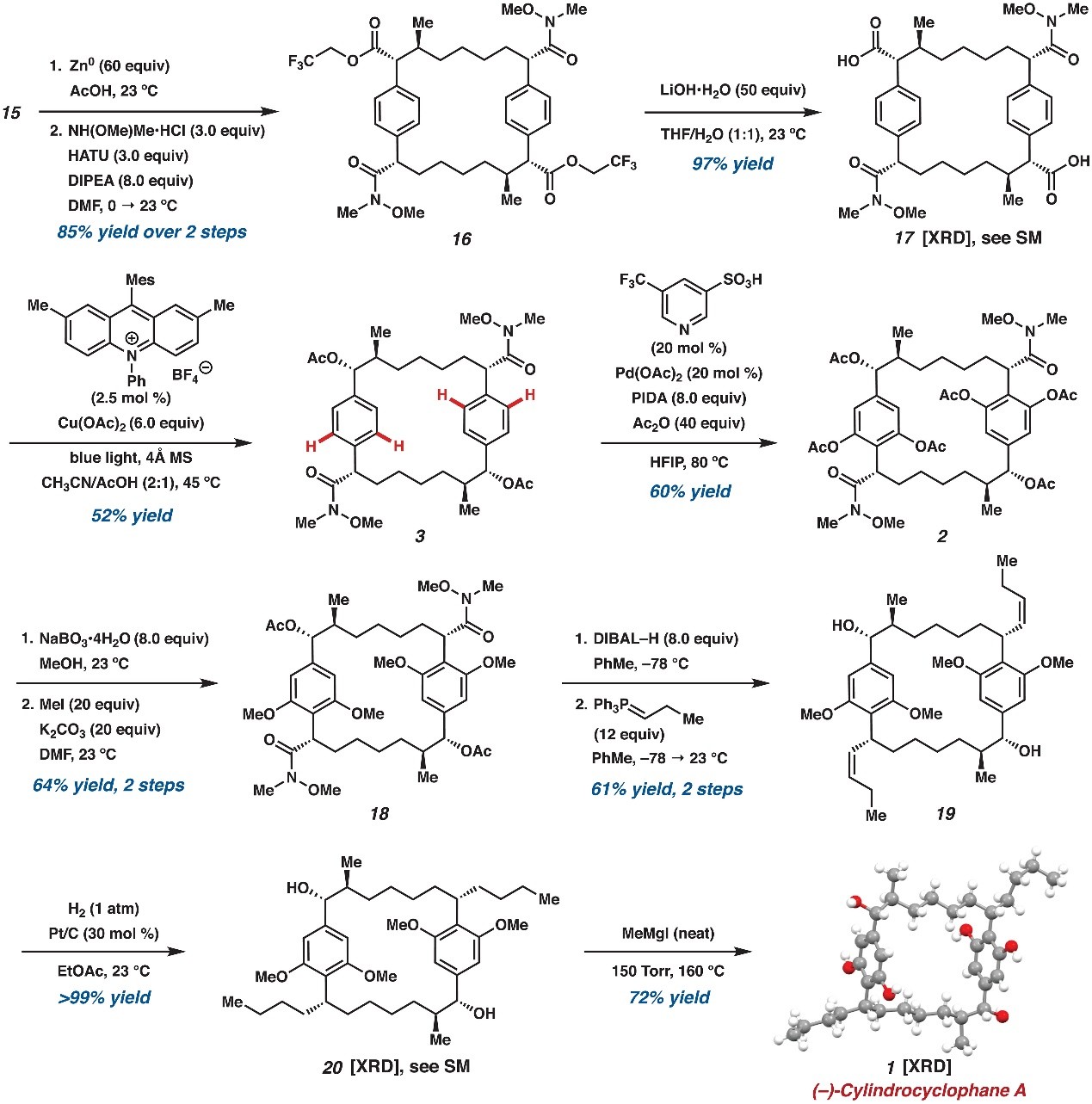
图4. (–)-cylindrocyclophane A的全合成。图片来源:Science
总结
Huw Davies教授和Brian Stoltz教授带领的研究团队从廉价易得的原料出发,通过10个C-H键官能团化反应构建了6个C-C键和4个C-O键,以高产率、高区域、高对映和高非对映选择性实现了(-)-cylindrocyclophane A的全合成(共17步/19步)。具体来说,手性四羧酸二铑催化剂能实现一级/二级C-H键官能团化,配合钯催化的C(sp2)-C(sp2)键交叉偶联可以快速构建大环核心和所有手性中心,而钯催化的四重C(sp2)-H键乙酰氧基化则安装了双间苯二酚部分。此项研究证明了C-H键官能团化可作为一种重要技术,有选择地将低成本材料转化为高度官能团化和具有复杂立体化学的构建模块。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of (−)-cylindrocyclophane A facilitated by C−H functionalization
Aaron T. Bosse, Liam R. Hunt, Camila A. Suarez, Tyler D. Casselman,Elizabeth L. Goldstein, Austin C. Wright, Hojoon Park, Scott C. Virgil, Jin-Quan Yu, Brian M. Stoltz, Huw M. L. Davies
Science, 2024, 386, 641-646. DOI: 10.1126/science.adp2425
导师介绍
Huw M. L. Davies
https://www.x-mol.com/university/faculty/2693
Brian M. Stoltz
https://www.x-mol.com/university/faculty/471
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号