靶向RNA去甲基酶FTO的PROTAC降解剂
RNA表观遗传展示了基因表达调控的新维度,可作为抗肿瘤原创药物发现研究的新赛道。中国科学院上海药物研究所、国科大杭州高等研究院药学院杨财广(点击查看介绍)实验室长期致力于RNA甲基化修饰的化学干预研究,报导了一系列m6A去甲基化酶FTO的抑制剂(图1)。这些抑制剂作用于FTO蛋白质的N-端结构域,对于C-端200多个氨基酸组成的结构域,其生物学功能研究报道很少。
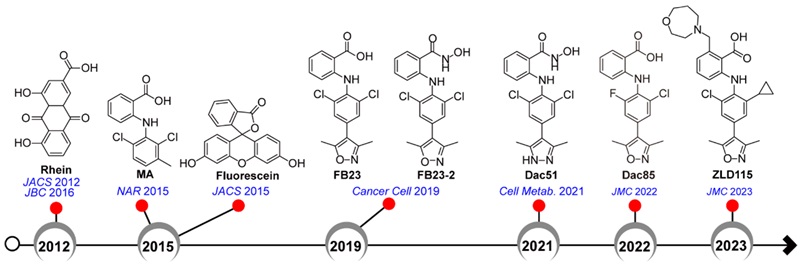
图1. FTO抑制剂
近期,杨财广团队在Acta Pharm. Sin. B 杂志上发表研究论文,报道了FTO降解剂QP73,概念验证了PROTAC靶向FTO抗急性髓细胞白血病(AML)的可行性,拓展了化学干预FTO生物学功能的工具箱,为靶向FTO抗肿瘤研究提供了新思路。
该课题以前期报道的2-芳氨基苯甲酸FTO抑制剂FB23作为弹头分子,结合FB23/FTO的复合物晶体和FB23的单晶结构,通过化学合成和初步降解活性评价,发现了靶向FTO的PROTAC降解剂QP73。进一步研究发现,QP73降解NB4细胞中的FTO,具有时间、浓度和蛋白酶体-泛素化系统的依赖性(图2)。
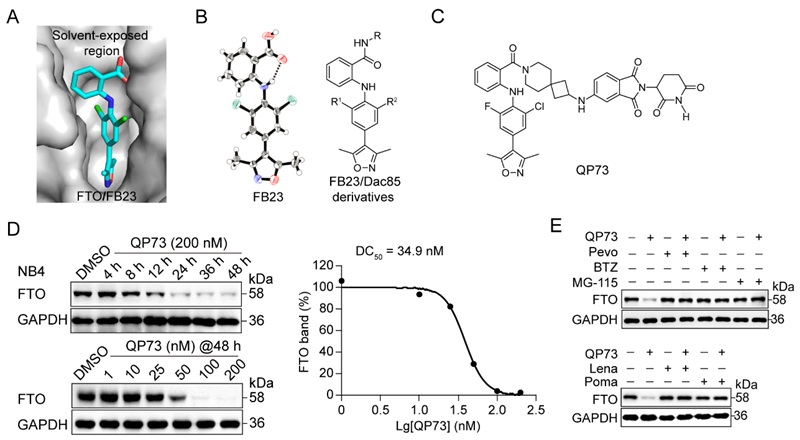
图2. 靶向FTO的PROTAC降解剂QP73的发现
细胞实验表明QP73在不同基因背景的AML细胞系中均表现出抗细胞增殖活性,并且这种抗增殖活性远远强于Dac85。并且在NB4细胞系上,降解剂QP73以更低的浓度依赖抑制细胞的集落形成、增加胞内m6A中mRNA的丰度、引起下游的信号通路调控。这些结果说明了FTO降解剂在调节FTO信号通路抗肿瘤方面比FTO抑制剂更有效(图3)。
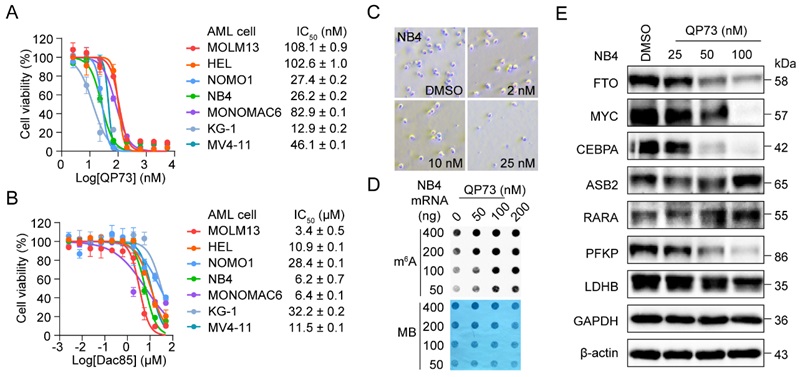
图3. QP73表现对AML细胞的增殖抑制活性
蛋白质组学表明QP73处理36小时后,FTO蛋白被全部降解。GSEA通路富集分析表明QP73处理的NB4细胞主要富集在FTO调控的下游通路,如MYC和G2M检查点(图4)。
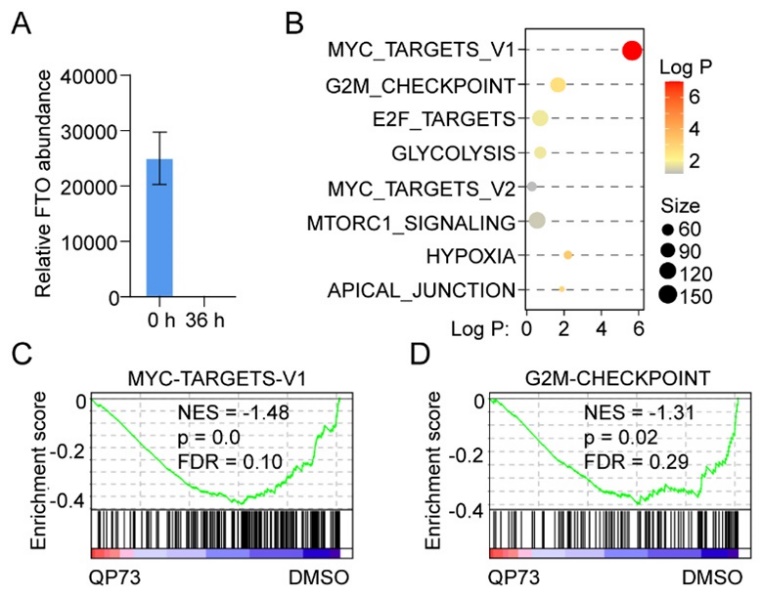
图4. QP73降解AML细胞FTO的信号通路研究
最后,QP73对NB4异种移植皮下瘤模型的体内疗效模型中展示了一定的肿瘤抑制效果。腹腔(i.p.)给药QP73后,给药组的肿瘤体积和肿瘤重量均低于对照组,QP73在治疗过程中并没有导致小鼠体重减轻。进一步研究发现QP73可以降低肿瘤中FTO蛋白水平,提高肿瘤中m6A的水平。这些结果表明QP73在体内可以有效地抑制动物模型中AML细胞来源的异种移植瘤的生长(图5)。
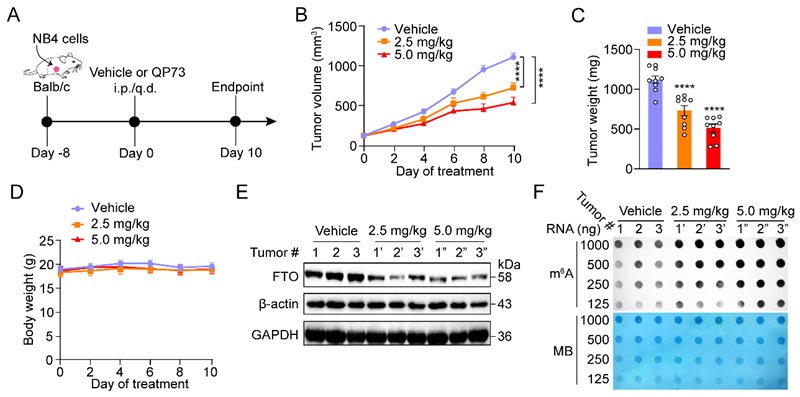
图5. QP73在动物水平上有抗肿瘤药效
总之,该研究基于RNA去甲基化酶FTO抑制剂,合理设计合成了靶向FTO的PROTAC降解剂,概念验证了PROTAC靶向FTO抗急性髓细胞白血病的可行性,拓展了调控FTO化学生物学功能的工具箱。
本研究工作的第一作者是国科大杭州高等研究院的博士后刘璐、国科大杭州高等研究院的硕士研究生邱元来和上海药物研究所的博士研究生索玉颖,通讯作者是上海药物研究所、国科大杭高院药学院首席教授的杨财广研究员,国科大杭研究院药学院董泽副研究员,上海药物研究所、国科大杭高院药学院双聘教授的周虎研究员。本研究的完成获得了国家自然科学基金、杭高院自主部署项目等基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of a potent PROTAC degrader for RNA demethylase FTO as antileukemic therapy
Lu Liu , Yuanlai Qiu , Yuying Suo , Siyao Tong , Yiqing Wang , Xi Zhang , Liang Chen , Yue Huang , Huchen Zhou , Hu Zhou , Ze Dong , Cai-Guang Yang
Acta Pharm. Sin. B, 2024, DOI: 10.1016/j.apsb.2024.07.016
导师介绍
杨财广
https://www.x-mol.com/university/faculty/22889
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号