JACS全合成 | 光反应赋能的去甲花群海葵碱简洁合成
海洋天然产物是海洋药物研发的宝库。迄今已有十余种基于海洋天然产物的药物上市,展现了海洋天然产物研究的重要价值。近日,复旦大学药学院孙域团队利用多种光化学反应,实现了去甲花群海葵碱的高效合成,为该类珍稀海洋生物碱的成药性研究奠定了基础。
花群海葵碱类海洋天然产物是一类具有独特七环缩酮骨架的海洋生物碱,其分离自花群海葵(图1)。该类天然产物具有抗骨质疏松、抗炎、抗转移、抗血小板聚集、损伤神经修复等多种生物活性,且安全性好,是富有潜力的药物候选物。然而,该类天然产物来源稀少,提取困难,其成药性研究难以开展,“药源不足”已成为其开发与应用的主要瓶颈。由于其显著的合成价值和艰巨的合成挑战,该家族代表性天然产物去甲花群海葵碱(Norzoanthamine,1)的首次全合成于2004 年发表于Science,路线长41 步。至今,该天然产物共有全合成路线三条,合成步骤36-47 步。较长的合成路线限制了其实用性,“药源不足”的困境依然是该类海洋生物碱由天然产物迈向药物的牢固枷锁。
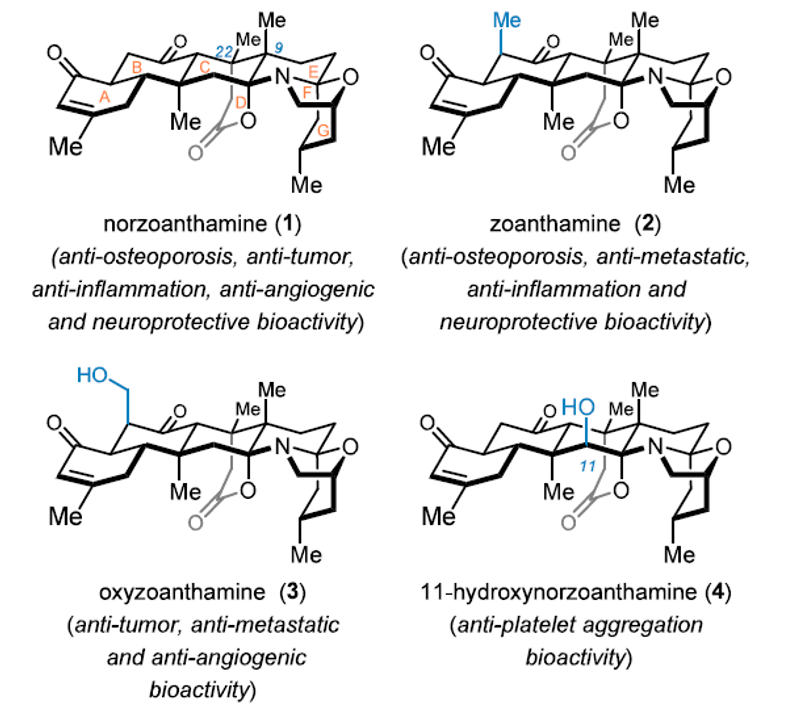
图1. 代表性花群海葵碱类海洋天然产物及其活性
该类天然产物的化学合成存在两个主要难点:1)ABC高氧化态三环母核骨架的构建;2)C9-C22位连续季碳手性中心的引入。针对上述难点,该团队设计了如下的合成方案(图2):
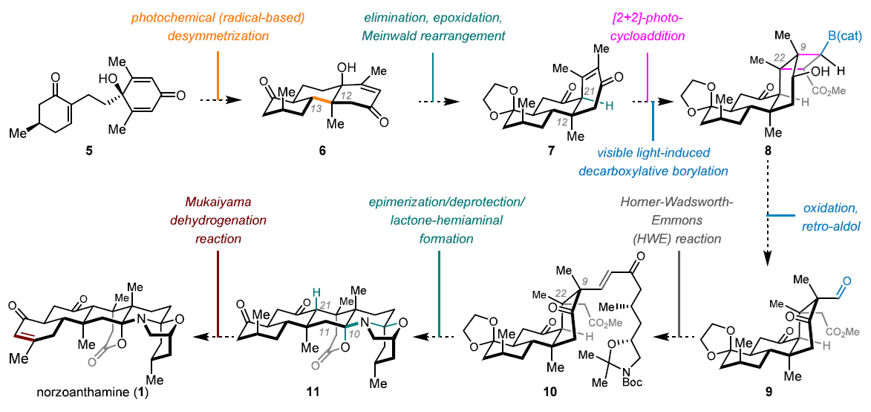
图2. 项目的初始合成方案
在ABC母核构建研究中,项目团队根据此类天然产物结构特点,发掘天然产物潜在的对称性因素,设计了去对称化合成策略。其中,三环母核化合物6预计通过可见光促进的自由基还原偶联反应实现。在解决合成的另一难点——C9-C22位连续季碳中心的引入方面,该团队摒弃天然产物结构原有的定式思维,利用Meinwald重排反应打造“非天然”的顺式并环骨架7。该调整反转了底物C环烯酮的面选择性,从而将C9-C22侧链的引入空间暴露出来,为后续的[2+2]反应实现连续季碳的合成创造条件。通过可见光促进的脱羧硼化反应可实现中间体8的合成,其氧化所得二级醇可用于逆Aldol反应切断四元环,进而合成中间体9。后续通过HWE烯化反应可引入侧链部分,并可利用酸性条件实现仿生串联环化及环系的顺反异构化,最终完成去甲花裙海葵碱(Norzoanthamine,1)的全合成。
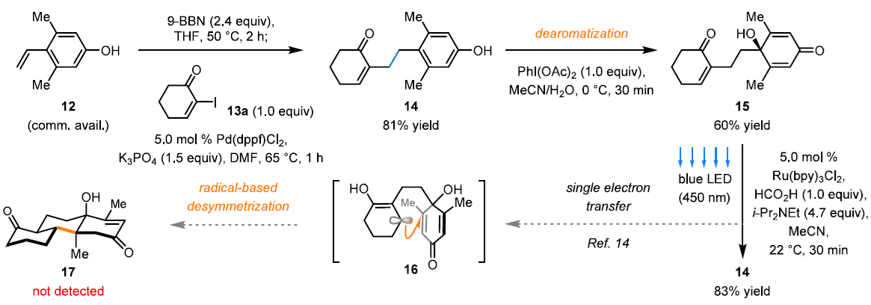
图3. 初代去对称化方案的研究
然而,初始的合成设计很快遇到了挑战(图3)。利用Suzuki偶联反应,化合物12与化合物13a可连接得到酚14,其在去芳构化条件下转化为去对称化前体15。项目团队期望通过可见光促进的烯酮自由基还原偶联条件,经过中间体16实现去对称化过程,合成三环化合物17。然而,该条件下,仅能得到重新芳构化的化合物14 (83% yield)。这证明在上述光反应条件下,C环双烯酮体系的还原优先于A环的单烯酮,因此未能实现期望的转化。
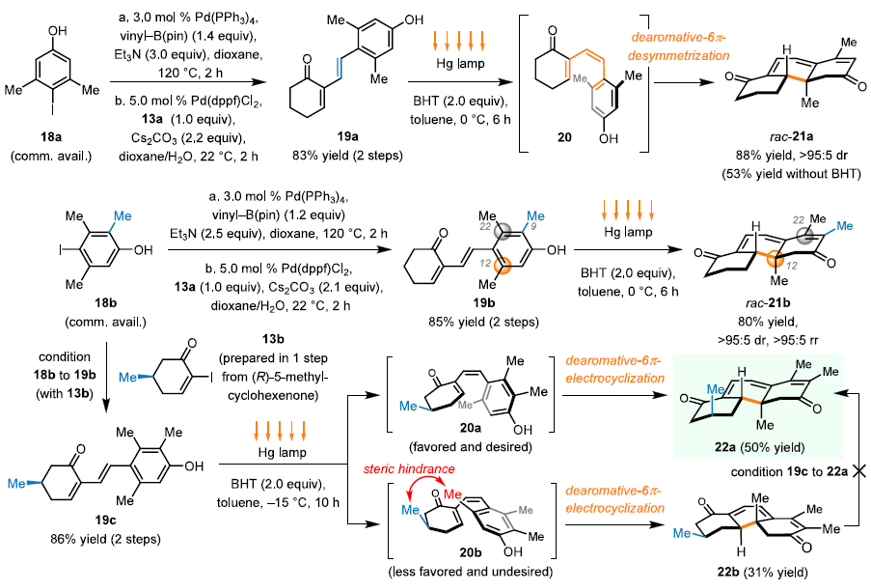
图4. 6π电环化去芳构化去对称化反应的开发
项目团队对合成的方案进行了大胆的创新,将先前依次进行的去芳构化和去对称化过程合二为一,开发了光促进的6π电环化去芳构化去对称化反应。该设计需要对前体14进行调整,使其在连接部分由饱和烷基改变为烯烃,进而合成了目标中间体19a(图4)。19a在光照条件下异构为顺式烯烃20,并成功发生6π电环化去芳构化得到消旋的三环化合物21a。值得一提的是还原剂BHT的加入显著提高了反应收率(88% vs 53%),推测其消耗了反应条件下产生的单线态氧,从而保护了易被氧化的19a。以此为基础,该团队对该反应予以拓展,证实C环引入额外甲基依然具有良好的区域选择性,而通过光学纯原料13b的引入可制备手性的三环高级中间体22a。至此该天然产物的ABC母核的合成仅需3步,这为后续的全合成研究奠定了坚实基础。
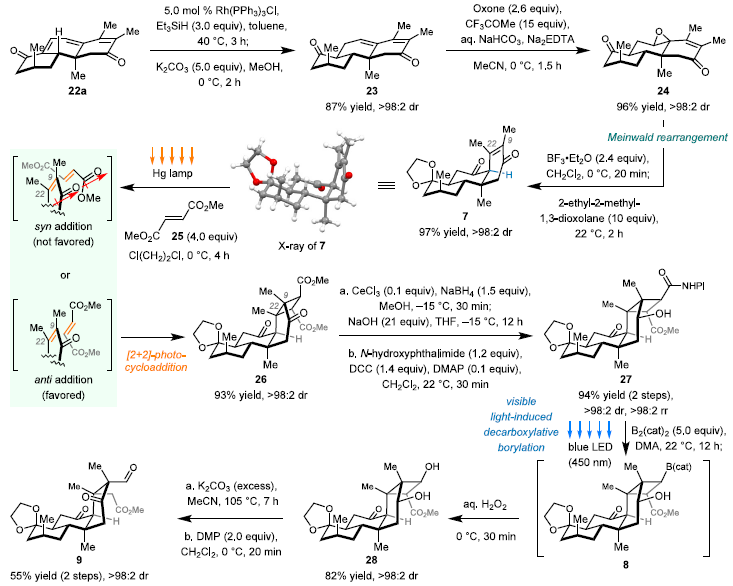
图5. C9-C22位连续季碳中心的构建
在得到关键中间体22a后,该团队利用硅氢化、环氧化及Meinwald重排反应,合成了顺式并环化合物7,其单晶结构中烯酮右侧空间开放,证实了合成设计的可行性(图5)。后续利用[2+2]光反应以93%的收率得到单一构型化合物26,其被转化为具有NHPI酯的化合物27,并通过可见光促进的脱羧硼化反应转化为二级醇28。28在碱性条件下发生逆Aldol反应,得到关键中间体9。至此C9-C22位连续季碳中心的构建已顺利实现。
利用HWE反应,化合物9与侧链相连接,得到中间体10(图6)。其在氢化及酯水解后,于酸性条件下反应,成功制备化合物11。该酸性条件采用“一石多鸟”的合成设计,同时实现了保护基的整体脱除、仿生串联环化、C21位手性翻转等多个过程。利用Mukaiyama烯化反应于11中引入A环的烯酮官能团,该团队最终实现了去甲花群海葵碱的全合成。
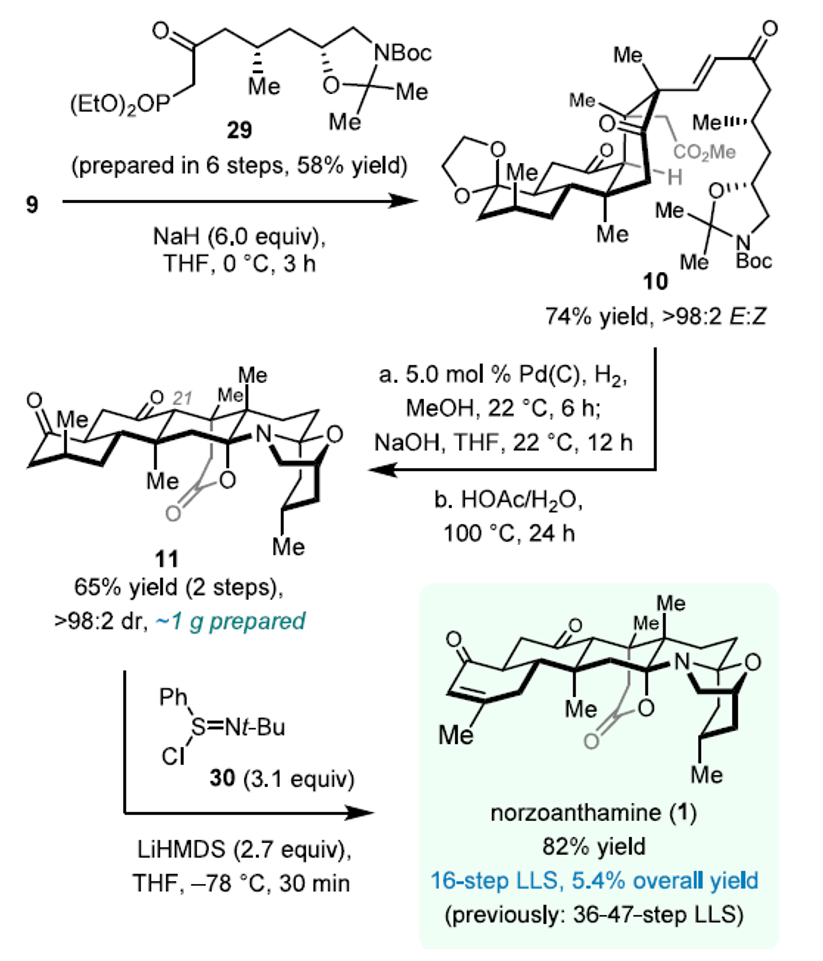
图6. 去甲花群海葵碱的全合成
总结
在新策略、新反应、新技术的协同作用下,该团队实现了去甲花群海葵碱的高效、简洁合成(图7)。该合成路线仅需16 步,较现有路线36-47 步显著缩短,且合成总效率最高(5.4% vs 0.0069-3.5%),合成规模最大(> 0.2 g),与现有合成工作相比具有优势。本工作为花群海葵碱类天然产物的家族化合成奠定了坚实基础,为后续的构效关系研究、靶点发现与活性筛选创造了有利条件。该研究有望对此类珍稀海洋生物碱的开发与应用产生显著的积极影响。
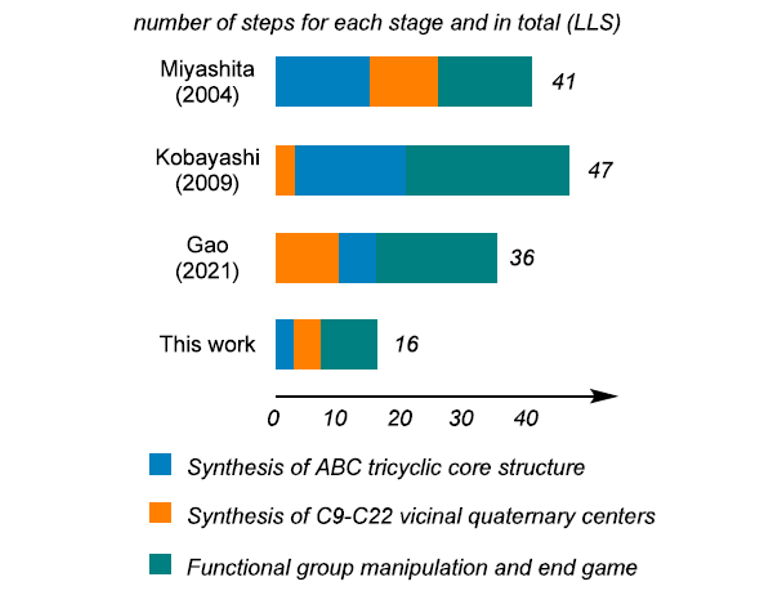
图7. 该工作与现有工作的比较
这一成果近期发表在Journal of the American Chemical Society 期刊上,复旦大学药学院孙域青年研究员为论文的通讯作者。复旦大学药学院硕士研究生孙昱晨、博士研究生张晓为该论文的共同第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Concise Synthesis of Norzoanthamine Enabled by a Set of Photochemical Transformations
Yuchen Sun, Xiao Zhang, Fuyin Jiang, Mengling Zhang, Wanru Wu, Yu Sun*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c14081
导师介绍
孙域课题组网站
https://www.x-mol.com/groups/sunyu
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号