北大雷晓光团队:STING拮抗剂天然产物Anhydrotuberosin的首次高效全合成及其生物机制解析
作者:X-MOL
2024-11-15
自身免疫疾病已经成为全球关乎公众健康的一类重要疾病,世界范围内约5%的人口受到自身免疫性疾病的影响,且近年来患病率呈现逐年上升趋势。干扰素基因刺激因子(stimulator of interferon genes protein, STING)能够调控一型干扰素和系列炎性细胞因子的生成,因此STING活性的动态平衡对于维持免疫稳态至关重要。STING 相关血管病变(STING-associated vasculopathy with onset in infancy, SAVI)和炎症性肠病等多种严重影响国民生命健康的自身免疫病均和STING的过度激活高度相关,但目前没有STING的抑制剂被批准上市,故临床上和STING活性过高相关的自身免疫病存在靶向性药物短缺的实际情况,因此开发安全高效的STING抑制剂用于自身免疫疾病治疗具有重要的科学意义和潜在的药用转化价值。
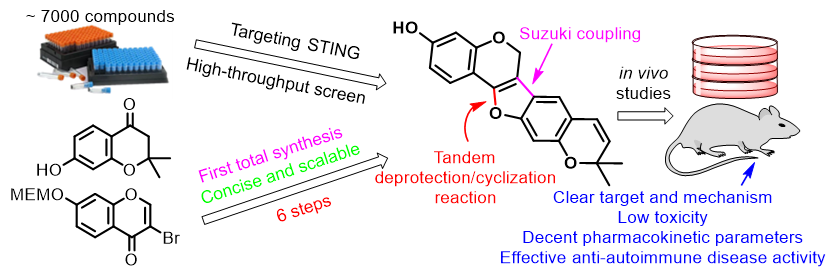
近日,北京大学化学与分子工程学院/北大-清华生命联合中心雷晓光 教授团队与首都医科大学附属北京儿童医院毛华伟 教授团队合作在Angew. Chem. Int. Ed. 通过高通量筛选首次发现并阐明了天然产物Anhydrotuberosin(ATS)是一种新型的STING小分子拮抗剂,且具有良好的抗自身免疫疾病活性。该研究还开发出首条高效的ATS全合成路线。
天然产物ATS的全合成及靶向STING发挥抗自身免疫疾病活性的机制解析
STING激活后会诱导下游干扰素IFN-β的转录,将IFN-β的启动子元件克隆到萤火虫荧光素酶的上游,同时利用海肾荧光素酶作为内参构建一套可实现高通量测试的双荧光素酶筛选体系,最终从近7000个单体化合物中鉴定到来源于葛根的天然产物ATS具有强效的STING抑制活性。鉴于ATS从植物中直接分离的得率极低,为了解决这一问题,作者从商业可得的原料出发以6 步反应完成了ATS的首次化学全合成。此路线可以大量合成目标天然产物,解决了后续生物研究的天然产物来源匮乏问题。
之后在蛋白水平证实ATS和STING具有直接的相互作用,并能够在HeLa、THP-1及SAVI病人来源的PBMC等多种细胞中显著性抑制STING激活后的下游信号。同时协同分子对接、关键氨基酸突变及ATS衍生的集成研究手段初步解析了ATS和STING蛋白的结合模式。最后,作者确认ATS在小鼠体内具有良好的药代动力学参数,并在与STING过度激活相关的Trex1敲除的自身免疫炎症疾病小鼠、葡聚糖硫酸钠诱导的炎症性肠病小鼠模型中证实ATS能够通过抑制STING缓解自身免疫疾病。 综上,作者通过高通量筛选首次鉴定到天然产物ATS是一个新型的STING小分子抑制剂,通过系列生物学活性测试初步证实ATS具有良好的抗自身免疫疾病的成药性,并发展了其首条高效的化学全合成路线。可以设想的是对ATS进行成药性的衍生优化创造出具有优化结构的其它衍生物,将有可能为STING靶向的药物研发提供具有临床转化价值的化学起点,并有希望在未来进行医学转化工作来满足临床实际的用药缺口。 雷晓光 教授管理了整个研究项目。雷晓光 教授和毛华伟 教授为该工作的通讯作者。文章的第一作者为雷晓光教授团队的郭富生 博士、张静 博士、博士生高一卉 和毛华伟教授团队的舒洲 博士;毛华伟教授团队的孙菲博士、马静博士及雷晓光教授团队的周栩博士、李文洋博士也为本工作做出了重要贡献。该工作得到国家重点研发计划、国家自然科学基金、北京分子科学国家研究中心、北大-清华生命联合中心、新基石基金会、中国博士后基金、北京大学博雅博士后等项目和单位的资助。
原文(扫描或长按二维码,识别后直达原文页面,或 点此查看原文 ):
Discovery and Total Synthesis of Anhydrotuberosin as a STING Antagonist for Treating Autoimmune Diseases
Fusheng Guo, Jing Zhang, Yihui Gao, Zhou Shu, Fei Sun, Jing Ma, Xu Zhou, Wenyang Li, Huawei Mao, Xiaoguang Lei
Angew. Chem. Int. Ed ., 2024 , DOI: 10.1002/anie.202407641
导师介绍
雷晓光
https://www.x-mol.com/groups/leigroup




































 京公网安备 11010802027423号
京公网安备 11010802027423号