新型双靶点抗真菌发光化合物:打破耐药性,攻克难治感染
抗真菌药物的耐药性是一个关键的问题,需要创新的治疗手段。双靶向机制(Dual-targeting mechanism of action)作为降低耐药性的有效策略,在对抗细菌感染药物设计中得到了验证。然而,真菌和哺乳动物细胞之间的相似性使得开发能够选择性杀死真菌的双机制药物极其困难。
在此背景下,新加坡国立大学、厦门大学附属翔安医院和上海交通大学第一人民医院的研究团队近日发表了一项研究成果——设计出具有双重靶向机制的新型小分子荧光化合物TPY和TPZ。该系列化合物通过双重机制——即破坏真菌细胞膜并造成DNA损伤,表现出优异的抗真菌效果,为解决抗真菌药物耐药性提供了新思路。
真菌耐药性挑战和抗菌靶点的选择
为了解决真菌耐药性带来的挑战,在过去的几年里人们已经做出了巨大的努力来确定新的抗真菌靶点,包括真菌细胞壁或细胞膜的特异性成分,以及代谢、DNA合成、线粒体功能和应激反应等过程。
真菌细胞膜不仅在维持形态和细胞存活方面都扮演着至关重要的角色,构成真菌细胞膜的成分也十分复杂,包括几丁质、β-葡萄糖和糖基化蛋白质等,这些成分的合成涉及多种代谢和生理过程。因此,破坏真菌膜涉及多种机制,这使得病原体很难通过单个基因突变来产生耐药性。此外,长期以来,DNA一直被认为是治疗各种疾病(包括癌症和病原体感染)的极佳靶点,因为它在存储遗传信息和确保生物体生长和代谢方面起着至关重要的作用。因此,将破坏真菌膜和DNA的双重靶向作用整合到单一抗真菌药物中,以减少耐药性和对抗真菌感染具有重大的潜力。然而,通过这种双重机制杀灭真菌的小分子尚未被报道,这种小分子治疗真菌感染的潜力仍旧被低估。
分子设计:双重靶向机制
该研究团队通过对具有DNA结合能力的荧光小分子TPW进行疏水性修饰,赋予其双重靶点机制,即通过破坏真菌细胞膜和诱导DNA损伤双重机制实现抗真菌效果。这一设计思路源自双靶点抗菌策略,该策略能够降低病原体通过基因突变产生抗药性的风险。相较于传统单一靶点的抗真菌药物,TPY和TPZ不仅表现出良好的抗真菌活性,还能够有效降低耐药性的产生,使其在白色念珠菌等真菌病原体的抗感染治疗中展现出良好的潜力。
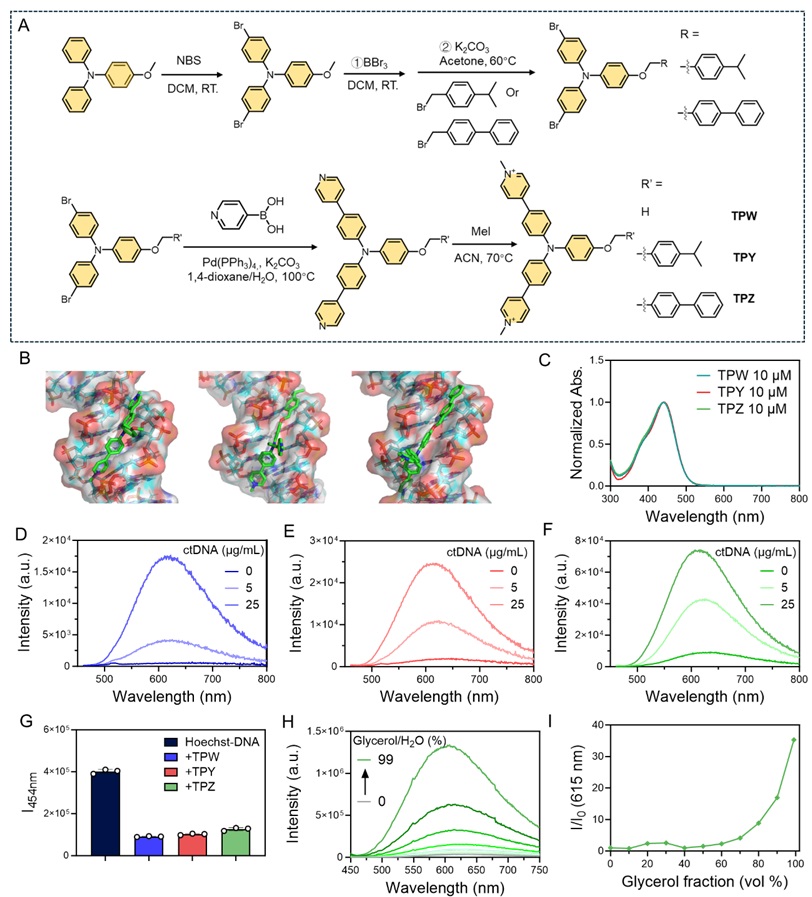
TPW、TPY和TPZ的分子合计和光物理性质
TPY和TPZ的抗真菌表现
通过一系列实验,研究团队验证了TPY和TPZ的高效抗真菌活性。实验显示,这些化合物能够在数分钟内渗透真菌细胞膜,并迅速累积在真菌细胞核内,与DNA结合后引发遗传物质损伤。与传统药物相比,TPZ不仅在体外具有低至2 μM的最低抑菌浓度(MIC),且在对真菌生物膜的抑制上表现出显著优势。此外,真菌耐药性的测试中,在亚致死浓度连续传代30代后,仍旧没有观察到白色念珠菌对TPZ产生明显的耐药性。这些结果进一步验证了双重靶向机制对抗真菌感染及其耐药性的有效性。
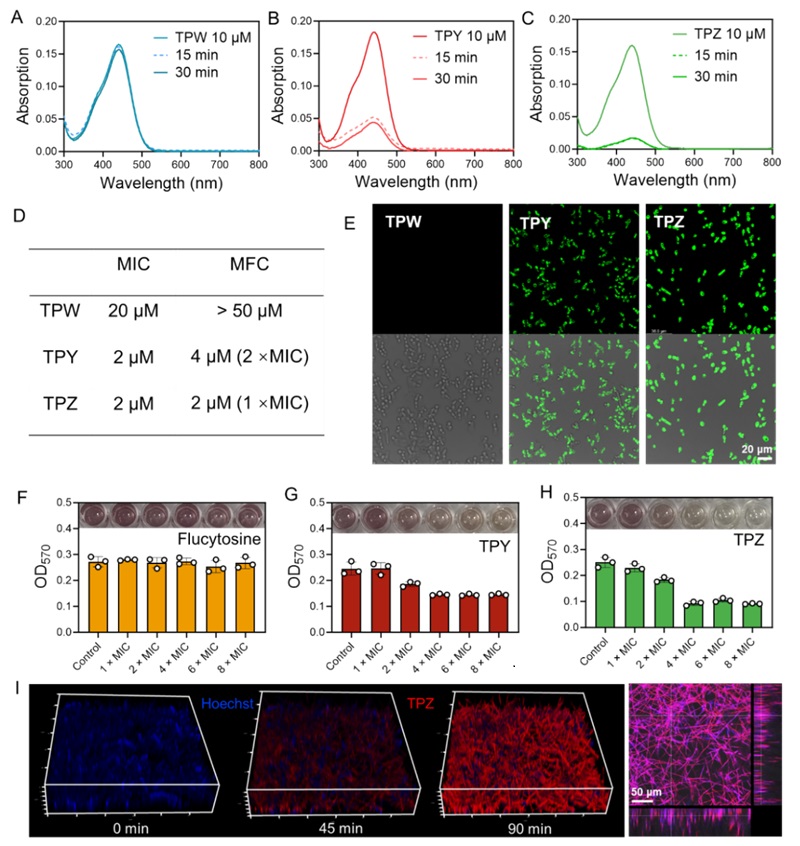
TPY和TPZ的抗真菌表现
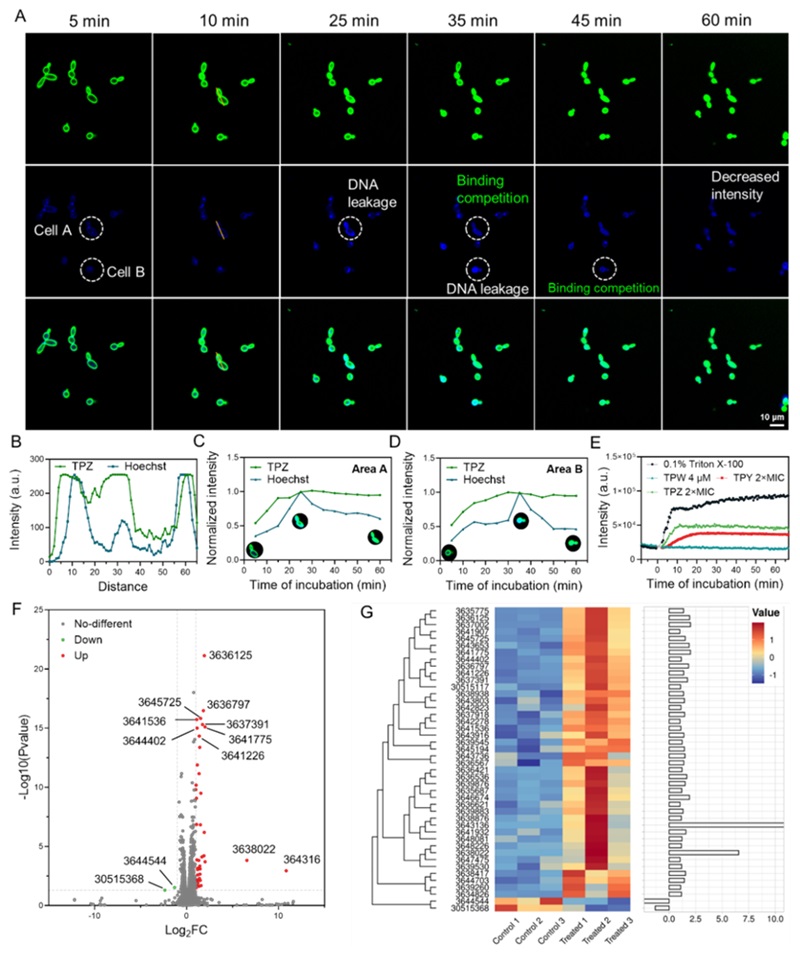
抗真菌机理研究
良好的生物相容性与高选择性
虽然TPY和TPZ对真菌细胞表现出强效的杀菌能力,但在对正常哺乳动物细胞的影响方面表现出高度选择性。研究团队以NIH/3T3细胞和红细胞作为研究对象,对这些化合物的生物相容性进行了研究。结果显示,在高浓度下TPY和TPZ对正常的哺乳动物细胞并未表现出明显的毒性。这一特性为其在体内应用提供了安全保障。在实验中,TPZ被证明能够选择性地作用于真菌细胞的细胞核,而对哺乳动物细胞的细胞核无显著影响。研究人员们推测,这可能是由于其在哺乳动物细胞中主要累积在脂滴中,从而避免了对细胞核的损伤。
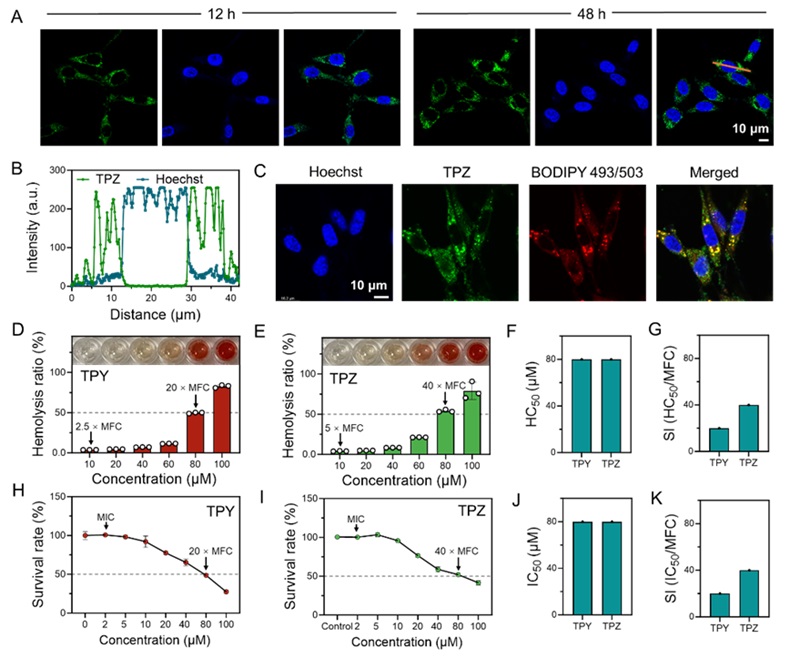
TPY和TPZ的生物相容性
此外,在小鼠白色念珠菌诱导的阴道炎模型中,TPY和TPZ展现了有效的抗感染活性。通过局部给药,这些化合物显著减少了感染组织中的真菌负荷并有效缓解了组织炎症反应。与常规药物相比,TPY和TPZ在降低感染真菌数量和炎症水平上表现出更高的清除率。研究还进一步通过系统毒性测试确认了其良好的体内相容性,这表明该化合物有望成为安全有效的抗真菌治疗选择。

体内抗真菌实验(小鼠阴道炎模型)
未来展望:新型抗真菌治疗手段
TPY和TPZ的开发为抗真菌治疗带来了新的希望,尤其是在降低真菌感染耐药性方面。同时,TPY和TPZ的双靶点机制也为设计其他具有类似机制的抗真菌化合物提供了参考。对于医院获得性感染、免疫抑制患者的严重真菌感染,这类新型双靶点化合物有望成为替代传统疗法的新型抗真菌方案。
相关论文发表于J. Am. Chem. Soc.,第一作者为新加坡国立大学博士生刘祥隆、厦门大学附属翔安医院副主任医师李浩、新加坡国立大学博士后齐国斌,通讯作者为上海市第一人民医院施雷雷副研究员;新加坡国立大学刘斌教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Combating Fungal Infections and Resistance with a Dual-Mechanism Luminogen to Disrupt Membrane Integrity and Induce DNA Damage
Xianglong Liu, Hao Li, Guobin Qi, Yunyun Qian, Bowen Li, Leilei Shi*, Bin Liu*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c09916
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!








































 京公网安备 11010802027423号
京公网安备 11010802027423号