上海交大谭蔚泓院士/杨宇教授:新型多价核酸适体-药物偶联物显著提升肿瘤铜死亡疗效
第一作者:王爽,刘学良,魏大力
通讯作者:谭蔚泓,杨宇
通讯单位:上海交通大学医学院分子医学研究院
全文速览
本文开发了一种新型的具有核小体样结构的多价核酸适体-药物偶联物用于负载和肿瘤靶向递送铜死亡诱导剂。这种多价核酸适体-药物偶联物将铜死亡诱导剂递送到肿瘤部位后,会释放出Cu2+、H2O2及伊利司莫(铜离子载体),Cu2+催化H2O2发生类芬顿反应诱导肿瘤细胞谷胱甘肽(GSH)耗竭抑制其对铜离子的螯合,同时过量的铜离子能够诱导肿瘤细胞线粒体铜过载,这种基于线粒体铜过载和GSH耗竭的“开源节流”的策略能够高效诱导肿瘤细胞发生铜死亡,从而抑制肿瘤生长。
背景介绍
1. 铜死亡
铜死亡(Cuproptosis)是近几年发现的新型细胞死亡方式,与传统的细胞死亡途径(如凋亡、焦亡、坏死、铁死亡等)不同,铜死亡主要依赖于线粒体内铜过载。线粒体中过量的铜离子与三羧酸循环中的脂酰化蛋白结合,会导致脂酰化DLAT寡聚化和Fe-S簇下调,诱导蛋白毒性应激反应,最终导致铜死亡(Science, 2022, 375, 1254-1261)。然而,先前铜离子载体药物(伊利司莫)临床试验的失败为肿瘤铜死亡疗法的临床应用带来了更多不确定性,究其原因可能是肿瘤细胞对铜死亡敏感性有限。这种低敏感性主要由于铜死亡对线粒体内铜离子浓度的高度依赖,仅依赖内源性铜离子难以高效诱导线粒体铜过载,除此之外,肿瘤细胞内高表达的谷胱甘肽(GSH)会螯合铜离子,抑制铜离子与蛋白的相互作用,从而抑制铜死亡发生。
2. 多价核酸适体药物偶联物
由于铜死亡诱导剂(如铜离子)等对人体健康组织具有广泛的杀伤作用,因此需要开发安全、高效、精确的靶向药物递送系统用于肿瘤铜死亡治疗。核酸适体是一种能够与相应的靶标分子特异性结合的寡核苷酸序列,具有结合特异性高,免疫原性低以及易于合成等优点,已被用于药物的肿瘤靶向递送。然而,短链单价的功能核酸序列存在亲和力不强、稳定性差、血液循环半衰期短、体内靶向递送效率较低等限制,难以满足铜死亡诱导剂对精准靶向递送的要求。针对短链单价核酸适体在药物递送领域面临的挑战,研究者先前的研究开发了一系列的长链多价核酸适体(Sci. Adv. 2023, 9, eadf3329; Angew. Chem. Int. Ed. 2023, 135, e202307020; Angew. Chem. Int. Ed. 2024, 63, e202311309; J. Am. Chem. Soc., 2024, 146, 13805-13816),能够通过多价效应显著增强对靶标的亲合力和选择性,并增加药物的负载效率。同时,长链多价核酸适体更大的尺寸能够有效提高核酸适体的稳定性,延长药物的血液循环时间,促进药物在肿瘤部位的驻留,增强药物的靶向递送效果。因此开发基于多价aptamer和多价PolyT的长链DNA的递送系统有望实现铜死亡诱导剂安全高效的靶向递送。
研究出发点
为提高肿瘤细胞对铜死亡治疗的敏感性,研究者提出了一种“开源节流”的治疗策略以增强肿瘤细胞对铜死亡治疗的响应。具体而言,通过递送外源性铜离子进入肿瘤细胞以增加其胞内铜离子浓度,在铜离子载体伊利司莫的作用下,外源性铜离子被转运到线粒体导致肿瘤细胞线粒体铜过载,称为“开源”;另一方面将过氧化铜纳米点递送到肿瘤细胞内,使其响应溶酶体酸性环境分解,产生Cu2+和H2O2并催化发生类芬顿反应从而高效消耗肿瘤细胞内高水平的GSH,诱导GSH耗竭的发生,从而避免GSH螯合铜离子,称为“节流”。合成了含有过氧化铜和伊利司莫-Cu2+的CuPEs纳米点用于实现“开源节流”的策略。
除此之外,研究者开发了一种新型多价核酸适体纳米药物偶联物,含有多价EpCAM(肿瘤标志物)核酸适体和多价polyT序列,其中polyT序列能够螯合铜离子,最终能够实现对CuPEs纳米药物的有效负载和肿瘤靶向递送,避免其潜在毒性并提高铜死亡治疗疗效。
结果与讨论
1. 多价核酸适体纳米药物偶联物CuPEs@PApt合成与表征
Figure 1A是多价核酸适体纳米药物偶联物CuPEs@PApt的合成过程以及“开源节流”铜死亡协同治疗策略的作用机制。简而言之,先通过一锅法制备了含有过氧化铜和伊利司莫-Cu2+的CuPEs纳米点,随后将滚环扩增获得的含有多价EpCAM核酸适体和polyT序列的PApt与先前制备的CuPEs纳米点混合,最终获得了多价核酸适体纳米药物偶联物CuPEs@PApt。通过原子力显微镜(AFM)对制备过程中每一步的底物和产物进行了表征(Figure 1B),值得注意的是最后合成的CuPEs@PApt呈现出类似核小体的构象,PApt中的polyT序列(~4 nm)缠绕CuPEs纳米点(~1 nm)从而在AFM镜下表现为长链DNA上凸起(更亮)的点。除此之外,CuPEs@PApt长链结构也增强了核酸适体和polyT序列的抗酶切稳定性(Figure 1C)和抗血清稳定性(Figure 1D)。最终验证了CuPEs@PApt能够响应酸性环境分解(Figure 1E)并发生类芬顿反应消耗GSH(Figure 1F)。
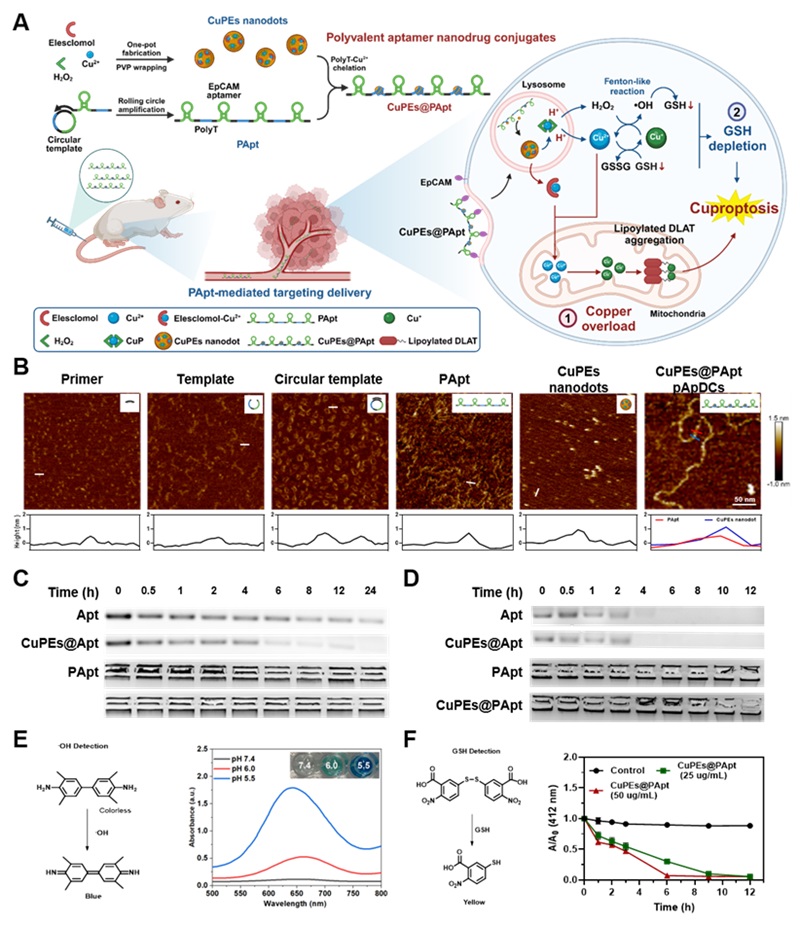
Figure 1. The design, synthesis and characterization of CuPEs@PApt. (A) A scheme illustrating the preparation of CuPEs@PApt polyvalent aptamer nanodrug conjugates and the mechanism of enhanced tumor cuproptosis induced by the “open-source cost-saving” strategy. (B) Top: atomic force microscopy (AFM) image of RCA products, including primers, templates, circular templates, polyvalent aptamer sequences (PApt), CuPEs nanodots, and CuPEs@PApt. Bottom: height profile of a representative sample (as indicated in the AFM image). (C) Gel electrophoresis showed the antienzymatic cleavage stability of monovalent EpCAM aptamer-PolyT sequence (Apt), CuPEs@Apt, PApt, CuPEs@ PApt incubated with Exonuclease I for different times. (D) Gel electrophoresis showed the antiserum stability of Apt, CuPEs@Apt, PApt, CuPEs@ PApt incubated with 10% serum for different times. (E) The pH-responsive •OH production of CuPEs@PApt with the TMB, which changes from colorless to blue upon reaction with •OH. (F) The GSH depletion of CuPEs@PApt with DTNB as the trapping agent, which can react with GSH to change from colorless to yellow. The error bars were based on triplicate measurements.
2. “开源节流”策略增强肿瘤细胞铜死亡治疗
在体外对“开源节流”策略的有效性进行了验证,首先通过ICP-OES验证了CuPEs@PApt确实能够通过递送外源性铜离子诱导肿瘤细胞铜过载(Figure 2A),其次通过共聚焦显微镜验证了CuPEs@PApt进入肿瘤细胞后能够发生类芬顿反应产生•OH(Figure 2B)并消耗肿瘤细胞内高表达的GSH(Figure 2C),诱导GSH耗竭。铜死亡相关蛋白(DLAT、LIAS、FDX1)WB结果显示CuPEs@PApt诱导肿瘤细胞发生铜死亡效率最高,表明诱导肿瘤细胞线粒体铜过载及GSH耗竭的“开源节流”策略能够有效增强肿瘤细胞对铜死亡的敏感性,并能够高效杀伤肿瘤细胞(Figure 2E)。
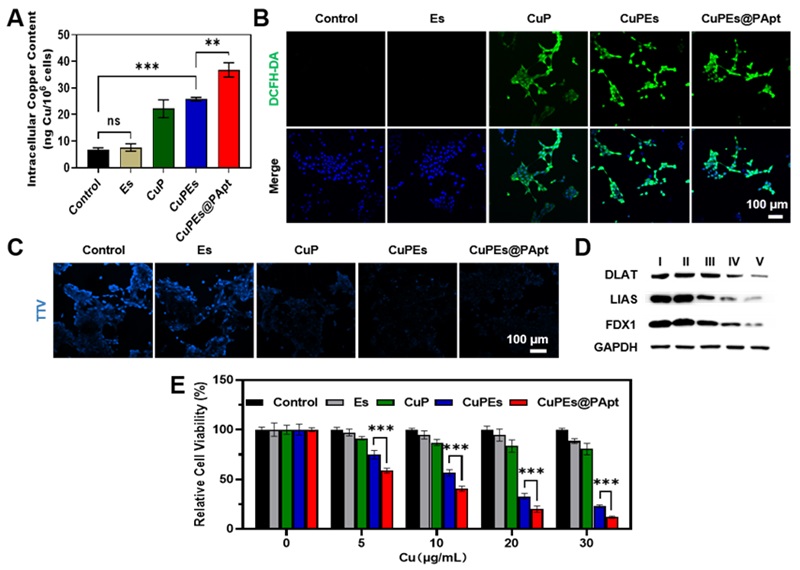
Figure 2. In Vitro enhanced tumor cell cuproptosis induced by CuPEs@PApt. (A) The intracellular copper content of 4T1 cells following various treatments determined by ICP-OES. Representative CLSM images of •OH production (B) and GSH level (C) within 4T1 cells treated by Es, CuP, CuPEs, and CuPEs@PApt. •OH was detected by DCFH-DA fluorescent probe. GSH was detected by ThiolTrace Violet 500 (TTV) fluorescent probe. (D) Western blot assay to determine free lipoylated DLAT, LIAS, and FDX1 in 4T1 cells treated with (I) Control, (II) Es, (III) CuP, (IV) CuPEs, and (V) CuPEs@PApt. (E) Relative cell viability of 4T1 cells preincubated at 4 °C for 1h with Control, Es, CuP, CuPEs, and CuPEs@PApt at different copper ion concentrations. The error bars were based on triplicate measurements. P values were calculated by the Student’s t-test, ***p < 0.001, **p < 0.01, or *p < 0.05.
3. 多价核酸适体药物偶联物实现肿瘤靶向药物递送
为评估多价核酸适体药物偶联物CuPEs@PApt肿瘤靶向递送效率,对CuPEs@PApt标记了ICG,并通过近红外活体成像系统考察ICG@CuPEs@PApt的体内分布,结果显示多价核酸适体能够高效促进药物在肿瘤部位的富集(Figure 3A-C)。随后评估了静脉给药后CuPEs@PApt对4T1肿瘤的治疗效果,结果显示CuPEs@PApt由于更强的靶向递送效率,因此实现了最佳的治疗效果(Figure 3D-H)。
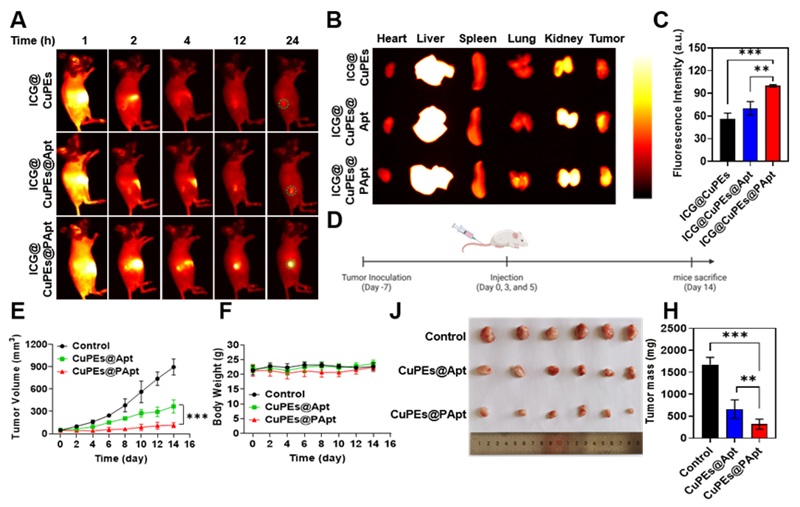
Figure 3. Enhanced tumor-targeted drug delivery by CuPEs@PAptin vivo. (A) In vivo biodistribution of ICG@CuPEs@PApt at different time points post intravenous injection. (B) The biodistribution of ICG@CuPEs@PApt in excised major organs (i.e., heart, liver, spleen, lung, kidney) and tumors after 24 h. (C) Quantitative analysis of the distribution of ICG@CuPEs@PApt in excised tumors (n = 3). (G) Schematic illustration of the experimental design to evaluate the biocompatibility and systemic antitumor effect of CuPEs@PApt by intravenous administration. Tumor growth kinetics (H) and body weight (I) of mice treated by Control, CuPEs@Apt, and CuPEs@PApt, respectively (n = 6). Photograph (J) and mass (K) of tumors from mice post various treatments collected at day 14.
总结与展望
研究者提出了一种基于铜死亡的新型肿瘤治疗策略,称为“开源节流”。该策略主要通过诱导肿瘤细胞线粒体铜过载和GSH耗竭协同破坏铜稳态,从而高效诱导肿瘤细胞发生铜死亡,提高抗肿瘤治疗疗效。其他增强肿瘤细胞对铜死亡敏感性的方法,如通过抑制铜离子外排或增强线粒体呼吸的生物过程,通常需要时间发挥作用,但铜离子作为小分子“快进快出”的药代动力学过程使在肿瘤部位滞留时间很短,因此难以与这些方法实现最佳的联合治疗效果。通过类芬顿反应产生•OH从而耗竭GSH的化学反应能够迅速增强肿瘤细胞对铜死亡的敏感性,因此能够实现最佳的联合治疗效果。由于铜离子等铜死亡诱导剂的潜在毒性以及其在肿瘤部位分布较少且滞留时间短导致其治疗窗口窄,为拓宽铜死亡诱导剂治疗窗口,开发了一种新型的铜死亡诱导剂递送系统——多价核酸适体药物偶联物用于实现铜死亡诱导剂的高效负载和靶向递送,促进药物在肿瘤的富集以避免其在非靶向组织的毒性,并提高铜死亡治疗效果。展望未来,期待基于铜死亡的“开源节流”治疗策略能够为肿瘤铜死亡治疗,尤其是化疗耐药的肿瘤治疗提供新的解决方案。同时,希望多价核酸适体药物偶联物能够推动金属离子药物靶向递送系统的设计与合成。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Polyvalent Aptamer Nanodrug Conjugates Enable Efficient Tumor Cuproptosis Therapy Through Copper Overload and Glutathione Depletion
Shuang Wang, Xueliang Liu, Dali Wei, Huayuan Zhou, Jiawei Zhu, Qing Yu, Lei Luo, Xinfeng Dai, Yiting Jiang, Lu Yu, Yu Yang*, Weihong Tan*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c06338
导师介绍
谭蔚泓
https://www.x-mol.com/university/faculty/10092
杨宇
https://www.x-mol.com/university/faculty/376831
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号