东南大学梁高林教授课题组近年来工作概览
梁高林,东南大学首席教授,生物科学与医学工程学院博士生导师,数字医学工程全国重点实验室副主任,国家杰出青年科学基金获得者。1989年考入南京大学基础学科教学强化部(理科第一名)并于1993年获南京大学物理化学专业学士,2002年获得郑州大学化学工艺专业硕士,2005年获得复旦大学药物化学专业博士。1993年至2002年,江苏省原子医学研究所助理研究员。2005年9月至2008年1月香港科技大学化学系博士后,导师徐兵教授。2008年1月至2010年5月,美国斯坦福大学医学院博士后,导师饶江宏教授。2010年3月-2021年3月,中国科学技术大学化学系教授。2018年12月至今,东南大学生物科学与医学工程学院教授。

梁高林教授主要从事分子影像和生物医药领域的研究。截至目前,以通讯作者的身份在Nat. Chem., Nat. Commun., Sci. Adv., J. Am. Chem. Soc., Angew. Chem. Int. Ed.等国际期刊上发表了SCI论文200余篇,论文被引11000余次,H因子55。主持或参与科技部国家重点研发计划3项、基金委创新研究群体项目1项、国家杰出青年科学基金1项及基金委重点等项目6项。先后获得国家二类新药证书1项、中国专利10项、世界专利1项,美国专利1项。荣获2020年国务院政府特殊津贴、入选2019年国家百千万人才工程、被授予“有突出贡献中青年专家”、获2019年安徽省自然科学二等奖(排名第一)、2017年“国家杰出青年科学基金”资助、2010年教育部“新世纪优秀人才支持计划”。
原位自组装是一种利用生理环境中的特定刺激(如pH、酶等)触发小分子自发聚集形成纳米结构的技术,兼具小分子易于摄取和纳米结构长效滞留的优势。梁高林教授课题组基于CBT-Cys点击反应和Nap-FF自组装体系,开发了一系列细胞内自组装的纳米探针或药物。此外,课题组还积极利用该反应体系设计新型纳米材料和分子探针。近年来,团队取得了多项代表性成果:
(一)双重聚集增强AIEgen的成像信号
聚集诱导发光染料(AIEgen)是一种具有良好临床应用潜力的荧光探针,目前的研究通常仅通过AIEgen的“单重聚集”实现荧光的“点亮”,成像信号有限。为了克服这一局限性,梁高林教授课题组利用CBT-Cys点击反应实现了AIEgen的“双重聚集”,从而进一步增强成像信号并提高灵敏度。具体来说,设计的探针分子QMT-CBT在神经炎症细胞高表达的Caspase-1的激活下发生CBT-Cys点击反应生成环状二聚体(单聚集),并进一步自组装成纳米颗粒(双聚集),最终“点亮”并增强AIE信号,以实现阿尔茨海默症的高灵敏荧光成像(J. Am. Chem. Soc., 2023, 145, 27748-27756)。
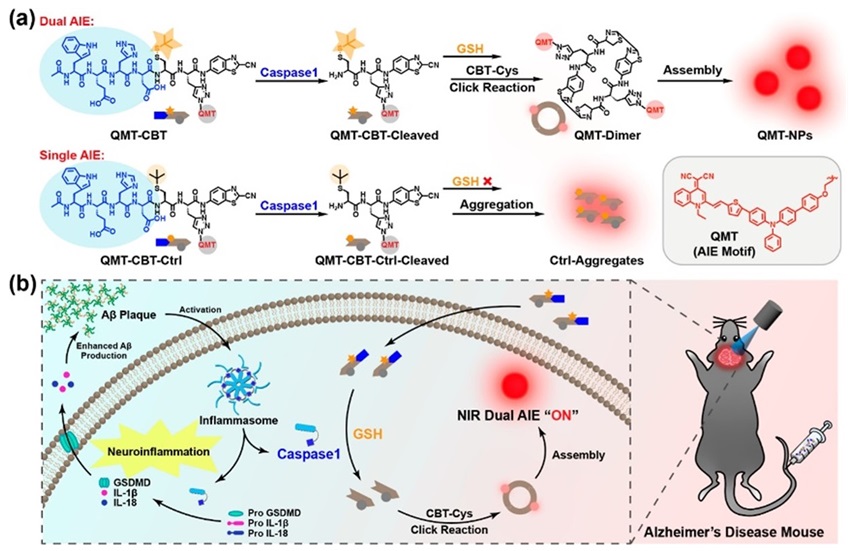
图1. 近红外AIEgen的双重聚集用于增强阿尔茨海默症成像示意图。
为了进一步增强成像的特异性,该课题组还提出了一种串联靶向与双重聚集结合的策略,通过靶向生物素受体和亮氨酸氨基肽酶(LAP),将探针Ala-Biotin-QMT精准递送到肿瘤细胞中,实现有别于正常组织的高对比度的AIE荧光成像(J. Am. Chem. Soc., 2024, 146, 25462-25466)。
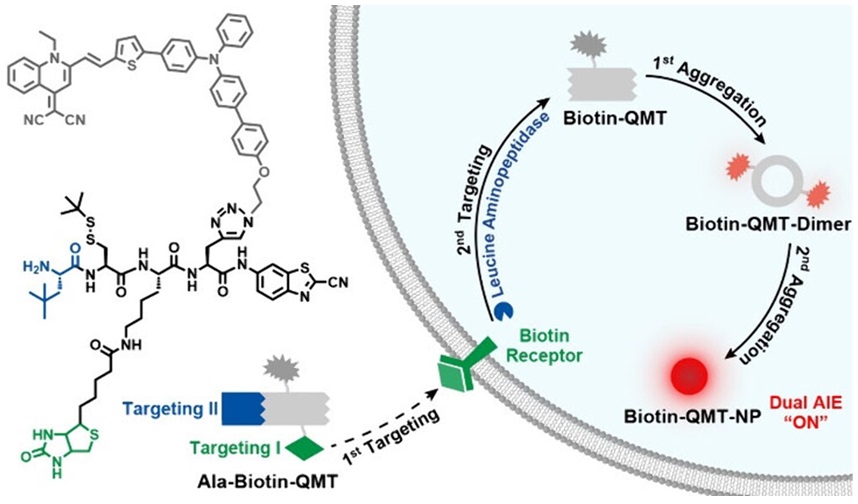
图2. AIEgen的串联靶向和双重聚集结合用于增强肿瘤的近红外荧光成像示意图。
(二)原位自组装引导药物胞内富集和激活
原位自组装纳米药物有助于实现药物在病变部位的浓聚和响应释放,显著提高药物疗效。梁高林教授课题组利用Nap-FF自组装体系开发了一系列纳米药物。其中,设计的三叉戟分子Nap-CPT-HCQ-Yp在碱性磷酸酶(ALP)的水解下原位自组装形成纳米纤维,在羧酸酯酶(CES)剪切后释放化疗药物喜树碱(CPT)和自噬抑制剂羟基氯喹(HCQ)。这种原位形成的纳米纤维有效抑制了癌细胞的转移和侵袭行为,而HCQ则通过抑制细胞自噬增强CPT的化疗效果。三者的协同作用在高效杀死癌细胞的同时,诱发机体产生免疫原性细胞死亡(ICD),并联合免疫检查点抑制剂刺激全身免疫反应。该策略同时阻碍了原发性肿瘤转移和远端肿瘤生长,实现了对肿瘤转移的高效抑制(J. Am. Chem. Soc. 2022, 144, 11897-11910)。
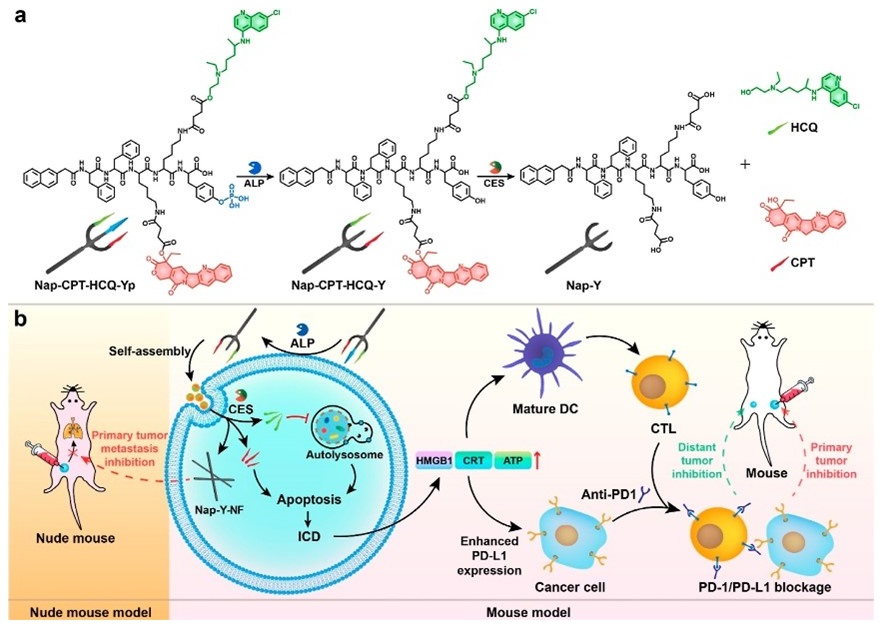
图3. 具有纳米刷-纳米颗粒-纳米纤维转变特性的三叉戟分子在空间上抑制肿瘤转移示意图。
此外,这种自组装单元在偶联靶向基团后能够实现纳米药物在特定部位的聚集,干扰相关信号通路。例如,该课题组将Nap-FF自组装单元与六肽IRLRFK偶联后能精准识别AXL激酶,并原位自组装形成纳米纤维网络,阻止其与配体GAS6的结合,从而抑制AXL激酶及其下游信号通路激活,最终诱导癌细胞凋亡,实现对卵巢癌的高效治疗(Adv. Mater., 2024, 36, 2308504)。
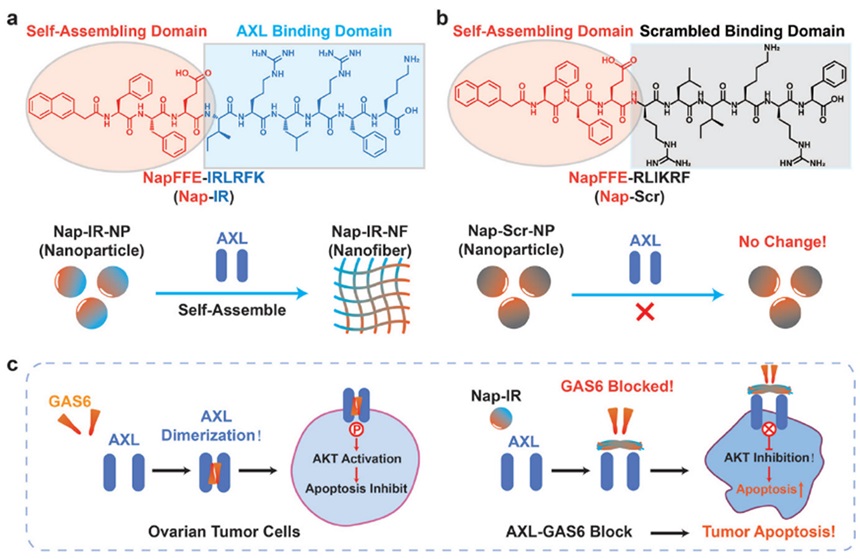
图4. 原位纳米纤维形成阻断AXL与GAS6结合以抑制卵巢癌发展示意图。
在肿瘤细胞凋亡过程中,Caspase-3的表达量显著增加,这一特征使其成为潜在的生物标志物和响应单元。因此,该课题组创新性地提出了一种凋亡放大组装(Apoptosis-Amplified Assembly,3A)的策略,经光/药物诱导产生的凋亡蛋白酶Caspase-3识别并剪切Ac-DEVDD-TPP生成D-TPP,在线粒体周围原位自组装形成纳米纤维。在激光照射下,D-TPP纳米纤维可以产生更多单线态氧,诱导细胞深度凋亡,进而产生更多Caspase-3,完成凋亡放大组装的过程。这种循环放大机制显著增强了癌细胞的凋亡进程,实现了对口腔癌增强的光动力治疗(J. Am. Chem. Soc., 2023, 145, 7918-7930)。
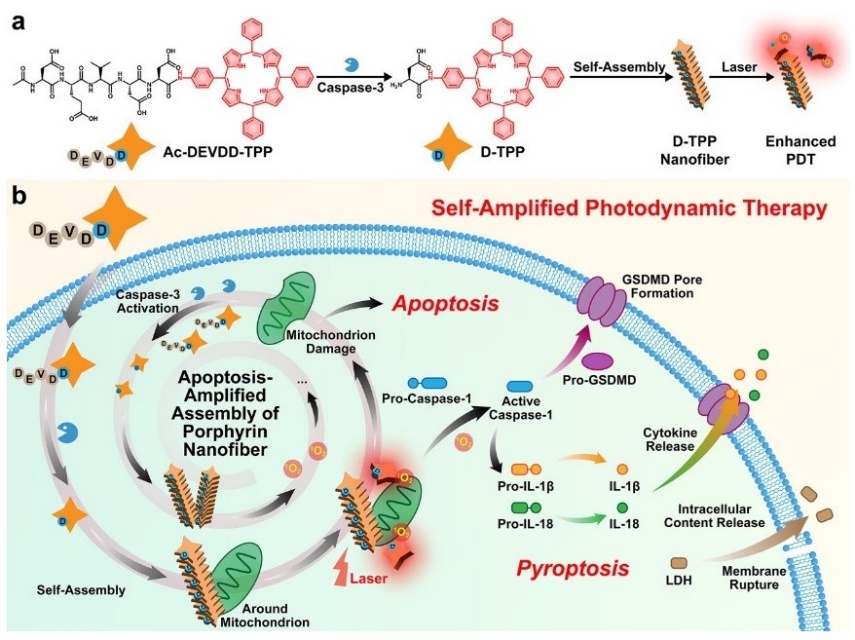
图5. 凋亡放大组装的卟啉纳米纤维增强口腔肿瘤的光动力治疗示意图。
靶向配体常用于修饰纳米药物,以提高治疗的特异性。其中,多价修饰更能显著增强药物与受体之间的结合亲和力。在这一背景下,该课题组首次提出了一种客体-主体-配体串联识别机制,以特异性靶向巨噬细胞表面的甘露糖受体。当Cip-CBT-Ada进入感染的巨噬细胞后,在Caspase-1(一种细菌感染中的过表达酶)和谷胱甘肽(GSH)剪切下原位自组装形成纳米颗粒Nano-Cip。最终Nano-Cip在酯酶的作用下持续、缓慢释放环丙沙星,从而高效杀灭细胞内的金黄色葡萄球菌,并有效缓解细胞区域的炎症(Angew. Chem. Int. Ed., 2023, 62, e202306427)。

图6. 客体-主体-受体串联识别精确引导环丙沙星消除细胞内金黄色葡萄球菌示意图。
(三)超分子自组装驱动力控制化学反应区域选择性
叠氮-炔烃环加成反应常常受到反应速率和产物低区域选择性的限制。尽管通过升温和添加金属离子催化剂可以克服这些局限,但这往往会影响生物兼容性。为了解决这一问题,梁高林教授课题组利用超分子自组装来提高叠氮-炔烃环加成反应的区域选择性。在水溶液中,Nap-FFK-Azi和Nap-FFG-Alk自发形成有序的纳米纤维,非共价相互作用使得分子之间相互靠近,进而促进环加成反应的发生。随着自组装和环加成反应的进行,纤细的纳米纤维逐渐转变为较宽的纳米带。高效液相色谱(HPLC)分析也显示出环加成产物Nap-FFK-Tria-GFF-Nap的生成,进一步印证了组装驱动的环加成反应的成功实现(Nat. Commun., 2023, 14, 3935)。
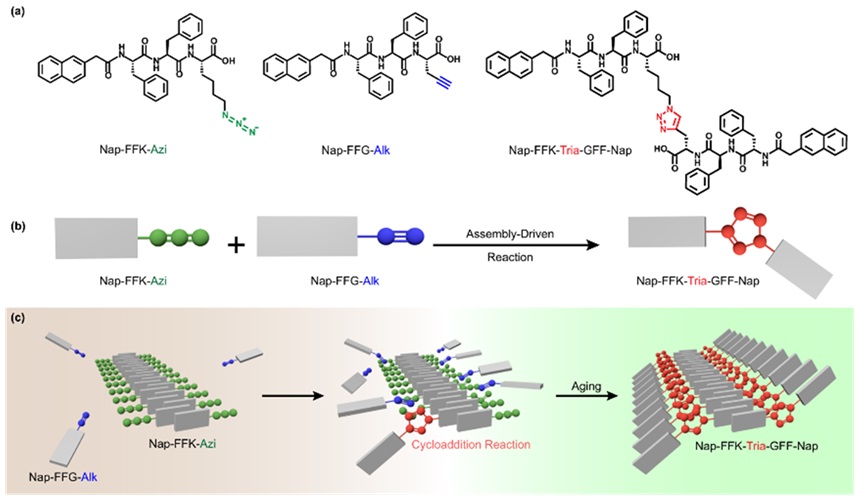
图7. 自组装驱动区域选择性的叠氮-炔烃环加成反应示意图。
(四)双酶触发的荧光素原位形成以实现精准生物发光
荧光素的氨基(羟基)或羧基脱笼“点亮”生物发光的技术已被广泛应用于多种生物标志物的检测成像(Anal. Chem., 2023, 95, 14165-14168)。然而,基于单一分析物响应的检测精度仍然非常有限。着眼于此,梁高林教授课题组开发了两个新型化合物TFGC和KGRR-CBT,它们可以分别被自噬标志物Atg4B和CTSB剪切,释放出荧光素构建单元D-Cys和CBT。二者通过CBT-Cys点击反应在原位快速生成荧光素,从而实现对癌症自噬过程的精准生物发光成像(ACS Cent. Sci., 2023, 9, 2251-2256)。
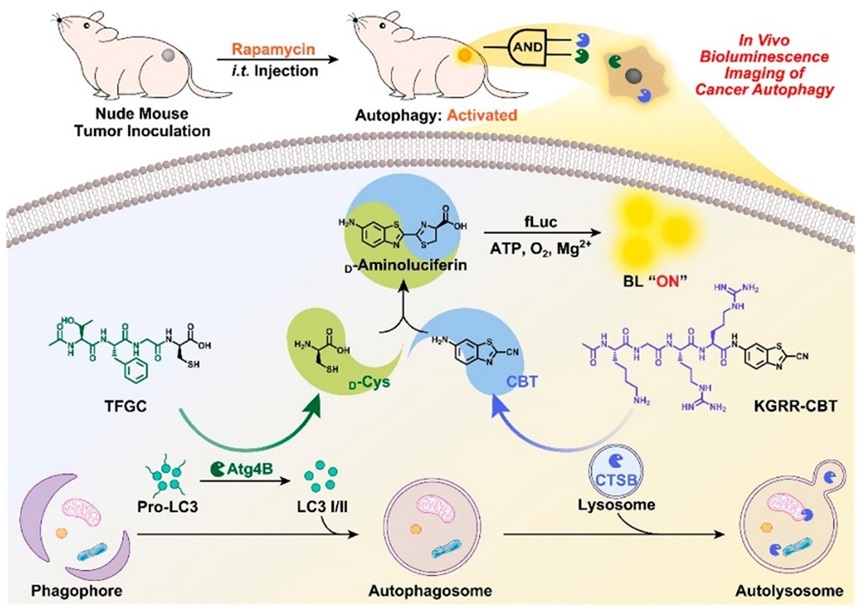
图8. Atg4B和CTSB触发的荧光素原位形成用于癌症自噬的精准生物发光成像示意图。
更多详细信息请参考课题组官网:https://bme.seu.edu.cn/lianglab/
此外,课题组欢迎热爱科研并对相关研究方向感兴趣的同学联系报考硕士、博士及博士后岗位。

图9. 梁高林教授课题组成员
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号