耿轶群课题组Nat Commun:热蛋白质组学揭示糖代谢产物果糖-1,6-二磷酸作为磷酸化供体激活代谢酶PGAM1
糖代谢重编程被视为多种疾病的标志(Nat. Rev. Cancer 2016, 16, 635-649)。在肿瘤细胞中,为了支持生物分子的组装、能量的产生以及维持细胞的氧化还原稳态,糖酵解代谢通量显著上调(Warburg effect)(Science 2009, 324, 1029-1033)。多项证据表明,糖代谢过程中的代谢产物可以作为信号分子,通过与关键蛋白相互作用来调节各种生物学事件和细胞命运。因此,深入解析糖代谢产物信号传递机制对于理解糖代谢重塑在人类生理和疾病中的作用至关重要。糖酵解代谢产物果糖-1,6-二磷酸(FBP)已被报道能够作为代谢信号分子来调节多种生理、病理过程。尽管科学家们在鉴定FBP特异性互作蛋白方面已经取得了显著进展,但对其互作网络的系统鉴定及分子机制的深入解读仍然存在挑战。
在前期工作中,中国医学科学院药物研究所/天然药物及核药基础与新药创制全国重点室耿轶群课题组,利用光亲和探针和定量化学蛋白质组学策略,在活细胞中系统鉴定了FBP的互作蛋白,并且解析了存在于线粒体途径的由FBP及其互作蛋白ALDH2介导的葡萄糖代谢感知与信号传递机制(J. Am. Chem. Soc. 2024, 146, 15155−15166)。近日,该团队再次取得突破性进展,联合北京大学药学院天然药物及仿生药物全国重点实验室黎后华课题组在Nat. Commun.上发表研究论文,采用热蛋白组学技术(Thermal proteome profiling, TPP)系统鉴定了HepG2细胞中FBP的互作蛋白组,并详细阐述了FBP作为磷酸化供体激活代谢酶磷酸甘油酸变位酶1(PGAM1),从而正反馈糖酵解代谢途径并支持Warburg效应和细胞增殖的分子机制。
首先,作者通过TPP结合二甲基化标记的定量质谱分析,成功鉴定了66个高置信度的FBP互作蛋白(图1 a-c)。对这66个蛋白的生物信息学分析显示,它们在功能上涉及运输、代谢过程、核糖核蛋白、转录和翻译等多个方面,并定位于细胞质、细胞核等多种亚细胞器中(图1 d)。KEGG分析进一步表明,FBP参与多种途径,如翻译、糖酵解、核糖体小亚基生物合成等(图1 e)。
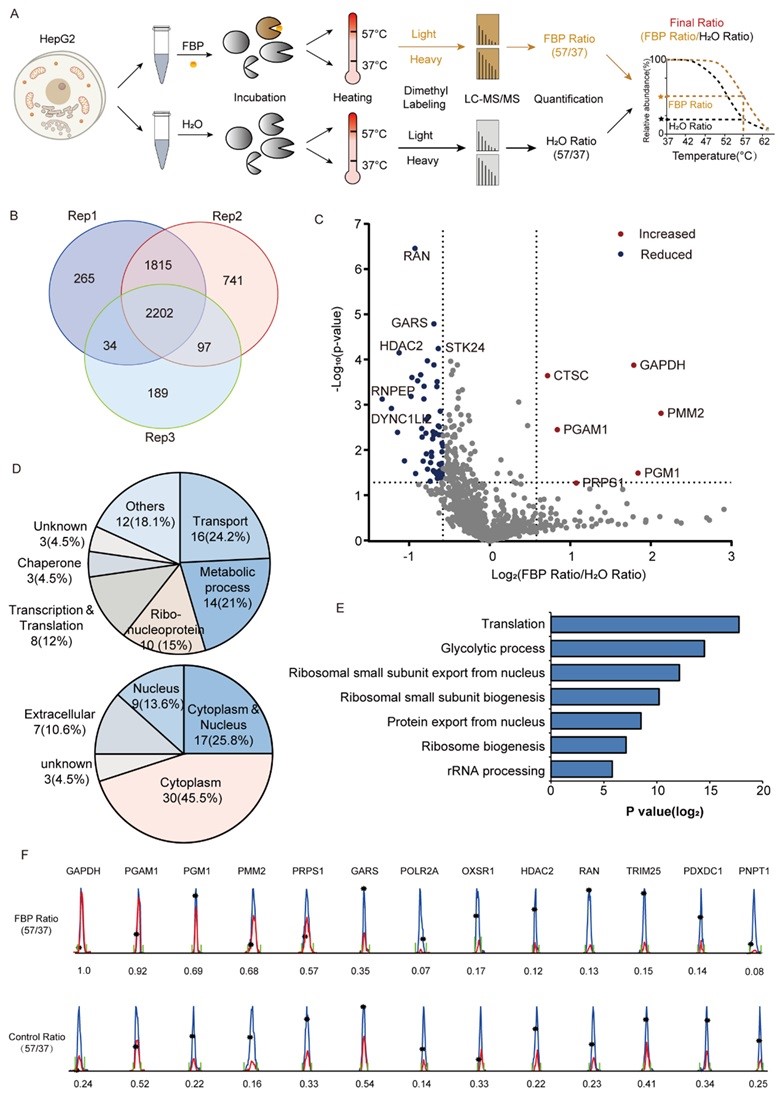
图1. FBP相互作用蛋白的热蛋白质组分析
在鉴定到的FBP互作蛋白中,作者发现25个蛋白参与磷酸转移或识别,26个是ATP/GTP或DNA/RNA结合蛋白。同时,33%的热稳定性降低的FBP互作蛋白和83%的热稳定性增加的FBP互作蛋白都参与磷酸转移催化过程。特别是糖代谢酶PGAM1、PGM1和PMM2,它们通过相似的“乒乓”机制实现磷酸糖的相互转化。因此,作者重点研究了FBP如何与这些磷酸转移相关酶相互作用并调节其功能。通过酶活性测定和微量热涌动(MST)分析,作者发现FBP能够激活PGAM1,而抑制PGM1和PMM2活性(图2 a-b)。作为糖酵解代谢产物,FBP可被ALDOA裂解为甘油醛-3-磷酸(G3P)和二羟丙酮磷酸(DHAP),同时也是PKM2的变构激活剂。然而,关于FBP是否能干扰或参与代谢酶的磷酸转移过程,此前未见报道。已知PGAM1可被辅因子2,3-二磷酸甘油酸(2,3-BPG)活化,发生活性位点11位组氨酸磷酸化(His11),从而实现糖酵解代谢产物3-磷酸甘油酸(3-PG)与其异构体2-磷酸甘油酸(2-PG)的互变。作者推测FBP可以作为磷酸化供体促使组氨酸被磷酸化而激活PGAM1。通过Phos-tag 凝胶电泳和特异性组氨酸磷酸化抗体免疫印迹分析,作者验证了FBP可以作为供体,磷酸化PGAM1产生3-pHis修饰(图2 c-e)。LC-MS/MS分析进一步确认了FBP磷酸化PGAM1的位点位于其活性稳点His11(图2 f)。FBP不能活化PGAM1-H11A突变体,表明His11磷酸化是FBP激活PGAM1的关键(图2 g)。
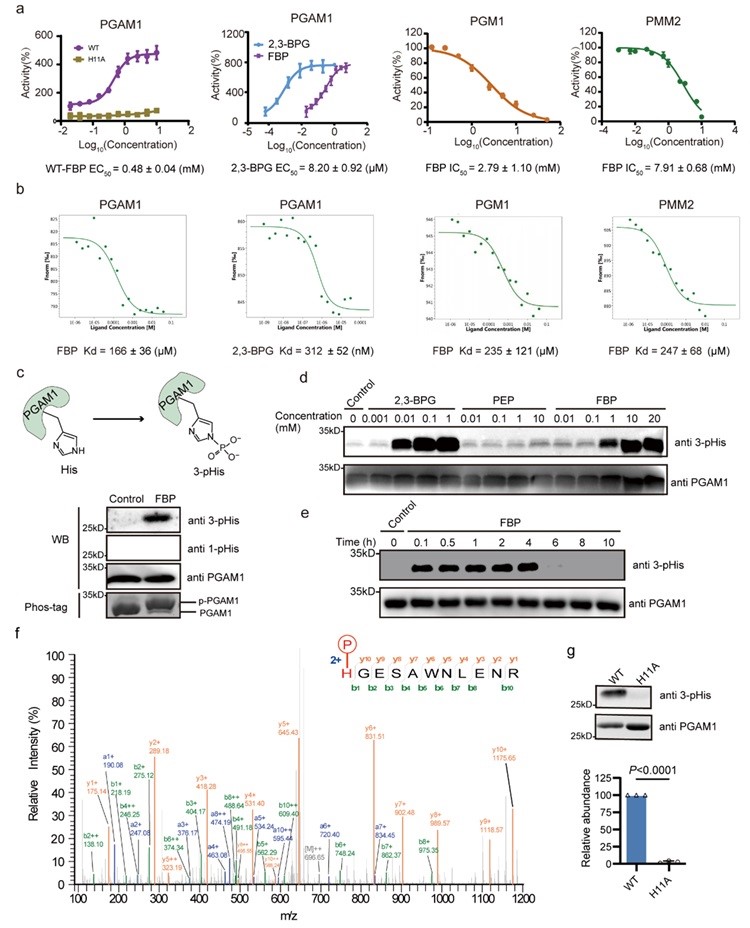
图2. FBP磷酸化His11进而激活PGAM1
为了深入了解FBP-PGAM1互作的分子机制,作者通过分子对接发现FBP可以转移C1-O-磷酸或C6-O-磷酸至His11的N3位来活化PGAM1(图3 c)。这与LC-MS/MS分析FBP-PGAM1互作时生成单磷酸糖代谢产物F6P和F1P的结果相一致(图3 a-b)。作者还对参与FBP-PGAM1互作的关键氨基酸残基进行了定点突变,并通过免疫印记和MST分析验证了这些突变对FBP-PGAM1结合和组氨酸磷酸化的影响(图3 d)。同时,作者还进行了分子动力学模拟以研究FBP磷酸化PGAM1的动态过程(图3 e)。
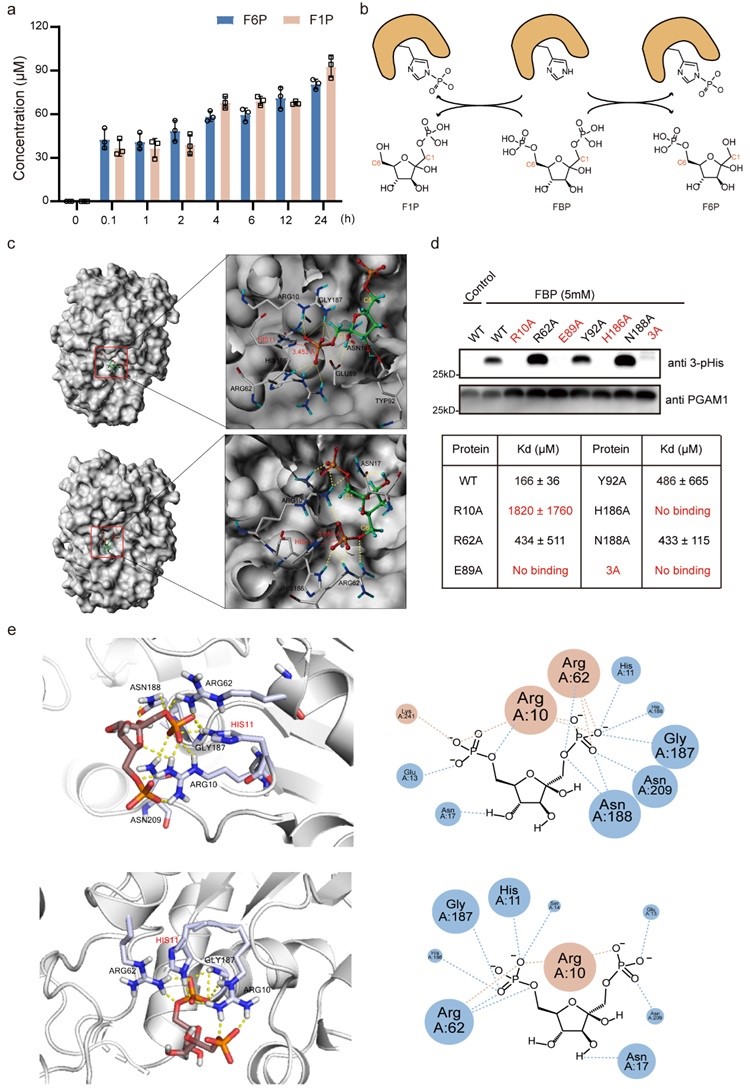
图3. FBP-PGAM1互作的分子机制
为了进一步证明FBP通过磷酸转移激活PGAM1的特异性,作者测试了多种内源性磷酸糖骨架的代谢产物,发现只有FBP或2,3-BPG才能作为磷酸供体形成3-pHis修饰而激活PGAM1(图4 a-c)。作者还设计并合成了一系列FBP类似物用于构效关系(SAR)研究,发现这些类似物失去了对PGAM1的磷酸化能力并呈现出抑制酶活效果(图4 d-g)。这表明FBP-PGAM1互作是特异性的,包括双磷酸和果糖骨架在内的整个FBP结构都是PGAM1磷酸化所必需的。
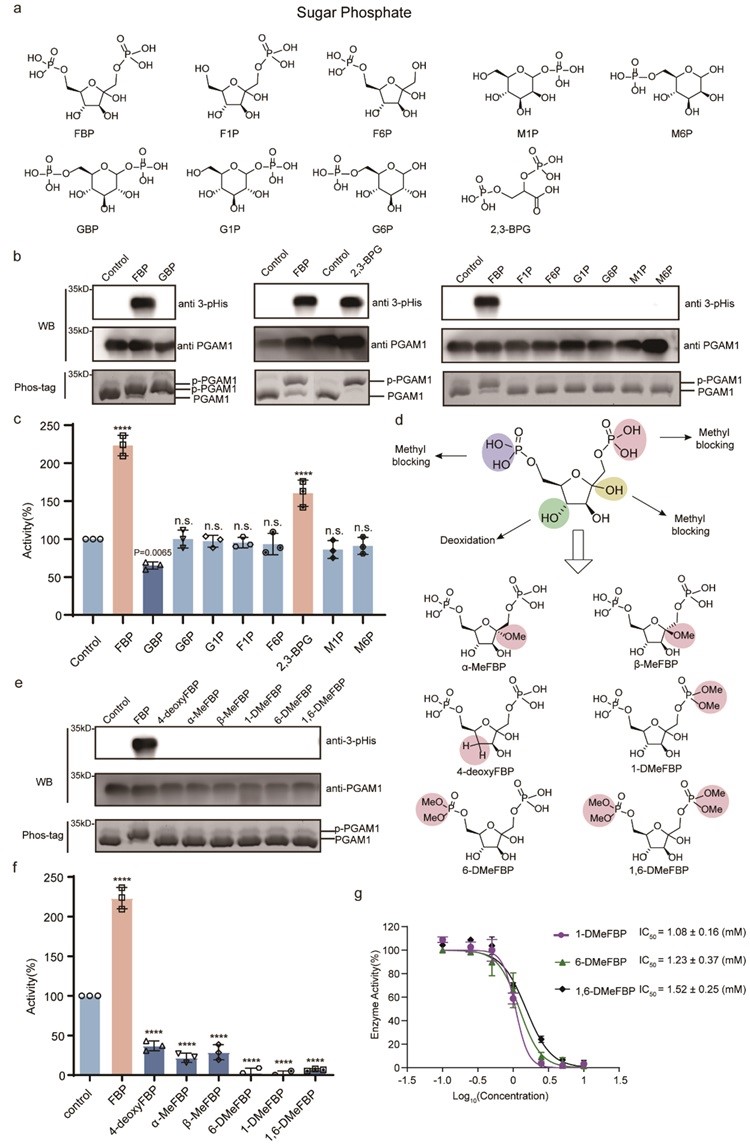
图4. FBP-PGAM1互作的构效关系研究
接下来,作者研究了活细胞中FBP激活PGAM1的表型。结果表明,FBP外源处理的HepG2细胞中FBP水平上调,PGAM1的组氨酸磷酸化表现出剂量依赖性,同时2-PG/3-PG比值增加,乳酸生成和葡萄糖消耗增加,糖酵解被正反馈,细胞增殖显著上调。敲除PGAM1后,FBP作用消除,表明FBP通过激活其下游代谢酶PGAM1正反馈糖酵解和促进癌细胞增殖。此外,设计合成的PGAM1类似物1-DMeFBP、6-DMeFBP和1,6-DMeFBP均被发现能够抑制细胞增殖。其中,1-DMeFBP对HepG2细胞增殖的抑制作用最强。
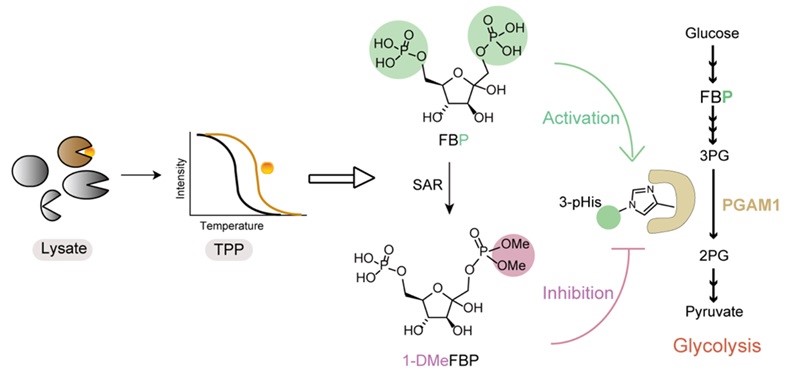
综上所述,作者通过热蛋白质组学系统鉴定了FBP互作蛋白组,揭示了FBP作为磷酸化供体激活PGAM1支持Warburg效应和肿瘤细胞增殖的化学信号传导作用。在分子水平,FBP通过转移其C1-O-磷酸或C6-O-磷酸至PGAM1活性位点His11的N3位,形成3-pHis修饰,激活PGAM1。作者还基于FBP结构设计合成了一系列类似物用于SAR研究,并发现了能够抑制PGAM1磷酸化和肿瘤细胞增殖的PGAM1正构抑制剂。这些发现为理解糖代谢重塑在人类疾病中的作用以及开发新的抗肿瘤药物提供了线索。
中国医学科学院药物研究所耿轶群课题组助理研究员张艳玲和博士后曹亚飞为该论文的共同第一作者。耿轶群研究员、张艳玲博士和北京大学药学院黎后华研究员为该论文的共同通讯作者。北京大学药学院博士研究生吴霞,药物所博士研究生陈征辉、王安慧等为该研究做出了重要贡献。该工作得到了国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程、北京市教委-自然科学基金联合项目、中国医学科学院中央级公益性科研院所基本科研业务费、北京协和医学院中央高校基本科研业务费等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Thermal proteome profiling reveals fructose-1,6-bisphosphate as a phosphate donor to activate phosphoglycerate mutase 1
Yanling Zhang1*, Yafei Cao1, Xia Wu, Zhenghui Chen, Bowen Chen, Anhui Wang, Yanshen Guo, Wei Chen, Ruolan Xue, Zihua Liu, Yuanpei Li, Tian Li, Ruiqin Cheng, Ning Zhou, Jing Li, Yuan Liu, Xiaohui Zhao, Huixin Luo, Ming Xu, Houhua Li* and Yiqun Geng*
Nat. Commun., 2024, 15, 8936. DOI: 10.1038/s41467-024-53238-w
导师介绍
耿轶群
https://www.x-mol.com/university/faculty/385335
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号