北大雷晓光团队与合作者Cell:人体内源“天然产物”胆酸介导系统性瘙痒的分子机制
2024年10月29日,北京大学雷晓光课题组与合作者北京大学李毓龙课题组及首都医科大学附属北京佑安医院陈煜课题组在国际权威期刊Cell 在线发表了题为“Structure-guided discovery of bile acid derivatives for treating liver diseases without causing itch”的开拓性研究成果,系统地揭示了人体内源“天然产物”分子胆酸诱导胆汁淤积瘙痒的分子机制,并且开发出针对多种肝胆疾病具有良好治疗效果且不存在瘙痒副作用的先导药物分子。

图1. 人体内源的胆酸分子
瘙痒自古以来便为人们所关注,苏东坡曾感慨“忍痛易,忍痒难”,生动表达了瘙痒所带来的痛苦。现代医学已表明,组胺依赖的急性瘙痒,如过敏或蚊虫叮咬等,可通过抗组胺类药物有效缓解。然而,非组胺依赖的全身性慢性瘙痒却无法通过这种药物进行治疗,因而困扰了大量慢性瘙痒患者。胆酸是一类重要的人体内源次生代谢产物,是人体内的“天然产物”(图1)。这类分子具有至关重要的生理功能,主要参与脂肪的消化吸收和胆固醇的代谢调节。胆酸通过肠肝循环不断再利用,维持着机体的代谢平衡。然而,当胆汁流动受阻,发生胆汁淤积时,胆酸无法正常代谢并在体内积累,导致约80%的胆汁淤积患者出现严重的慢性瘙痒,极大地影响其生活质量。迄今为止,导致胆汁淤积瘙痒的分子机制仍不明确,且缺乏有效的治疗药物。
北京大学雷晓光课题组长期致力于天然产物化学生物学研究与基于天然产物的新药创制,利用合成化学、化学生物学等多学科交叉的策略,揭示天然产物、天然药物分子的靶标和活性机制。他们在前期研究中利用活性天然产物分子阐明了多个调控程序性细胞死亡的重要药物靶标和分子机制(Acc. Chem. Res., 2020, 53, 1034-1045,点击阅读详细)。近期,他们与合作者发现了来源于肠道共生细菌的DPP4酶可以促进二型糖尿病的发生;进一步通过高通量药物筛选和后期药物化学开发,获得了靶向菌源DPP4酶的特异性天然产物小分子抑制剂,并且在多种动物模型上证明了其有效治疗二型糖尿病的效果(Science, 2023, 381, eadd5787,点击阅读详细)。
从2014年起,雷晓光团队开始拓展天然产物化学生物学中新的研究方向:发现人体内源天然产物未知的生理学、病理学功能与分子机制。他们聚焦在人体胆汁酸分子的研究。首先通过设计开发多种胆汁酸分子探针,利用化学蛋白质组学手段,系统地揭示了超过500个之前未知的胆汁酸结合蛋白,为后期研究提供了工作基础(ACS Cent. Sci., 2017, 3, 501-509)。之后,他们与李毓龙课题组合作,初步阐明了人体特有的G蛋白偶联受体:MRGPRX4是胆汁酸分子新的内源受体,并且可能与胆汁酸介导的系统性瘙痒密切相关(eLife, 2019, 8, e48431)。但是以上的研究还存在三个没有完整回答的关键科学问题:(1)在胆汁淤积瘙痒病人体内,究竟是哪些特定形式的胆汁酸分子主要造成了瘙痒?(2)这些胆汁酸分子究竟如果激活“痒受体”MRGPRX4?(3)这些科学发现究竟能否指导我们开发创新药物来治疗瘙痒?在这三个核心问题的指引下,他们开展了新的合作研究。
首先,雷晓光课题组与北京佑安医院陈煜医生团队合作,收集到数十例有瘙痒症状或无明显瘙痒症状的胆汁淤积病人血浆样本。研究者通过分析这些病人血浆中的28种不同胆酸成分,发现在伴有瘙痒症状的胆汁淤积患者中,一种包含了特殊修饰的3位羟基磺酸化胆酸(BA-3S)含量显著高于无瘙痒症状的患者(图2)。这种修饰主要发生在肝脏中,用于增强胆酸的水溶性从而利于排出体内,是胆汁淤积病人自我调节的一种方式。本研究中的发现表明,这类磺酸化修饰的胆酸很可能也与胆汁淤积病人的瘙痒症状有着密切的联系,有望将其作为一种新的生物标志物,用于预测和监测瘙痒的发生。那么,磺酸化修饰后的胆酸是如何导致胆汁淤积病人产生瘙痒症状的呢?

图2. 3位羟基磺酸化修饰胆酸在伴有胆汁淤积瘙痒的病人血浆中显著升高
接下来,研究者针对这一分子机制展开了详细的研究。早在2019年,研究人员已经发现,胆酸是表达在人类背根神经节中的G蛋白偶联受体MRGPRX4(hX4)的内源性配体,能够通过激活hX4导致瘙痒(eLife, 2019, 8, e48431; PNAS, 2019, 116, 10525-10530)。研究者怀疑,是不是磺酸化后的胆酸对于hX4具有更强的亲和力,从而产生这种更为严重的瘙痒现象?为了证明这一点,研究者测试了不同修饰类型的胆酸对于hX4的激活活性,结果表明胆酸的3位羟基(3-OH)对于激活hX4具有非常重要的作用,其被磺酸化修饰后显著提高了亲和力,被氧化后则显著降低了激活活性。接着,为了证实这种亲和力的增强能够导致瘙痒的症状,雷晓光课题组与北京大学李毓龙课题组合作,构建了hX4人源化大鼠的动物模型,用于研究瘙痒症状。研究者选择对hX4激活活性最强的DCA和DCA-3S进行验证,结果表明这两种胆酸都能够导致人源化大鼠产生瘙痒症状,并且DCA-3S能够产生更为严重的瘙痒(图3)。那么磺酸化修饰是如何增强胆酸对于hX4的亲和力的呢?

图3. 3位羟基磺酸化修饰能够增强对hX4的亲和力导致更严重的瘙痒症状
研究者尝试利用冷冻电镜技术解析DCA-3S与hX4的复合物结构,然而尽管做了大量的尝试,但都无法成功获得复合物结构,他们推测可能是DCA-3S的亲和力依然不足导致的。在2021年,Bryan课题组首次解析了hX4与外源性配体的复合物结构,他们发现hX4的配体结合口袋包含了丰富的带正电氨基酸(Nature, 2021, 600, 170-175)。因此,研究者推测磺酸化胆酸活性的提高可能与磺酸基团携带了一个负电荷有关。基于此,研究者做了大胆的推测:进一步增加其携带的电荷数或许能够进一步提升亲和力。因此,他们将磺酸基团换成了携带两个负电荷的磷酸基团,人工合成了3位磷酸化修饰胆酸DCA-3P。非常惊喜的是,这种磷酸化修饰确实将其亲和力提升了近十倍。利用DCA-3P,研究者成功解析了胆酸类化合物与hX4的复合物结构,首次揭示了胆酸是如何激活hX4的分子机制。更有趣的是,DCA-3P所结合的口袋与目前所报道的其余MRGPRX家族受体小分子的结合口袋都不一样。其余的小分子都结合在MRGPRX家族更靠近溶剂的部分,而DCA-3P则以垂直的方式地结合在hX4内部(图4)。值得一提的是,在他们获得这个cryo-EM复合物结构之前,也曾尝试过利用AlphaFold和分子动力学模拟的方式去解释胆酸与hX4的结合机制,然而预测的结果表明DCA-3P结合位置与所报道的其他分子类似结合在更靠近溶剂的部分,与实验解析出来的结果完全不同,这也进一步证实一定程度上预测的模型与实际结果依旧存在着较大差距。
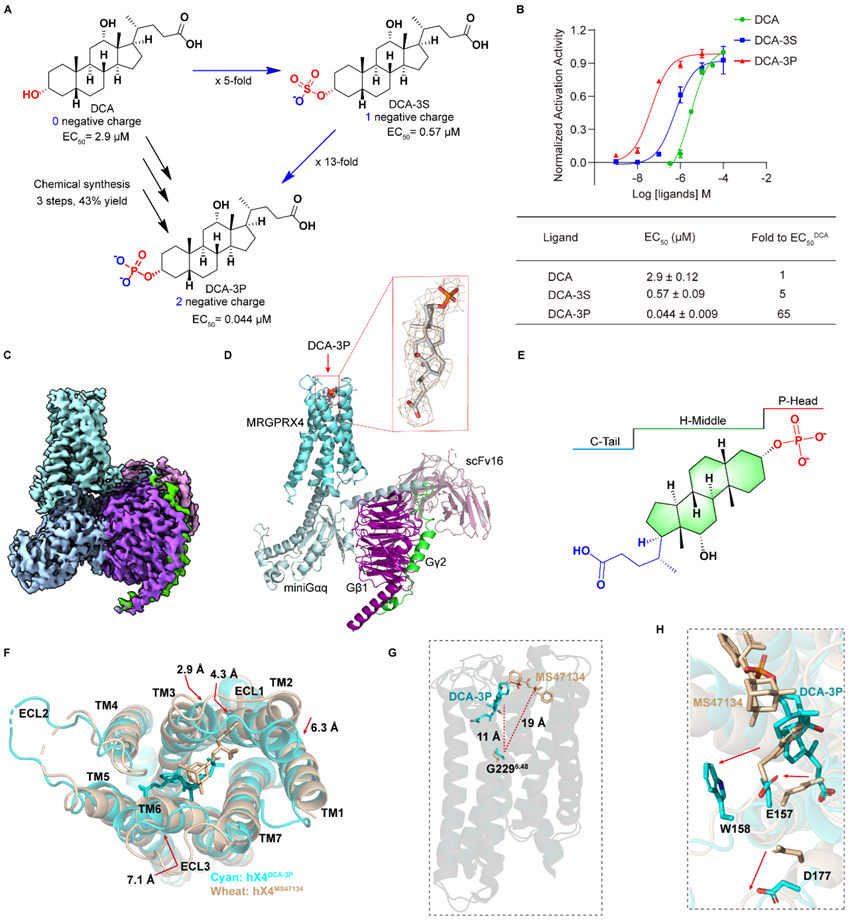
图4. DCA-3P与hX4的cryo-EM复合物结构
在对胆酸和瘙痒机制进行深入研究的同时,研究者也同时关注到现有临床药物奥贝胆酸(OCA)在治疗过程中的瘙痒副作用。OCA是一种强效的法尼醇X受体(FXR)激动剂,广泛用于治疗原发性胆汁性胆管炎(PBC)。然而,其剂量依赖性的瘙痒副作用限制了OCA在临床中的广泛应用。由于OCA也是胆酸类似物,并且同样包含了至关重要的3位羟基基团,因此,研究者推测其产生瘙痒的副作用可能也是通过激活hX4来实现的。研究者进一步从分子、动物、人体等多方位的角度证实,OCA确实可以激活hX4并且在人源化大鼠模型,甚至人体上产生剂量依赖性的瘙痒症状。因此,OCA导致瘙痒副作用的靶点确实就是hX4(图5)。

图5. OCA通过激活hX4导致瘙痒副作用
在证实了OCA的副作用靶点后,是否能够基于前期的机制研究,改造OCA使其保留治疗活性的同时避免瘙痒的副作用呢?基于对胆酸激活hX4机制的深入理解,研究团队对OCA进行了精准的结构改造,去除了其激活hX4所必需的3-OH基团,成功获得了化合物C7。令人惊喜的是,通过细胞水平的实验证实,C7失去了激活hX4的能力但保留了对FXR的激活活性(图6)。进一步通过人源化大鼠动物模型验证,发现化合物C7并不会使人源化大鼠产生瘙痒的症状(图6)。这也就说明,基于胆酸激活hX4的分子机制,非常精准地使得OCA丧失了原本导致瘙痒的活性。

图6. 基于结构对OCA进行改造产生的化合物C7丧失了导致瘙痒的功能
作者进一步研究了C7在肝脏相关疾病中的治疗作用。研究发现,C7在胆汁淤积和非酒精性脂肪性肝炎(NASH)模型中展现出强大的肝保护作用和抗纤维化潜力。在α-萘基异硫氰酸酯(ANIT)诱导的胆汁淤积大鼠模型中,C7有效下调了与胆汁酸合成和炎症相关的基因表达,显著改善了胆汁分泌,减少了血清总胆红素、ALT和AST水平,并缓解了肝实质坏死和炎症细胞浸润。在胆管结扎(BDL)模型中,C7进一步减少了胆汁淤积引发的纤维化。在TAA诱导的NASH模型中,C7下调了纤维化和脂肪生成相关基因的表达,减少了肝脏损伤及纤维化,表现出显著的抗炎和抗纤维化功效。这些研究表明,C7有望成为治疗胆汁淤积和NASH等肝病的创新药物。
综上所述,本研究工作围绕胆汁淤积瘙痒和肝病治疗新策略两个方面展开了非常系统的研究(图7)。第一个方面,从临床样本出发,结合高分辨质谱发现3位羟基磺酸化修饰胆酸在瘙痒胆汁淤积病人体内显著升高,它们能够通过增强对hX4的激活活性从而导致更为严重的瘙痒症状。此外,利用冷冻电镜技术,解析了hX4与胆酸类似物的复合物结构,详细阐明了胆酸3-OH对于激活hX4的重要作用。第二个方面,研究者针对OCA在临床上导致瘙痒副作用开展了一系列的机制和分子改造研究。首先证实OCA通过激活hX4导致瘙痒副作用,接着根据发现的胆酸激活hX4的分子机制,精准地对OCA进行化学改造,成功地获得了避免瘙痒副作用且保留肝病治疗活性的新一代先导药物分子C7,为临床肝病治疗提供了全新的可能性,有望彻底解决OCA在临床上应用中遇到的瘙痒副作用难题。

图7. 相关研究的综述
雷晓光教授构思了最初概念并启动该项研究,并与李毓龙教授管理整个研究项目。北京大学雷晓光教授、李毓龙教授,首都医科大学附属北京佑安医院陈煜教授为论文的共同通讯作者。北京大学雷晓光课题组博士研究生杨军、李毓龙课题组赵天军博士、雷晓光课题组范俊萍博士和陈煜课题组邹怀宾博士为该论文的共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金委员会、北京分子科学国家研究中心、北大-清华生命科学联合研究中心、北京市“卓越青年科学家计划”、新基石基金会科学探索奖等项目和单位的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure-guided discovery of bile acid derivatives for treating liver diseases without causing itch
Jun Yang, Tianjun Zhao, Junping Fan, Huaibin Zou, Guangyi Lan,∙ Fusheng Guo, Yaocheng Shi, Han Ke, Huasheng Yu, Zongwei Yue, Xin Wang, Yingjie Bai, Shuai Li, Yingjun Liu, Xiaoming Wang, Yu Chen*, Yulong Li*, Xiaoguang Lei*
Cell, 2024, DOI: 10.1016/j.cell.2024.10.001
导师介绍
李毓龙
https://www.x-mol.com/university/faculty/229339
雷晓光
https://www.x-mol.com/groups/leigroup
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






































 京公网安备 11010802027423号
京公网安备 11010802027423号