ACS Nano | 多功能仿生纳米平台用于结肠癌的多模式精准治疗
英文原题:A Multifunctional Biomimetic Nanoplatform for Dual Tumor Targeting-Assisted Multimodal Therapy of Colon Cancer

通讯作者:万昊(南昌大学);梁永晔(南方科技大学);万益群(南昌大学)
作者:Xin Wan#, Ying Zhang#, Yiqun Wan*, Mengmeng Xiong, Anqi Xie, Yongye Liang*, Hao Wan*
结肠癌是一种常见的消化道恶性肿瘤,对人类健康构成重大威胁。其治疗方法主要有手术切除、化疗、放疗及免疫疗法等,但由于结肠癌的高转移率、高复发性以及多耐药性,患者往往预后不佳,且单一治疗方式的疗效并不能满足临床需求。因此,研究开发新的治疗方式进一步提高结肠癌的治疗效果很有必要。构建多功能的仿生纳米材料并用于联合治疗癌症已受到广泛关注。近期,南昌大学万昊教授(点击查看介绍)、南方科技大学梁永晔教授(点击查看介绍)和南昌大学万益群教授(点击查看介绍)等人在ACS Nano 期刊发表了“A Multifunctional Biomimetic Nanoplatform for Dual Tumor Targeting-Assisted Multimodal Therapy of Colon Cancer”研究性论文,该研究以结肠癌为研究对象,合理设计并开发了集双重肿瘤靶向、增强光热效应、pH响应性Ca2+释放、诱导抗肿瘤免疫反应和免疫抑制分子阻滞等多功能于一体的仿生纳米材料Fe3O4@PDA@CaCO3-ICG@CM,从细胞及动物层面,系统地评估了所制备的多功能仿生纳米材料对结肠癌的治疗效果及其作用机制,取得了较好的效果。
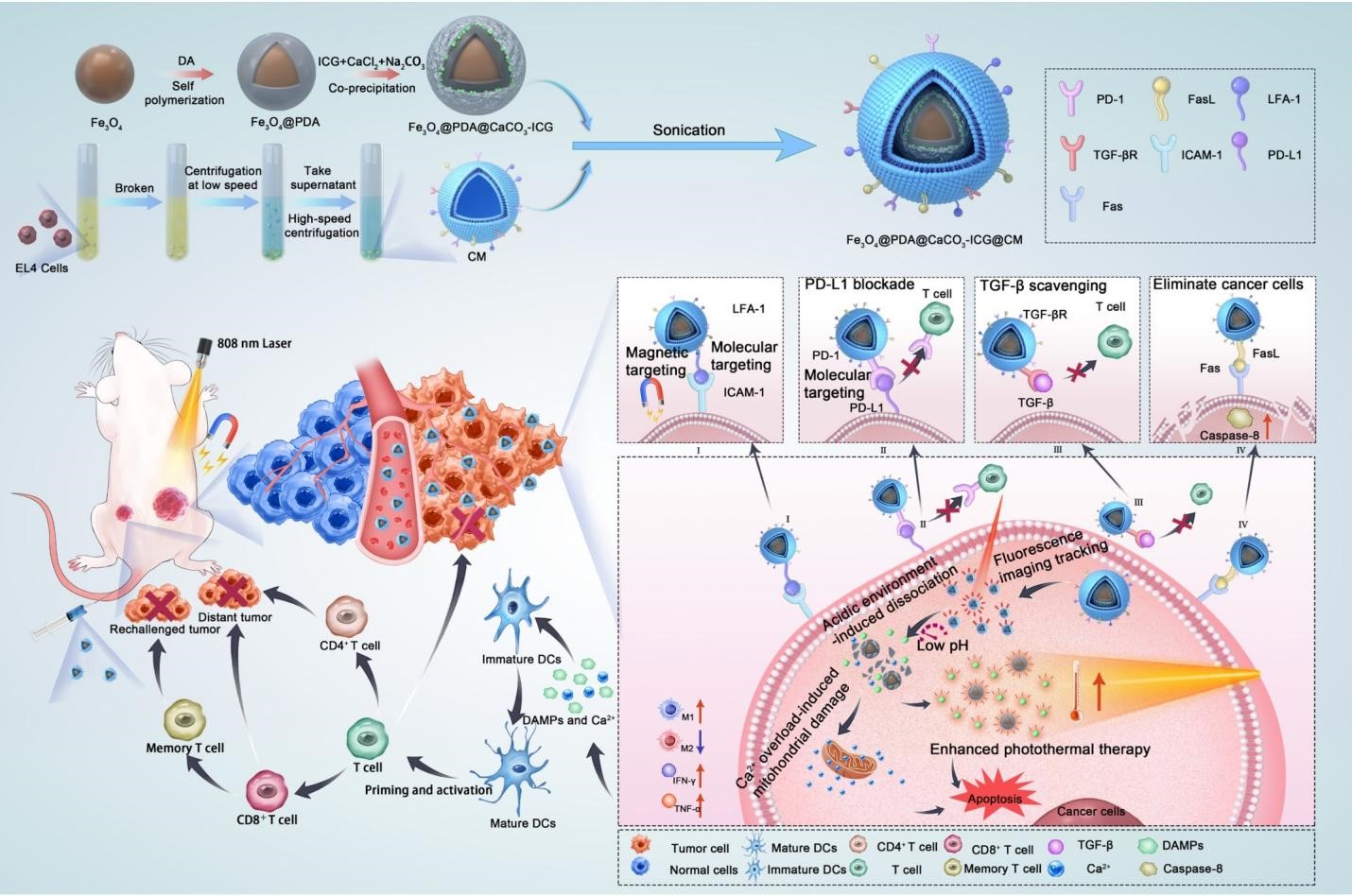
图1. Fe3O4@PDA@CaCO3-ICG@CM制备过程及治疗结肠癌小鼠的示意图
本文亮点与重点
(1)以Fe3O4为核心,在碱性条件下引发聚合反应,使聚多巴胺(PDA)包覆在Fe3O4表面,形成核-壳结构的Fe3O4@PDA;随后通过静电吸附,将吲哚菁绿(ICG)吸附在Fe3O4@PDA表面并将CaCO3矿化在Fe3O4@PDA外层,得到Fe3O4@PDA@CaCO3-ICG;通过超声将提取出的EL4细胞膜(CM)包裹Fe3O4@PDA@CaCO3-ICG,得到Fe3O4@PDA@CaCO3-ICG@CM(图1)。该仿生纳米材料具有优良的光热效应。采用模拟体内肿瘤微环境中的pH实验,证明了其具有pH响应性Ca2+释放行为。通过Fe3O4@PDA@CaCO3-ICG@CM和CM分别与CT26 细胞孵育等处理实验,表明该材料还具有直接杀伤癌细胞、膜蛋白的靶向、阻断免疫抑制分子等功能。
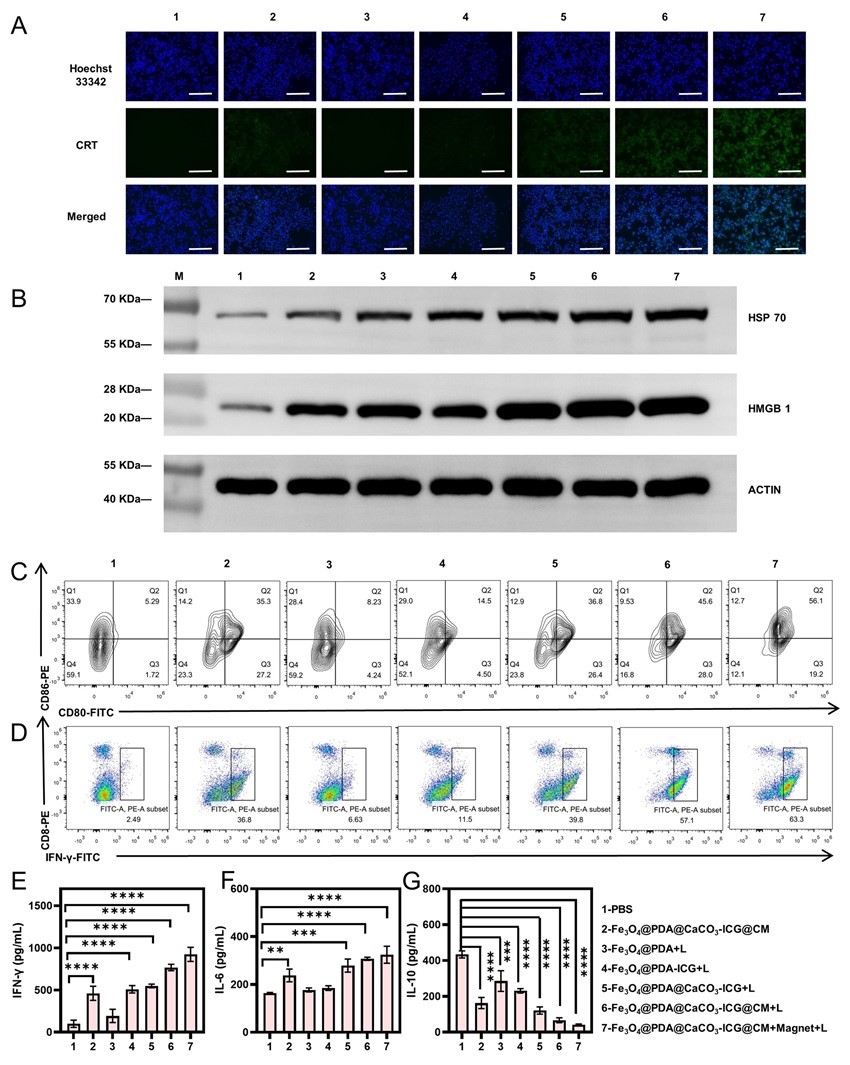
图2. Fe3O4@PDA@CaCO3-ICG@CM引发体外抗肿瘤免疫反应的评估;(A)不同处理后CT26细胞释放CRT的免疫荧光检测;比例尺=275 μm;(B)不同处理后CT26细胞释放HMGB1和HSP70的蛋白免疫印迹分析;(C)不同处理后脾免疫细胞与CT26 细胞上清液共孵育后成熟DCs标志物CD80/CD86表达水平的流式细胞术分析;(D)不同处理后脾免疫细胞与CT26细胞上清液共孵育后效应T细胞标志物CD4+/CD8+的表达水平的流式细胞术分析;不同处理后脾免疫细胞与CT26细胞上清液共孵育产生(E)IFN-γ、(F)IL-6和(G)IL-10的含量;1: PBS, 2: Fe3O4@PDA@CaCO3-ICG@CM, 3: Fe3O4@PDA+L, 4: Fe3O4@PDA-ICG+L, 5: Fe3O4@PDA@CaCO3-ICG+L, 6: Fe3O4@PDA@CaCO3-ICG@CM+L, 7: Fe3O4@PDA@CaCO3-ICG@CM+Magnet+L。
(2)Fe3O4@PDA@CaCO3-ICG@CM具有良好的生物相容性,能显著抑制CT26结肠癌细胞的增殖和促进细胞凋亡。而且,该仿生纳米材料可激起强大的免疫反应,诱导树突细胞(DCs)成熟,并在成熟DCs作用下激活T细胞。同时,促炎细胞因子IFN-γ和 IL-6水平升高,抗炎细胞因子IL-10水平降低(图2)。
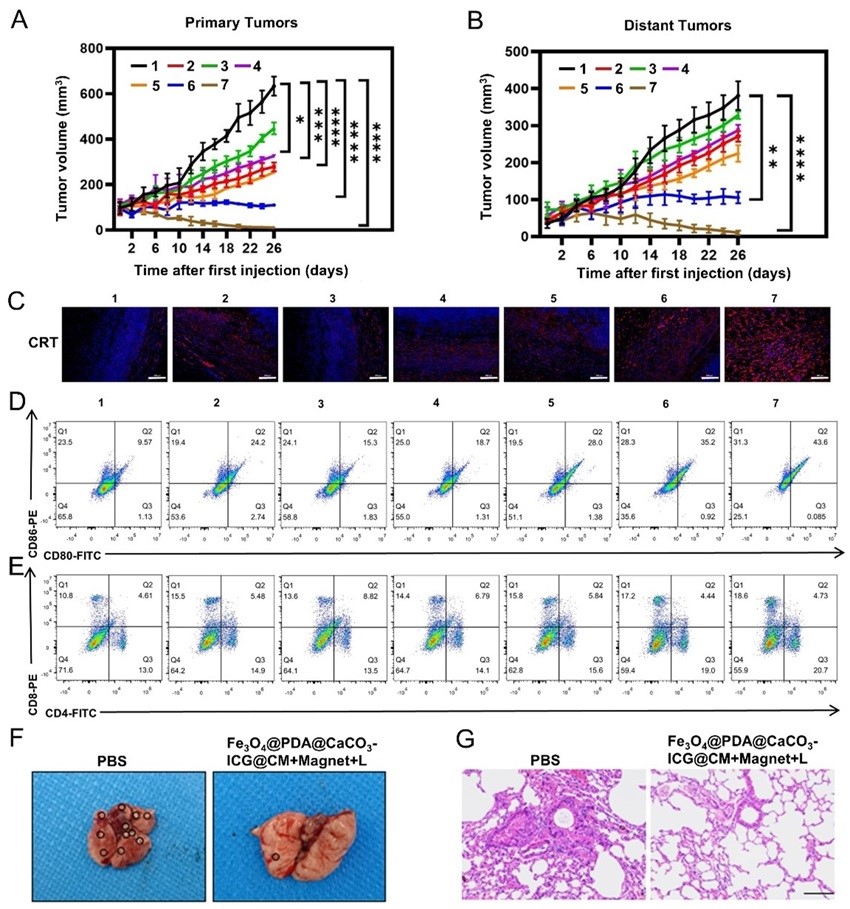
图3.(A)不同治疗组小鼠近端肿瘤体积随时间的变化;(B)不同治疗组小鼠远端肿瘤体积随时间的变化;(C)不同处理后小鼠肿瘤中CRT的免疫荧光染色;比例尺= 100 μm;(D)不同处理后树突状细胞(CD80/CD86)成熟的流式细胞术分析;(E)不同处理后的T细胞活化(CD4+/CD8+)的流式细胞术分析;(F)结肠癌肺转移小鼠经Fe3O4@PDA@CaCO3-ICG@CM在磁铁吸引及激光照射处理后肺组织的代表性图及(G)H&E染色图;比例尺= 100 μm。1: PBS, 2: Fe3O4@PDA@CaCO3-ICG@CM, 3: Fe3O4@PDA+L, 4: Fe3O4@PDA-ICG+L, 5: Fe3O4@PDA@CaCO3-ICG+L, 6: Fe3O4@PDA@CaCO3-ICG@CM+L, 7: Fe3O4@PDA@CaCO3-ICG@CM+Magnet+L。
(3)该仿生纳米材料在细胞膜蛋白PD-1和LFA-1肿瘤靶向能力及Fe3O4介导的磁靶向能力的共同作用下,能更好地积累在肿瘤处,在激光照射下,Fe3O4@PDA@CaCO3-ICG@CM能有效抑制原发性和远处CT26肿瘤的生长,能引起体内强大的免疫反应,促进树突细胞成熟,激活T细胞,可有效实现免疫记忆效应,抑制肿瘤的复发和转移,并实现长期的保护(图3)。
结论
该研究设计了集多种功能于一体的仿生纳米平台,在体内外模型中展现出显著的抗肿瘤和抗复发、转移效果。该研究为结肠癌的治疗提供了新的治疗举措,并展示了多模式协同作用的潜力。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Multifunctional Biomimetic Nanoplatform for Dual Tumor Targeting-Assisted Multimodal Therapy of Colon Cancer
Xin Wan, Ying Zhang, Yiqun Wan*, Mengmeng Xiong, Anqi Xie, Yongye Liang*, Hao Wan*
ACS Nano 2024, 18, 39, 26666-26689
https://doi.org/10.1021/acsnano.4c05773
Published September 19, 2024
Copyright © 2024 American Chemical Society
导师介绍
梁永晔
https://www.x-mol.com/university/faculty/40488
万益群
https://www.x-mol.com/university/faculty/184088
万昊
https://www.x-mol.com/groups/wan_hao
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号