湖南大学黄晋Nano Lett.:可分辨微小pH差异的DNA纳米球用于调节细胞焦亡或凋亡
细胞焦亡作为一种炎症形式的程序性细胞死亡,相较于凋亡,具有更高的治疗潜力和免疫激活作用。设计和合成能够调节细胞程序性死亡模式以提高抗肿瘤疗效的纳米药物是癌症治疗领域的重大挑战。近期,湖南大学化学化工学院黄晋教授(点击查看介绍)团队开发了一种能够分辨不同内体区室微小pH差异的智能DNA纳米球,从而调节细胞焦亡或凋亡。该研究为内体激活纳米药物的设计提供了新的见解,推动了癌症靶向治疗的生物医学应用。
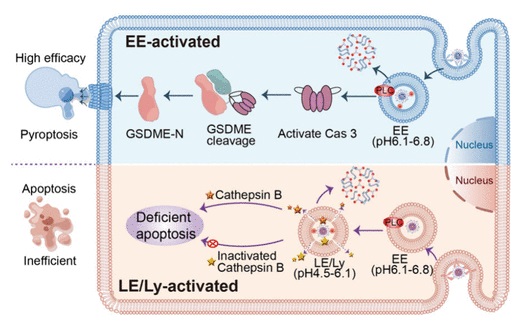
传统的癌症疗法主要通过诱导细胞凋亡的形式来杀伤细胞。然而,许多癌细胞能够逃避细胞凋亡,导致治疗耐药性。细胞焦亡作为一种坏死性和溶解性程序性细胞死亡,因其炎症反应而受到关注。与细胞凋亡相比,细胞焦亡表现出更高的治疗潜力和免疫激活作用,已成为一种有前途的癌症治疗策略。因此,开发具有焦亡可控的靶向、安全、可生物降解的纳米材料至关重要。DNA纳米材料具有尺寸可控、可编程、生物稳定性和生物相容性,已成为精准癌症治疗的优秀载体。本文中,作者设计的智能DNA纳米球(NS),能够通过整合i-motif序列来区分不同内体区室中微小的pH差异,控制NS在特定内体区室产生单线态氧(1O2),从而调控癌细胞发生焦亡或凋亡。
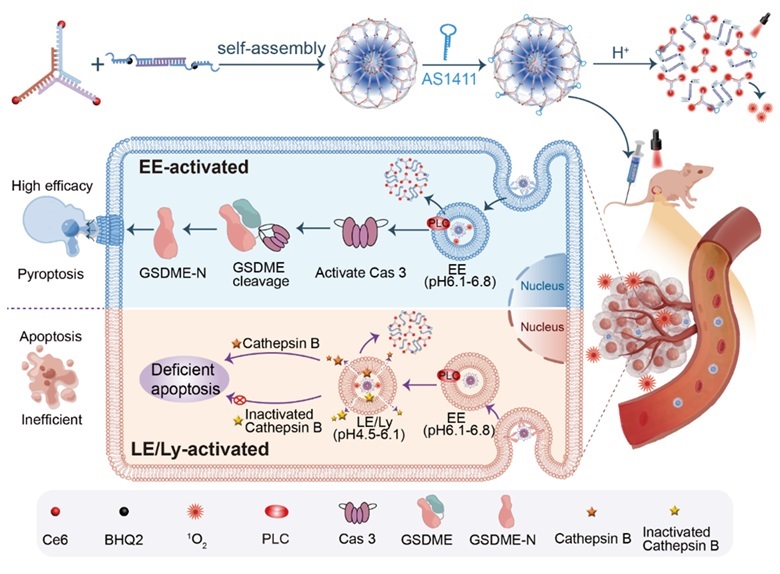
图1. NS的自组装、解组装以及在不同的内吞细胞器中激活诱导细胞焦亡或凋亡的示意图。
如图1所示,NS由两个多功能DNA模块自组装而成,具备肿瘤靶向、酸响应性解离及光动力疗法(PDT)激活功能。通过修改嵌入的i-motif序列,能够设计出可分辨微小pH差异的NS库。利用内体的pH差异,控制NS在早期内体(EE),晚期内体(LE)或溶酶体(Ly)中特异性激活,激光照射下产生单线态氧(1O2)。研究发现,在早期内体(EE)中激活的NS主要诱导细胞焦亡,而在晚期内体和溶酶体(LE/Ly)中激活的NS则诱导细胞凋亡。具体机制为EE产生的1O2激活磷脂酶C(PLC,在EE中高表达),激活焦亡信号通路,高效抑制肿瘤。相反,LE/Ly产生的1O2可激活组织蛋白酶B(Cathepsin B,在LE/Ly中高表达),诱导细胞凋亡,肿瘤抑制作用相对较弱。NS的两步自组装过程组装过程如图2a所示,优化的i-motif序列被合理地编程到L模块中,光敏剂(Ce6)和猝灭剂(BHQ2)分别修饰在Y和L的适当位点。在Y和L组装后,光敏剂通过靠近猝灭剂而被猝灭。琼脂糖凝胶电泳验证了NS的逐步组装过程(图2b)。动态光散射分析显示NS的平均粒径约为155 nm(图2c)。透射电子显微镜(图2d)和扫描电子显微镜(图2e)显示NS呈球形且相对均匀。
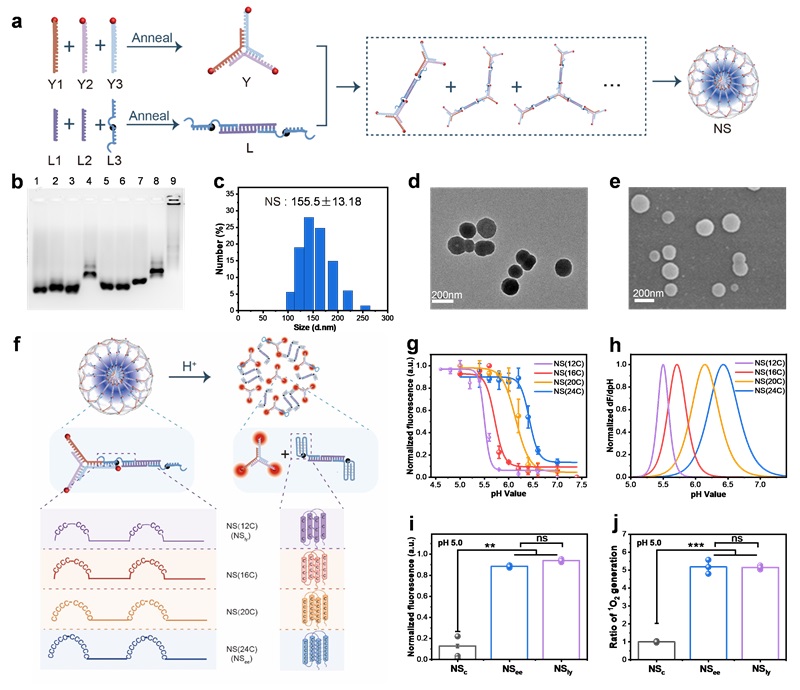
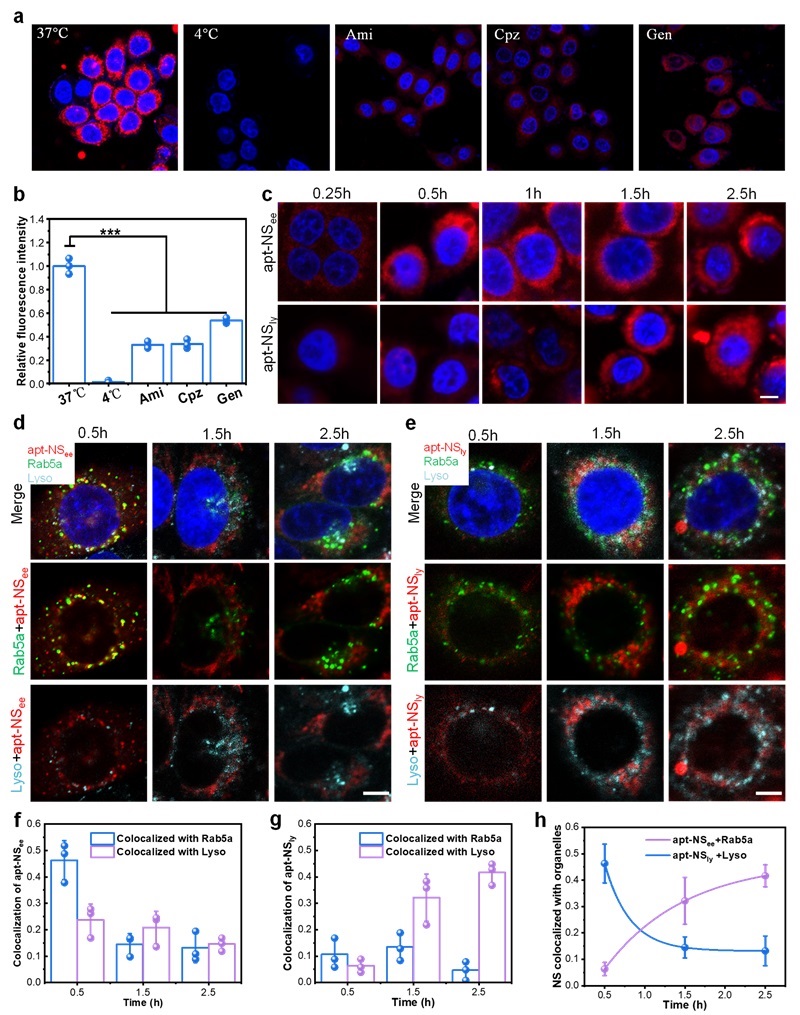
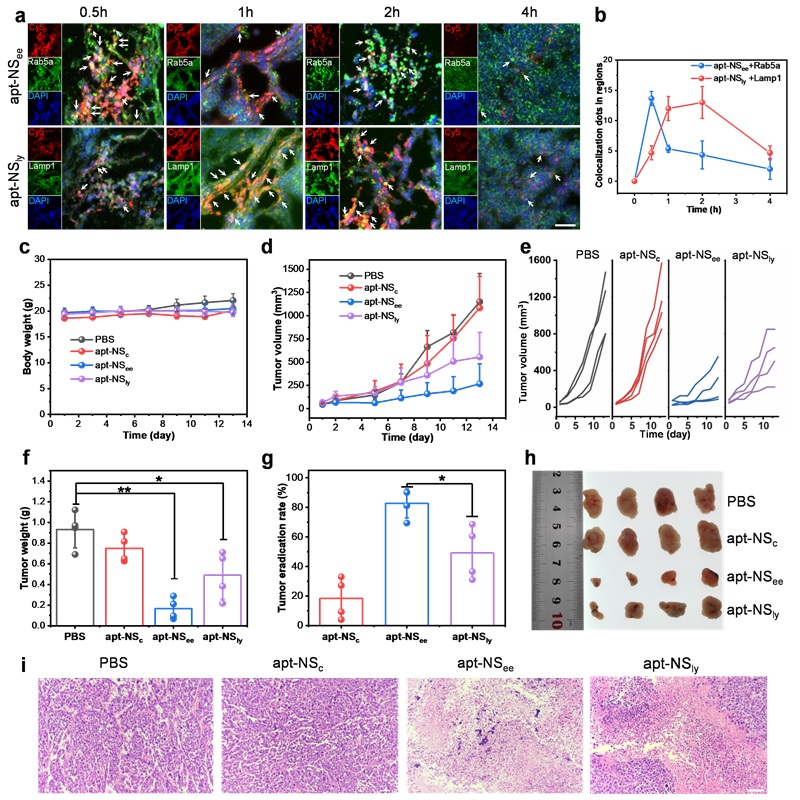
作者首先进行了初步的实验探究了NS在酸性条件下能够形成i-motif结构、解组装、在光照下产生1O2。然后设计了一个小型NS文库,其中i-motif序列包含不同数量的C碱基(图2f)。文库中的NS在pH 7.4时保持荧光“关闭”,而在预先设计的pH范围内分解并触发荧光“打开”(图2g)。结果表明,NS(12C)、NS(16C)、NS(20C)和NS(24C)的pH转变中点(pHt)值分别为5.49、5.71、6.15和6.43(图2h)。由于EE的pH为6.8-6.1,Ly的pH为5.5-4.5,因此分别选择NS(24C)和NS(12C)作为EE激活纳米球(NSee)和Ly激活纳米球(NSly)。并对三种纳米球(NSc、NSee和NSly)进行了荧光恢复和1O2产生分析。结果表明,在酸性条件下,与NSc(对照)相比,NSee和NSly的荧光显著升高,且产生了大量的1O2(图2i和图2j)。这些结果表明NS库已成功制备,NSee和NSly分别被选为EE激活和Ly激活的PDT纳米药物。接下来研究了NS的细胞摄取途径。结果表明,NS的细胞摄取是一个能量依赖性过程,依赖于巨胞饮、网格蛋白介导的内吞和小窝介导的内吞图(图3a和图3b)。内吞途径表明NS可以被内吞到内体中,然后转移到溶酶体。为了验证NS文库能否区分EE和Ly之间微小的pH差异,我们研究了apt-NSee和apt-NSly的活化动力学和内吞细胞器共定位。CLSM图像结果显示,apt-NSee和apt-NSly在MCF-7细胞中开始激活的时间分别约为0.5h和1.5h(图3c)。内吞细胞器共定位分析结果显示,apt-NSee在早期内体(Rab5a)中激活,时间约为0.5h,apt-NSly在溶酶体(Lyso)中激活,时间约为2.5h(图3d-图3h)。以上结果表明NSee和NSly可以分辩EE和Ly,实现精准的细胞器激活。
根据以上实验结果,作者考察了apt-NSee和apt-NSly在不同时间点光照的PDT效果(图4a)。细胞活力和Calcein/PI染色结果显示,apt-NSee比apt-NSly具有更强的细胞杀伤能力(图4b-图4d),apt-NSee和apt-NSly的半抑制浓度(IC50)值显示具有2.73倍的差异,分别为0.64µM和1.75µM(图4b)。这些结果表明,NSee激活的PDT表现出比NSly更高的光细胞毒性。接下来,作者研究了apt-NSee和apt-NSly不同细胞杀伤能力背后的机制。先前的研究表明,EE激活的PDT可以诱导细胞焦亡,而LE/Ly激活的PDT则诱导细胞凋亡。细胞形态观察显示,apt-NSee处理的细胞表现出明显的肿胀,质膜出现气泡、破裂和内容物流出,这是焦亡的典型特征。相反,经apt-NSly处理的细胞表现出皱缩,这是凋亡的特征(图4e)。此外,apt-NSee处理的细胞上清液中的乳酸脱氢酶(LDH)水平显著升高,表明细胞内容物破裂和流出(图4f)。WB分析表明,只有apt-NSee处理的细胞显示GSDME-N片段增加(图4g),这些结果证实了apt-NSee诱导的细胞焦亡。为了探索apt-NSee诱导细胞焦亡的普适性,作者对两种肿瘤细胞系(MCF-7和HepG2)和两种正常细胞系(MCF-10A和L02)进行了类似的研究。用apt-NSee处理的四种细胞显示了不同程度的细胞焦亡特征(图4h)。此外,细胞活力测定表明apt-NSee对肿瘤细胞的杀伤作用大于对正常细胞的杀伤作用(图4i)。原因可能归因于适体靶向性和肿瘤细胞中GSDME的更高表达(图4j)。这些结果表明apt-NSee治疗对正常细胞的毒性较小,可降低全身毒性并提供更有针对性的癌症治疗。
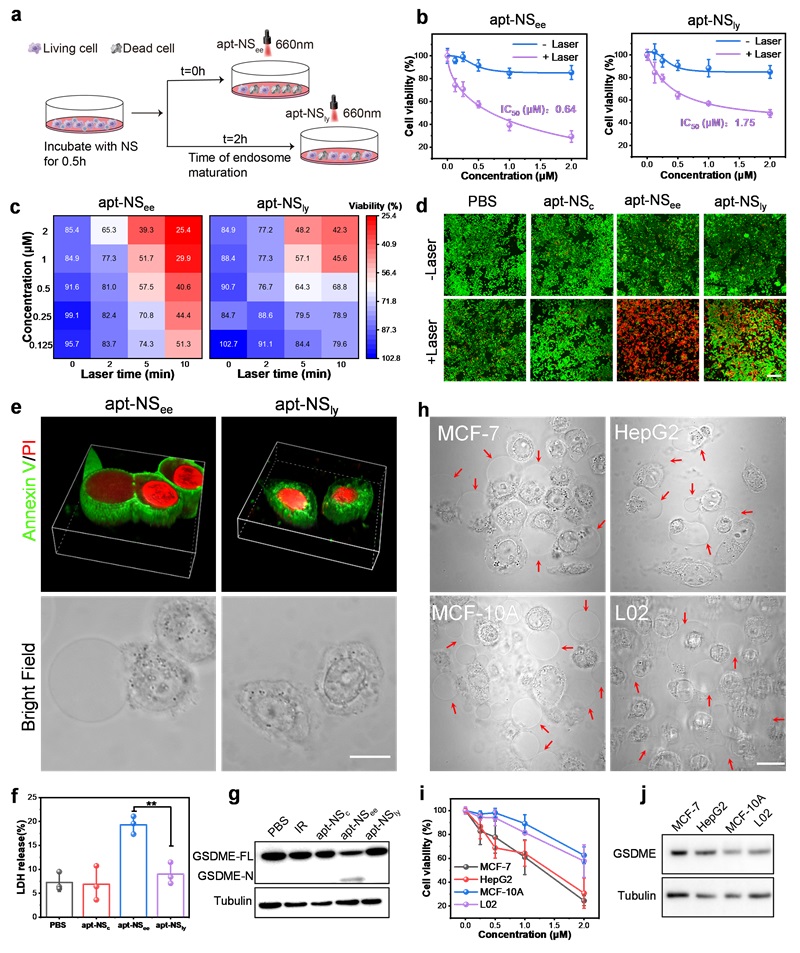
图4. NSee和NSly的体外PDT效果及杀伤机制。接下来作者研究了apt-NSee和apt-NSly与肿瘤组织中内吞细胞器的共定位情况。肿瘤切片分析显示apt-NSee最初与Rab5a(EE标记)共定位,而apt-NSly随后与Lamp1(Ly标记)高度共定位(图5a)。细胞器共定位分析结果显示,apt-NSee在EE中的峰值时间约为0.5h,apt-NSly在Ly中的峰值时间约为2h(图5b)。因此,在后续实验中,小鼠分别在注射apt-NSee和apt-NSly后0.5h和2h接受激光照射。最后作者在MCF-7荷瘤小鼠中系统评估了纳米药物的体内治疗效果。治疗期间体重无明显变化,表明纳米药物具有生物安全性(图5c)。肿瘤生长曲线(图5d和图5e)显示,apt-NSee比apt-NSly具有更好的肿瘤抑制效果。治疗后,切除肿瘤、称重并拍照,结果显示apt-NSee和apt-NSly均有明显的抑制效果(图5f)。然而,apt-NSee组的肿瘤根除率为82.7%,明显高于apt-NSly(49.2%)(图5g)。肿瘤图像进一步表明apt-NSee具有最佳的肿瘤抑制效果(图5h)。肿瘤组织的WB分析结果显示,apt-NSee组出现GSDME-N条带,表明发生了焦亡。以上结果表明apt-NSee通过诱导癌细胞焦亡引发高效的PDT。
综上所述,作者成功设计了一个内体区室特异性激活的NS库,形成了一系列能够响应各种pH范围的智能NS。其中,选择了两种pH响应范围不重叠的NS(NSee和NSly)分别在EE和Ly中特异性激活。EE激活的PDT通过GSDME介导的细胞焦亡有效地诱导了癌细胞焦亡,而Ly激活的PDT则导致低效的凋亡。另外,与正常细胞相比,NSee治疗组对GSDME高表达的癌细胞表现出更显著的焦亡细胞毒性。因此,通过适配体介导的靶向、时空可控激活及诱导GSDME介导的细胞焦亡,NSee能够高效杀死肿瘤细胞,同时减少对正常组织的副作用。这项研究展示了DNA纳米技术在药物输送领域的巨大潜力,能够实现靶向、安全、精准和可生物降解的药物输送。相关研究成果发表在Nano Letters,论文的第一作者为湖南大学化学化工学院博士研究生陈余,通讯作者为湖南大学化学化工学院黄晋教授。该研究工作得到国家自然科学基金和湖南省自然科学基金的资助。原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Tiny pH-resolved DNA nanospheres for cellular pyroptosis or apoptosis regulation
Yu Chen, Xiaoyi Liu, Yu Guo, Shiyuan Liu, Jiaoli Wang, Xiaoxiao He, Xiaohai Yang, Kemin Wang, Jin HuangNano Lett. 2024, 24, 13075-13084, DOI: 10.1021/acs.nanolett.4c03937

黄晋,湖南大学化学化工学院教授,博士生导师,教育部青年长江学者,湖南省杰出青年基金获得者,湖南大学岳麓学者。研究兴趣是DNA纳米材料及其生物医学应用。先后主持和参与国家及省部级科研项目近20项,已在国际学术期刊上发表论文200余篇,总引用次数超过9000次(H因子51),获发明专利8项。


























































 京公网安备 11010802027423号
京公网安备 11010802027423号