Kendomycin B中全碳环ansa结构的形成机制解析
Kendomycins是一类非典型安莎霉素类化合物,相较于传统安莎霉素的大环内酰胺结构,其具有独特的全碳环安莎(ansa)结构(图1)。不仅如此,其还具有多样的生物活性,包括抗菌、抗肿瘤和预防骨质疏松等。故kendomycins一度是天然产物化学领域的研究热点,近期中国科学院南海海洋研究所/山东大学药学院的鞠建华团队在J. Am. Chem. Soc.杂志上报导了kendomycin B结构中十八元大碳环ansa结构的形成机制,进一步解析了该非典型安莎霉素类化合物的生物合成过程。
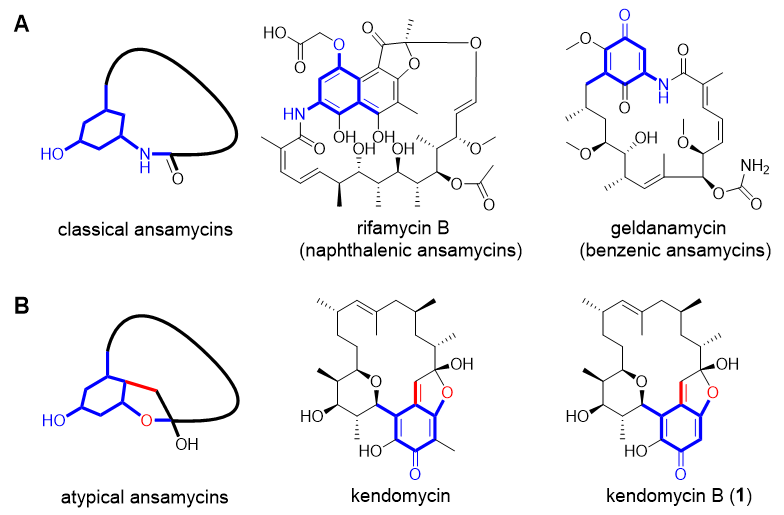
图1. 典型(A)和非典型(B)安莎霉素类化合物的结构特点及其代表性化合物。
Kendomycin B分离自一株深海稀有放线菌Verrucosispora sp. SCSIO 07399,其具有十八元全碳环ansa骨架,包括一个甲基醌发色团偶联一个高度取代的吡喃环结构。经基因簇比对和异源表达等确定其由一条I型/III型杂合聚酮合酶(PKS,polyketide synthase)基因簇kmy合成。进一步的生物信息学分析锁定3个氧化还原酶可能参与全碳环ansa骨架的形成,故研究者们进行了基因敲除/回补验证,发现分别失活Kmy5和Kmy9时,均仅降低了终产物的产量;而失活FAD依赖的单加氧酶Kmy13后,终产物kendomycin B-D(1, 1a, 1b)完全消失,且积累了一些中间体(图2)。
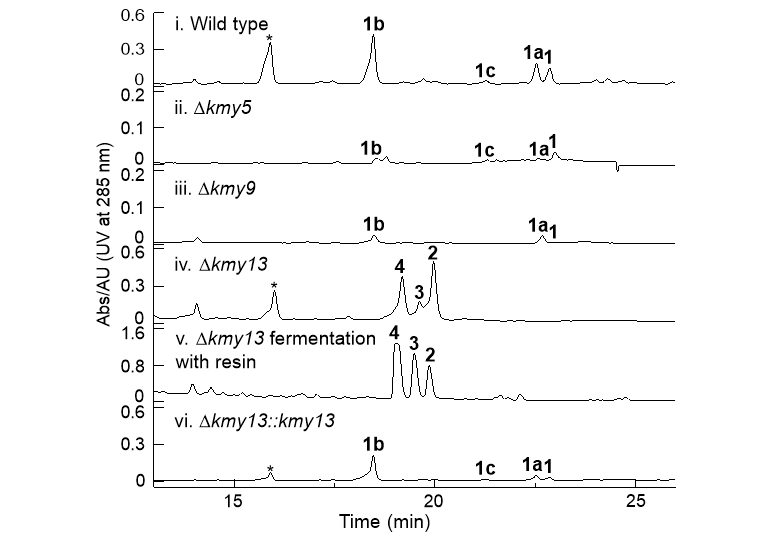
图2. 基因敲除突变株的发酵产物检测结果。
通过ΔKmy13突变株的放大发酵和产物分离鉴定,获得了三个β-酮酯中间体kendolactones A-C(2-4)及其开环脱羧产物kendoketone(5)。进一步的体外酶学实验,不仅验证了FAD依赖的单加氧酶Kmy13的催化功能,其全权负责全碳环ansa结构的形成,还鉴定了kendolactone A为Kmy13的天然底物,即真正的生物合成中间体。由此推测了kendomycin B可能的生物合成途径(图3)。
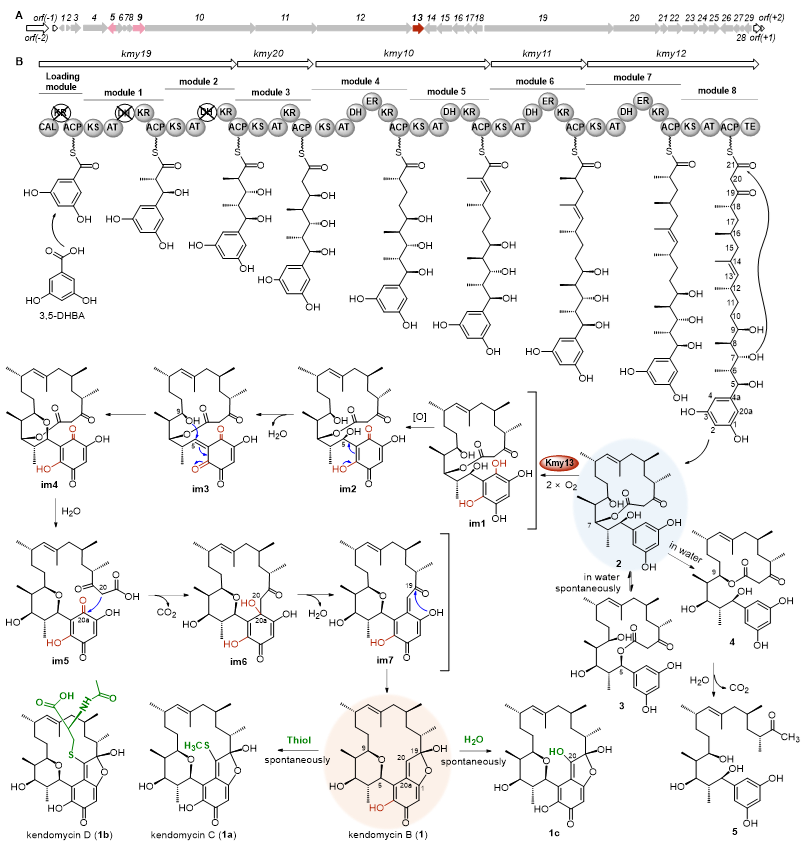
图3. Kendomycin B可能的生物合成途径。
从中间体kendolactone A(2)转变成终产物kendomycin B(1)的过程中涉及复杂的多步反应,但其仅由Kmy13单个酶完成,为了更详细地了解其催化机制,故对Kmy13进行了结构模拟、分子对接以及关键氨基酸残基的突变实验。确定R36、N40、R100、Y153和H175为催化相关残基,其中,R36和N40参与约束间苯二酚结构,R100提供催化碱性基团(图4)。同时,认为初始的邻位羟基化对后续一系列反应的发生至形成全碳环ansa结构至关重要。
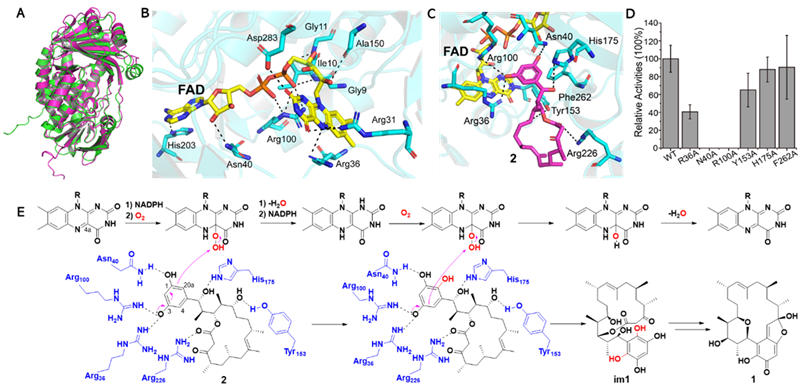
图4. Kmy13的蛋白结构模拟、分子对接和点突变等研究结果。
综上,该研究揭示了非典型安莎霉素类化合物kendomycin B中全碳环ansa骨架的形成机制,其仅由一个FAD依赖的单加氧酶Kmy13全权负责。同时,确证了kendolactone A为真正的生物合成中间体,从而推测了kendomycin B完整的生物合成途径。该研究也为探索其它kendomycin-类型天然产物的生物合成机制提供了参考。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Flavin-Dependent Monooxygenase Kmy13 Mediates Formation of the Carbocyclic ansa System during Kendomycin B Biosynthesis
Jiang Chen, Hongjie Zhu, Ming Peng, Shanwen Zhang, Qinglian Li, Yu-Cheng Gu, Jianhua Ju*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c08774
鞠建华 教授

鞠建华,1972年生,教授,博士生导师。主要从事活性天然产物的发现、生物合成和创新药物研发工作,发现了具有抗感染、抗肿瘤等活性天然产物2000余个,开发了基于代谢阻断的基因组挖掘技术,阐明了30余种天然产物的生物合成机制,揭示了26种新颖生物合成酶的催化功能,获得5个自主产权的抗结核杆菌/耐药菌感染、抗胶质瘤和抗白血病候选药物。获得国家杰出青年科学基金资助,入选科技部中青年科技创新领军人才、国家万人计划科技创新领军人才。获得第五届施维雅青年药物化学奖、第七届药明康德生命化学研究奖、广东省自然资源科学技术一等奖、中国海洋工程科学技术奖。中国药学会海洋药物专业委员会副主任委员;中国微生物学会海洋微生物专业委员会副主任委员;国际学术刊物J. Nat. Prod.,Mar. Drugs顾问编委、Pharmaceutical Science Advances执行主编。在Nat. Chem. Biol., PNAS,Nature Commun., JACS,ACIE等学术刊物发表论文230篇,获授权专利30余项。
https://www.x-mol.com/university/faculty/280525
研究领域
(1)特殊环境(海洋、沙漠、植物内生等)微生物活性次级代谢产物的发现(Bioactive natural product discovery)。利用化学生态学原理和多种发酵培养技术,从特镜微生物(放线菌、真菌等)中筛选、分离和鉴定结构新颖、活性显著的生物活性物质。研究微生物产生的活性物质在特定生境的化学防御机理,发现生理活性显著药效活性物质,为开发具有我国独立知识产权的创新药物提供先导化合物。
(2)微生物源复杂活性天然产物的代谢工程、组合生物合成和合成生物学技术开发(Metabolic engineering, combinatorial biosynthesis, and synthetic biology of complex bioactive natural products)。包括:抗生素生物合成基因簇的克隆、序列测定和生物信息学分析;重要活性化合物产生菌全基因组的序列测定及其功能基因研究;新的生物合成途径的发现及其调控机制;基因阻断、置换、重组或异源表达构建工程菌,产生“非天然”的天然产物或提高目标天然产物的产量;利用基因克隆、蛋白表达、纯化手段,对酶促反应机理和动力学进行表征,发掘新型酶促反应催化剂;重要活性天然产物的体外全生物合成(in vitrototal biosynthesis),体外构建重要天然产物的生物合成途径,用生物酶快速合成天然产物衍生物库。
(3)抗感染、抗肿瘤等药物的成药性评价和药物研发(Anti-infective and anti-tumor drug development)。对通过发现和生物合成技术改造获得的化合物进行构效关系研究,筛选出结构新颖、活性显著、具有自主知识产权的化合物进行体内药效、毒理和药代等临床前研究,开发抗感染、抗肿瘤等药物。
代表性论文(5篇)
1. Ji, X.; Tu, J., Song, Y.; Zhang, C.; Wang, L.; Li, Q.;* Ju, J.* A luciferase-like monooxygenase and flavin reductase pairAbmE2/AbmZ catalyzes Baeyer–Villiger oxidation in neoabyssomicin biosynthesis. ACS Catal., 2020, 10, 2591-2595.
2. Gui,C.; Chen,J.; Xie, Q.; Mo,X.; Zhang,S.; Zhang, H.; Ma,J.; Li, Q.; Gu,Y-C.; Ju, J.*CytA, a reductase in the cytorhodin biosynthesis pathway, inactivates anthracycline drugs inStreptomyces. Commun. Biol., 2019, 2:454.
3. Zhu, Q.; Chen, Q.; Song, Y.; Huang, H.; Li, J.; Ma, J.; Li, Q.; Ju, J.* Deciphering the sugar biosynthetic pathway and tailoring steps of nucleoside antibiotic A201A unveils a GDP-L-galactose mutase. Proc. Natl. Acad. Sci. U.S.A. 2017, 114, 4948-4953.
4. Ma, J.;*Huang, H.; Xie, Y.; Liu, Z.; Zhao, J.; Zhang, C.; Jia, Y.; Zhang, Y.; Zhang,H.; Zhang,T.; Ju, J.*Biosynthesis of ilamycins featuring unusual building blocks and engineered production of enhanced anti-tuberculosis agents. Nat. Commun. 2017, 8(1), 391.
5. Li, Q.;Qin, X.; Liu, J.;Gui, C.;Wang, B.;Li, J.;Ju, J.* Deciphering the Biosynthetic Origin of L-allo-Isoleucine. J. Am. Chem. Soc., 2016, 138, 408–415.
主持在研项目
1. 国家重点研发计划项目:重要深海药源天然产物合成生物学产生体系构建(2019YFC0312500),2020.01-2021.12,主持、结题;
2. 国家自然科学基金重点项目:海洋真核-原核共生体系化学防御功能天然产物的产生及其机制(22037006);2021.01-2025.12,主持、在研。
3. 国家自然科学基金-山东联合基金重点项目,海洋微生物源天然小分子探针的发现、优化及其化学生物学功能(U2106207),2022.01.01-2025.12.31,主持、在研。
联系方式:jju@sdu.edu.cn
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号