清华大学储凌课题组Nat. Commun.:小分子介导的生物正交反应
在癌症治疗中,前药的开发是降低毒副作用和提高药物递送效率的手段之一。生物正交反应和点击化学的发展为前药活化提供了新的思路,其中SQP33是一种被反式环烯烃(TCO)修饰的阿霉素前药,毒性被减弱的同时进行全身注射,通过局部注射四嗪(Tz)修饰的生物聚合物来进行局部激活。在这一过程中精准的给药途径以及高效选择性的点击化学共同实现特异性靶向,因此快速高效的生物正交反应的发展是推动这一领域发展的关键。
在芳硝基还原的前药开发中,利用实体瘤缺氧的特性开发的缺氧激活前药(HAP)依靠肿瘤缺氧环境中过表达的内源性还原酶还原释放细胞毒素,然而这一方法受限于实体瘤的复杂异质性,以及临床上缺乏可靠的缺氧生物标志物。硝基还原酶的异源表达是激活芳香硝基前药的另一种策略,然而该方法的推广同样受限于酶催化效率与基因转染效率低。
为了进一步推进芳香族硝基前药在癌症治疗中的应用,需要新的策略来规避肿瘤细胞固有的生物学特性,提高其激活效率。清华大学储凌课题组提出了4,4’-二联吡啶介导的芳硝基还原反应用于前药激活的策略(图1)。这是一个由有机催化剂介导的生物正交反应方法,反应在低浓度微摩尔级和生物相容条件下进行,同时发现水在低底物浓度下起着关键作用。这种前药激活反应在哺乳动物细胞、细菌和动物模型中是兼容的。此外,本研究展示了一个4,4’-联吡啶介导的还原环化级联反应,用于在活细胞中合成吲哚衍生物。
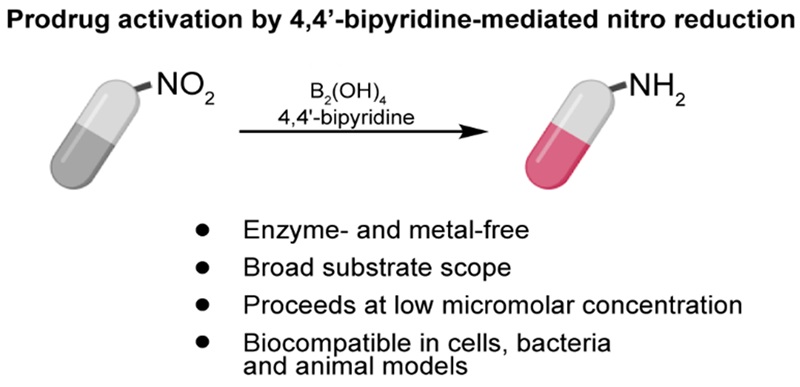
图1. 4,4’-二联吡啶介导的芳香硝基还原在细胞、细菌和动物模型中的前药激活
为了测试该硝基还原反应是否在活细胞中兼容,作者首先用荧光探针2d以及前体1d孵育细胞 (图2A),1d的荧光通过PeT效应被硝基猝灭,1d被还原后则会恢复荧光。通过共聚焦显微镜观察到,添加B2(OH)4和4,4'-二联吡啶增加了细胞的荧光强度 (图2B),表明该反应可以在生物相容条件下进行。通过荧光强度定量分析发现,反应收率在20%-40%之间(图2C)。
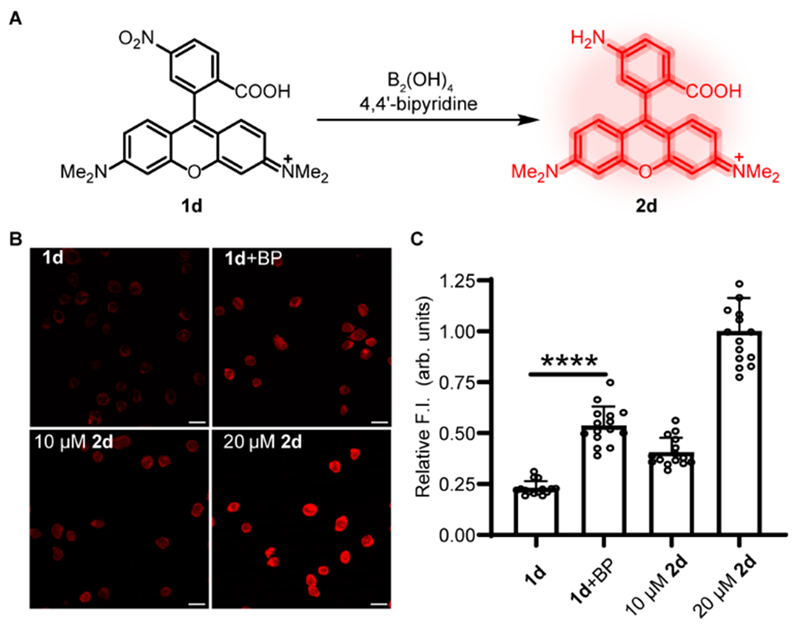
图2. 活细胞中1d硝基的还原
甲氧苄啶 (TMP) 和磺胺的协同给药用于治疗细菌感染。在这项工作中,作者尝试将硝基还原的方法用于抗菌前药的激活。作者首先优化了TMP和磺胺二甲嘧啶 (SMZ) 的浓度比例,以达到最大的细菌生长抑制效果。结果显示,0.44 μM TMP与44 μM SMZ组合的协同效应最高(图3C)。在接下来的测试中,0.44 μM TMP、44 μM前药1f和B2(OH)4/4,4′-二联吡啶的组合处理大肠杆菌的抑菌效果与0.44 μM TMP、44 μM 2f效果相当(图3D),证明了4,4'-二联吡啶介导的氮还原为抗微生物治疗提供了一种互补的前药策略。
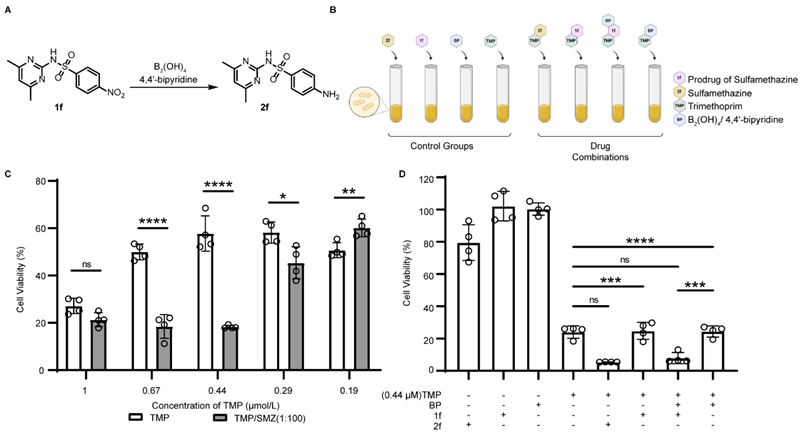
图3. 前药1f硝基还原的抑菌作用
吲哚是一种多功能药效团,通过不同的作用机制发挥广泛的药理活性。作者设想邻硝基乙醛在硝基还原后可能会环化形成吲哚环(图4A)。基于此设想合成了邻硝基苯乙醛衍生物7,前药7发生级联化反应转化为吲哚衍生物8(图4B),一种抗有丝分裂药物。当用前药7,B2(OH)4/4,4’-二联吡啶共同孵育细胞后,表现出显著的细胞杀伤效果(图4C)。表明在催化剂的存在下,7在细胞中转化为8。这些实验表明,硝基还原-环化级联可以作为活细胞中吲哚合成的补充策略。
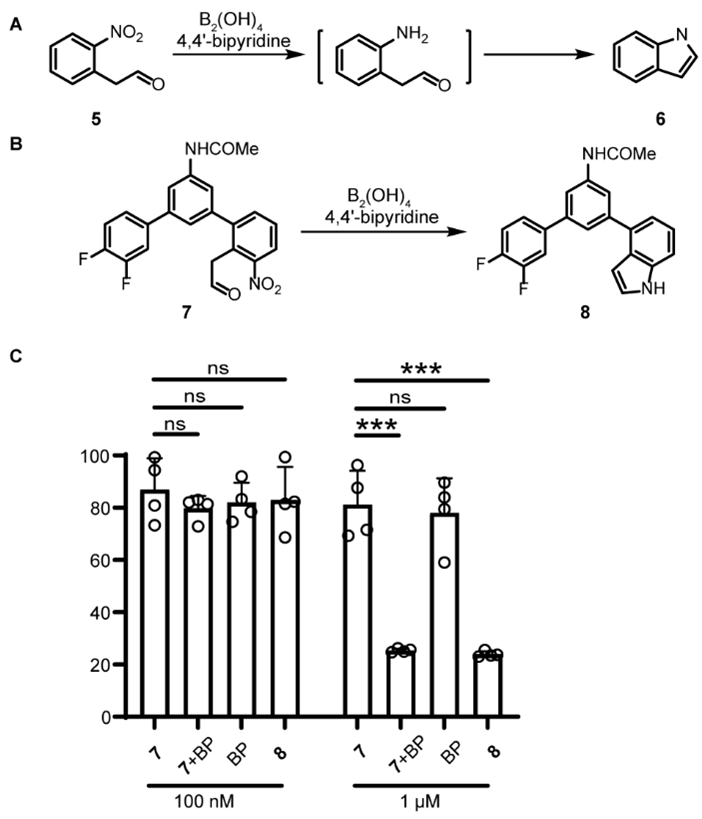
图4. 芳香硝基还原-环化级联在活细胞中合成吲哚
在该项工作的最后,为了证明该方法在体内的有效性,作者构建了稳定表达Super Degron (SD) 融合萤火虫荧光素酶 (FLuc) 的4T1细胞系(图5B)。SD系统使任何融合蛋白在IMiDs处理下都容易降解,作者设想Iberdomide的前药 (Pro-Iber) 可以在硝基还原条件下被激活得到Iberdomide (Iber)。首先在体外测试了这个降解系统,成功观察到Pro-Iber+ B2(OH)4/4,4’-二联吡啶组和Iber组的发光信号减少(图5A),表明该策略可以成功激活Pro-Iber并降解Fluc-SD。随后用表达FLuc- SD的4T1细胞构建动物模型,并成功观察到药物治疗组的生物发光信号下降(图5C, D)。结果表明通过硝基还原的前药激活策略在体内具有生物相容性,并有望实现靶向给药。
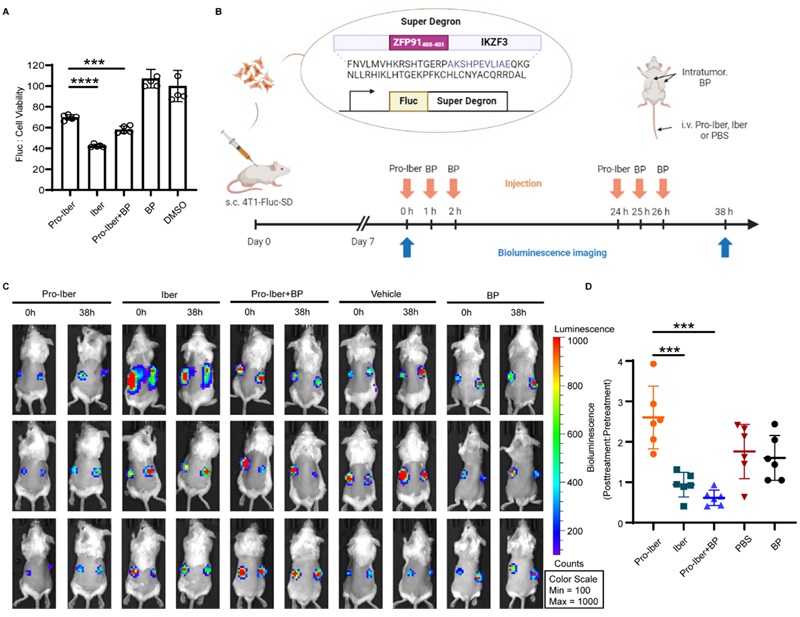
图5. Pro-Iberdomide激活在体内的蛋白降解
总之,该课题组报道了一个生物兼容的4,4’-二联吡啶介导的芳香硝基还原反应,以控制前药活化。该反应显示了良好的底物相容性,并能在低微摩尔浓度下进行。机理研究表明水在该反应中起着关键作用。通过使用荧光“turn on”底物,初步证明了该反应与活细胞的相容性。随后通过合成iberdomide的前药,并在MM.1S细胞中实现了氮还原反应,以证明该反应在蛋白质降解中的应用。此外,该前药激活策略可以应用于抗微生物治疗。后续设计了一个用于在活细胞中合成吲哚的硝基还原-环化级联反应,并将该级联反应用于合成具有生物活性的吲哚衍生物,以诱导癌细胞死亡。最后,通过体内蛋白质降解实验,证明这种生物正交化学在动物模型中激活前药的能力。该方法将成为助力化学生物学和药物递送的宝贵工具。
本研究得到国家重点研发计划 (No. 2021YFA0910900)、生物结构前沿研究中心和清华大学“笃实计划”、生命科学中心的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Prodrug activation by 4,4’-bipyridine-mediated aromatic nitro reduction
Qing Wang, Yikang Song, Shuowei Yuan, Yaoji Zhu, Wenjing Wang & Ling Chu
Nat. Commun., 2024, 15, 8643, DOI: 10.1038/s41467-024-52604-y
导师简介
储凌,清华大学药学院副教授。2012年本科毕业于中国科学技术大学化学系,2017年于斯克里普斯研究所获得化学博士学位。2017至2021年在耶鲁大学从事博士后研究,2021年3月起加入清华大学药学院,现任副教授、研究员。课题组目前的研究方向有:1) 蛋白标记及荧光成像方法的开发; 2)生物正交反应的开发与应用; 3) 基于新靶点、新机制的药物化学研究。
https://www.x-mol.com/university/faculty/369921
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号