Nano Res.│上海交通大学颜德岳教授课题组联合夏小霞教授课题组:亲合体-PROTAC偶联物自组装纳米药物用于癌症靶向治疗
本篇文章版权为李青荣所有,未经授权禁止转载。

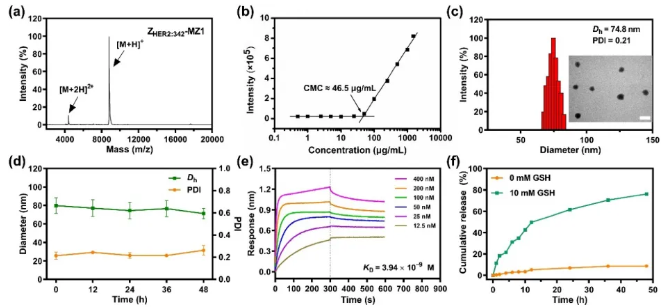
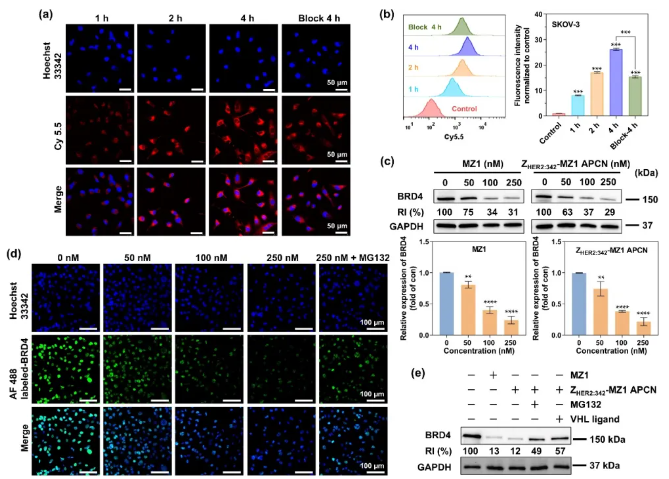
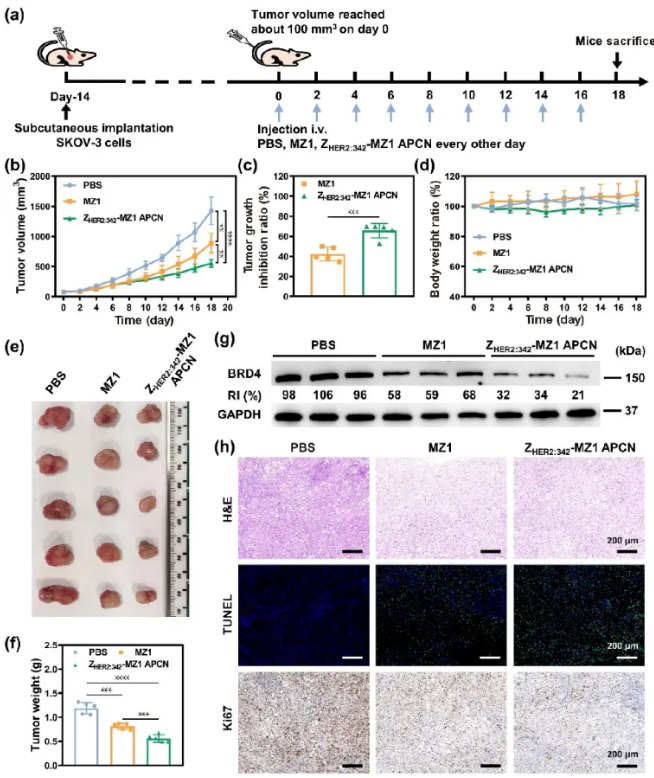
背景介绍 近年来,蛋白降解靶向嵌合体(Proteolysis targeting chimeras, PROTACs)已成为一类很有前景的癌症治疗药物。然而,PROTACs的膜通透性差、缺乏肿瘤靶向性,其临床应用受到很大限制。基于我们团队提出的亲合体-药物偶联物自组装纳米药物(Affibody-drug conjugate nanoagent, ADCN)新概念,在这里我们进一步构建一种亲合体-PROTAC偶联物纳米药物(Affibody-PROTAC conjugate nanoagent, APCN),特异性递送PROTACs用于肿瘤治疗。 成果简介 上海交通大学颜德岳教授和夏小霞教授课题组采用特异性识别卵巢癌过表达HER2的亲和体蛋白ZHER2:342与BRD4降解剂MZ1偶联制备亲和体-PROTAC偶联物,并进一步自组装制得主动靶向纳米药,用于HER2阳性卵巢癌的靶向治疗。由于亲和体-PROTAC偶联物ZHER2:342-MZ1具有两亲性分子结构,可在水中自组装形成粒径约73 nm的纳米颗粒ZHER2:342-MZ1 APCN。体外评价结果显示:ZHER2:342-MZ1 APCN可保持ZHER2:342的高亲和性,并以HER2受体介导的内吞途径进入肿瘤细胞,在胞内高水平谷胱甘肽作用下释放出MZ1,通过泛素化-蛋白酶体途径诱导BRD4降解,从而导致BRD4缺失介导的细胞凋亡。体内评价结果显示:ZHER2:342-MZ1 APCN在HER2阳性荷瘤小鼠体内具有优异的肿瘤靶向作用,且在肿瘤部位滞留时间明显延长。在HER2阳性卵巢癌模型治疗过程中,ZHER2:342-MZ1 APCN的体内抗肿瘤活性明显增强,肿瘤生长抑制率是MZ1的1.5倍。同时,经ZHER2:342-MZ1 APCN治疗的小鼠肿瘤中BRD4蛋白水平显著下降,且治疗过程中无明显毒副作用。综上所述,基于亲和体-PROTAC偶联物纳米药物有望促进PROTACs在肿瘤靶向治疗中的应用。 图文导读 图1 ZHER2:342-MZ1 APCN的制备过程及其体内抗肿瘤过程 图2 ZHER2:342-MZ1 APCN的制备与表征 图3 ZHER2:342-MZ1 APCN的细胞摄取和体外诱导BRD4降解 图4 ZHER2:342-MZ1 APCN在HER2阳性SKOV-3卵巢癌模型中的体内抗肿瘤活性。 作者简介 文章信息 Li Q, Yang X, Zhao M, et al. A self-assembled affibody-PROTAC conjugate nanomedicine for targeted cancer therapy. Nano Research, 2024, https://doi.org/10.1007/s12274-024-6974-x. 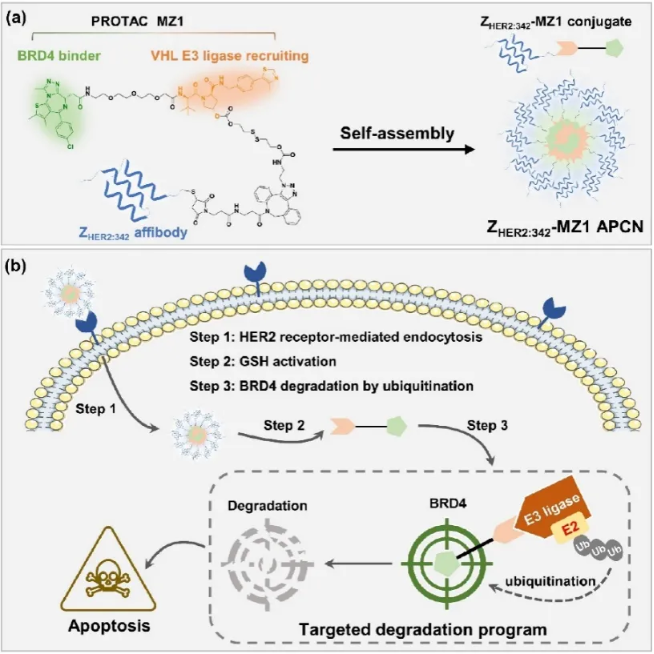

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号