刘聪/谭立/项晟祺JACS:靶向帕金森病病理聚集体无序区的抑制剂
注:文末有研究团队简介及本文科研思路分析
α-突触核蛋白(α-synuclein, α-syn)的淀粉样相变聚集是帕金森病(Parkinson’s disease, PD)的核心病理特征之一。α-Syn病理性聚集体能够在神经元之间传播,破坏细胞内的蛋白质稳态,干扰自噬途径,并诱导神经炎症与细胞死亡。近年来,刘聪课题组参与发现了多个关键蛋白(如膜受体LAG3、APLP1和RAGE,以及自噬关键蛋白LC3B等)通过特异性结合α-syn病理聚集体介导了这些不同的病理过程。此外,研究鉴定出α-syn聚集体的C末端以无序结构状态覆盖在病理纤维聚集体的表面,成为纤维聚集体与不同蛋白识别结合的关键区域。因此,发展小分子靶向C末端无序区,阻断α-syn病理聚集体与相应受体蛋白的互作,有望为PD药物研发和治疗提供潜在的新方向。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员(点击查看介绍)、谭立研究员(点击查看介绍)与中国科学技术大学项晟祺教授(点击查看介绍)合作,在Journal of the American Chemical Society 发表了研究文章,通过高通量筛选与理性设计,首次发现了能够结合α-syn病理纤维C末端关键无序区的活性小分子Givinostat(GS)及其衍生物。相应的活性小分子能有效阻断病理纤维与LAG3和RAGE等关键受体的相互作用,并抑制α-syn纤维在神经元中的病理性传播及其促炎症效应。候选化合物展现出良好的临床应用潜力,为PD的治疗提供了全新策略。
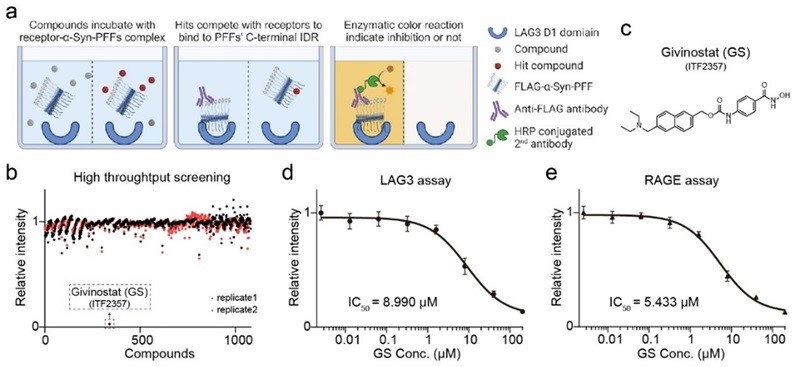
图1. 高通量筛选鉴定Givinostat(GS)分子能够阻断α-syn纤维与受体的结合
在本研究中,研究人员首先建立了基于酶联免疫吸附实验(ELISA)的高通量筛选方法,旨在寻找能够阻断α-syn病理纤维C末端关键无序区与受体结合的小分子抑制剂(图1a)。通过该方法,Givinostat(GS)被筛选为主要候选分子(图1b-c),进一步的活性验证表明,GS能够有效抑制α-syn C末端无序区与LAG3和RAGE受体的直接相互作用(图1d-e)。
研究人员进一步开展了结构-活性关系研究(SAR)。首先,对GS的关键结构单元进行了系统优化,GS的结构主要由两部分组成:(1)锌结合的异羟肟酸基团,(2)增强选择性的功能基团(图2)。在优化过程中,GS被分为A-E五个部分,并逐步进行调整。最初尝试替换E部分的异羟肟酸基团或对其进行修饰,但这些改动均导致分子活性丧失或大幅下降,进一步确认了异羟肟酸基团的关键作用。然而,对其位置的调整(如meta位类似物)成功保留了活性,同时降低了毒性。D部分引入给电子/吸电子基团未显著改变活性,但C部分的改造表明,用脲基替换氨基甲酰键可提高化学稳定性。最终,通过对B和A部分的进一步修饰,优化出了如GSD-16-24等具有更强抑制效果的化合物,并显著降低了其对神经元的毒性。
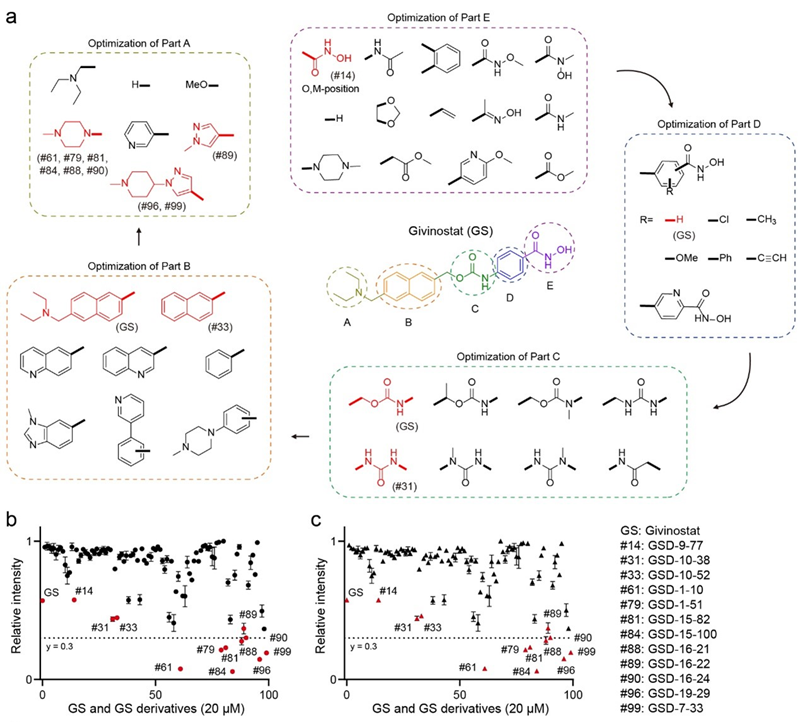
图2. 通过结构-活性关系研究(SAR)设计GS的系列衍生物。
在机制研究中,研究人员首先通过等温滴定量热法(ITC)发现,GS及其衍生物GSD-16-24直接作用于α-syn纤维的C末端无序区域,而非作用于LAG3和RAGE受体。随后,研究人员通过液态核磁共振、固态核磁共振及冷冻电镜等技术,进一步揭示了GSD-16-24与α-syn纤维C末端无序区域中具体的氨基酸相互作用位点,并发现这些结合位点与α-syn纤维结合受体的位点高度重合,表明GSD-16-24通过与受体直接竞争发挥抑制作用(图3)。细胞实验表明,GSD-16-24能够有效阻止α-syn纤维与原代皮层神经元及BV2细胞的结合,从而抑制纤维在神经元中的传播及其促炎症效应。
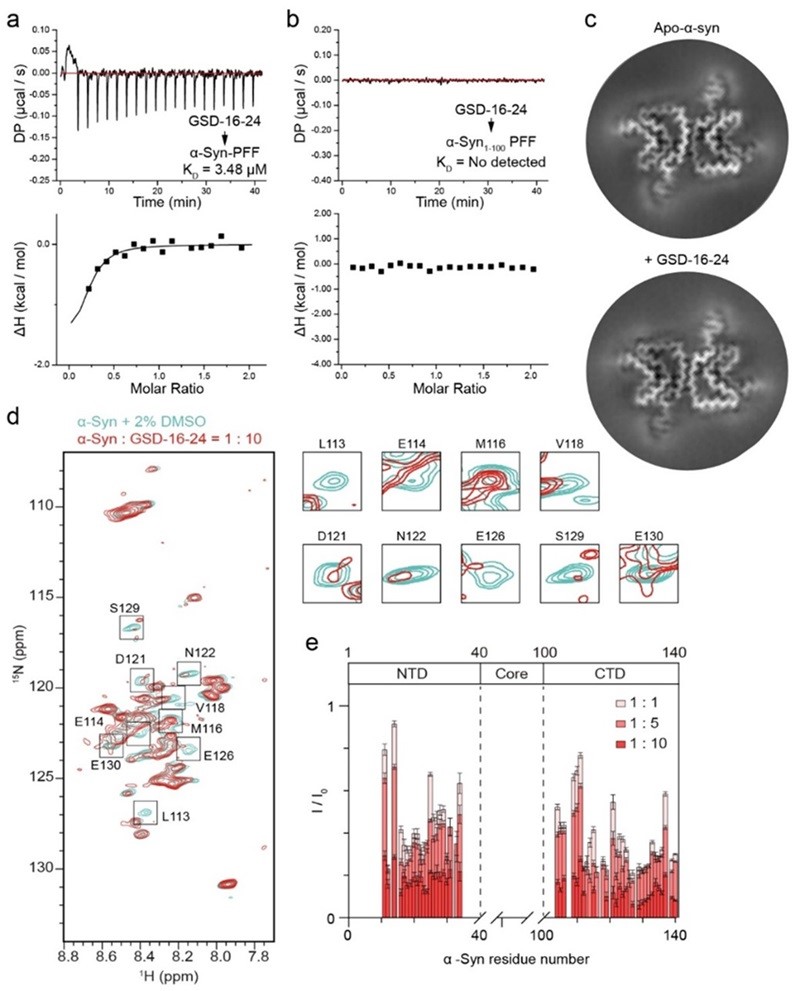
图3. 通过冷冻电镜和固态NMR等实验确定GSD-16-24结合于α-syn纤维的C末端无序区域。
综上所述,本研究首次实现了特异性靶向α-syn病理纤维核心外围无序结构区的小分子化合物的设计和研发,并通过活性分子阻断α-syn病理纤维与神经元及小胶质细胞膜受体的结合,有效抑制纤维的传播和神经炎症活性。这一研究为靶向病理蛋白无序区的小分子抑制剂的设计与研发奠定了基础,并为开发具有帕金森病治疗潜力的小分子药物提供了新的思路。
上海交通大学Bio-X研究院研究生章沈庆、陶友琦博士及中国科学院上海有机化学研究所生物与化学交叉研究中心博士生项淮江,以及中国科学技术大学生命科学学院李娟博士为该论文的共同第一作者。刘聪研究员、谭立研究员与项晟祺教授为共同通讯作者。本项目得到了国家自然科学基金委、中国科学院及上海市科委的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Inhibitor Development for α-Synuclein Fibril’s Disordered Region to Alleviate Parkinson’s Disease Pathology
Shenqing Zhang, Huaijiang Xiang, Youqi Tao, Juan Li, Shuyi Zeng, Qianhui Xu, Haonan Xiao, Shiran Lv, Caiwei Song, Yan Cheng, Martin Li, Zeyun Zhu, Shengnan Zhang, Bo Sun, Dan Li, ShengQi Xiang*, Li Tan*, and Cong Liu*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c08869
刘聪博士简介

刘聪,中国科学院上海有机化学研究所(SIOC)生物与化学交叉研究中心研究员,研究方向主要聚焦于蛋白质淀粉样纤维聚集的机制及其应用。他目前的主要研究项目包括:1) 神经退行性疾病中病理性淀粉样蛋白聚集的分子机制研究;2) 基于结构的病理性淀粉样蛋白聚集PET示踪剂与抑制剂的设计与开发;3) 基于淀粉样多肽的具有新功能的新材料设计,开发和应用。
近5年发表SCI论文百余篇,引用>5600次(Google scholar),(共)通讯67篇,包括Cell、Nature Chemical Biology (3篇)、Nat Struct & Mol Biol (3篇) 、PNAS(8篇)、JACS(3篇)、ACIE(3篇)、Nat Commun(9篇)、Cell Research(5篇)、Molecular cell等。受邀为Nat Rev Neurosci、Chem Rev、Chem Soc Rev等杂志撰写病理蛋白聚集机制与化学调控相关综述和展望。受邀为 Curr Opin Chem Biol 组织 “蛋白聚集与相分离的化学生物学研究” 专刊。获得国家及地方的多个基金资助,包括:国家杰出青年基金,科技部重点研发计划、自然基础科学中心项目(骨干) 、中科院基础研究领域青年团队项目等。
刘聪
https://www.x-mol.com/university/faculty/60195
实验室网站
谭立
https://www.x-mol.com/university/faculty/209653
项晟祺
https://www.x-mol.com/university/faculty/357578
科研思路分析
Q:这项研究的目的是什么?想法是如何产生的?
A:我们此前发现,α-syn病理性纤维通过C末端关键无序区与细胞膜受体(如LAG3、APLP1和RAGE)结合,介导纤维在神经元传播和诱发神经炎症等病理事件。基于这一机制,我们提出了通过竞争受体结合位点来阻止这些病理过程的设想,开发了靶向α-syn C末端无序区的ELISA高通量筛选方法,旨在发现能够阻断这种结合的小分子抑制剂。通过这一策略,我们筛选并优化了多种抑制剂小分子,为PD的治疗提供了新的干预策略。
Q:研究过程中遇到哪些挑战?
A:α-syn纤维C末端的动态性和无序性使得靶向设计抑制剂难度较大。我们在对GS进行优化时,尤其在替代和调整异羟肟酸基团时,多次遇到分子活性丧失的问题。通过不断调整优化策略,最终从100多个设计分子中筛选出了几种具有潜力的抑制剂,克服了无序蛋白区域的复杂性。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从中获益?
A:该研究为开发特异性靶向蛋白无序区的抑制剂提供了新颖的思路,特别是在抑制α-syn纤维C末端无序区介导的病理活性方面,具有潜在的临床药物研发应用前景。专注于神经退行性疾病药物开发和蛋白质聚集领域的企业或研究机构可以从这一成果中获益。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号