厦门大学刘刚/浙江中医药大学蒋莱Adv Mater:新型声动力制剂,实现肺部感染抗生素超声贯序治疗新策略
近日,厦门大学刘刚团队与浙江中医药大学药学院蒋莱团队提出了一种超声触发的仿生纳米抗生素复合制剂,用于耐甲氧西林金黄色葡萄球菌(MRSA)肺炎的精准贯序治疗。相关成果发表于国际知名学术期刊Advanced Materials。作者以表达MRSA特异性抗体的工程化细胞膜囊泡为载体,装载具有自发声动力学特性的纯环丙沙星纳米颗粒,构建了一种新型仿生靶向纳米药物。该药物在靶向突破肺部屏障的同时,在超声响应下产生大量•OH,破坏细菌外骨骼,促进胞内药物渗透,实现了对 MRSA 诱导的肺部感染的高效治疗。
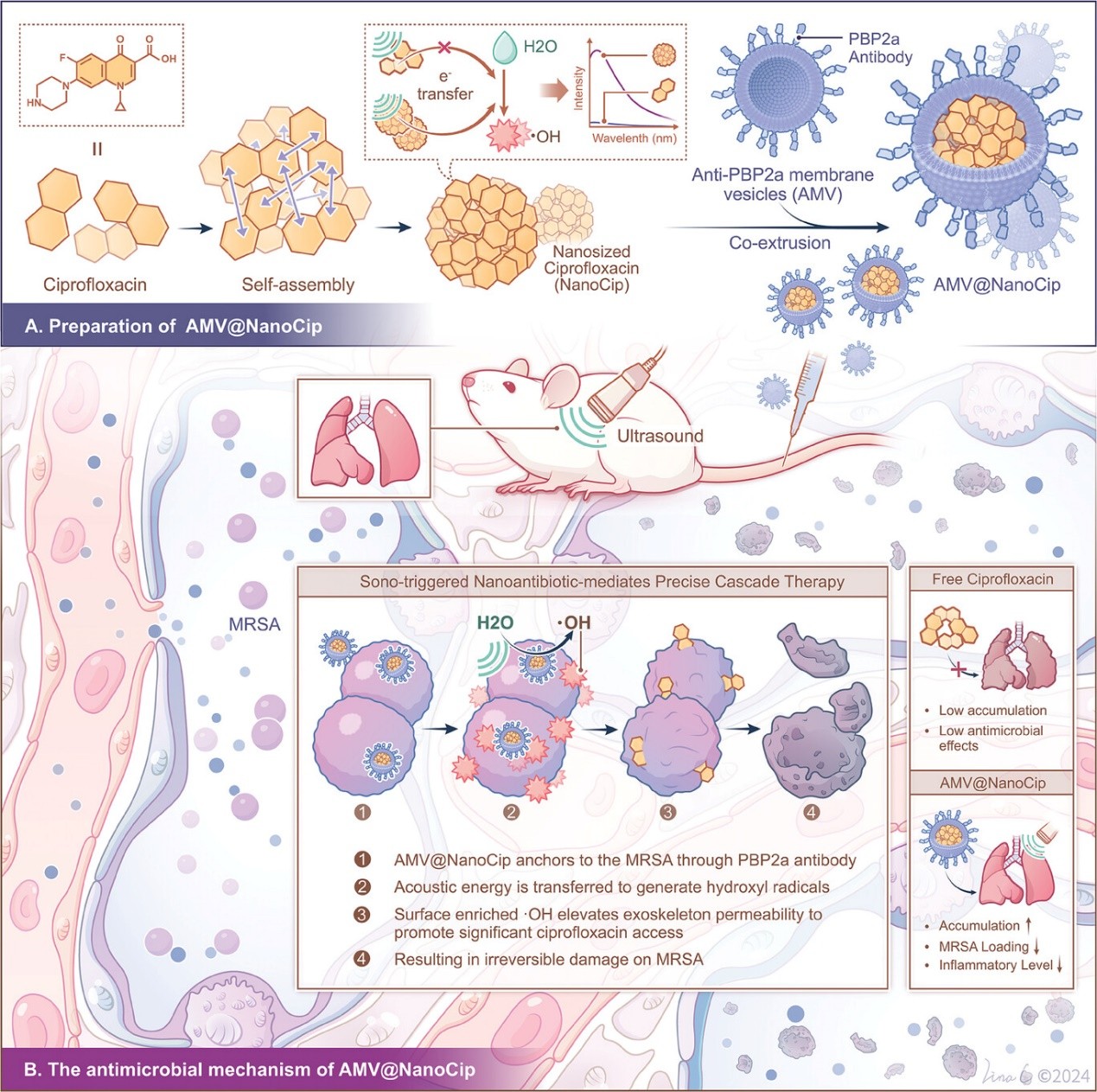
图1. AMV@NanoCip的制备及其在MRSA肺炎小鼠模型中的抗菌机制示意图
随着抗生素的广泛使用,耐甲氧西林金黄色葡萄球菌(MRSA)引起的下呼吸道感染急剧增加,特别是在与呼吸机相关的具有高致病性和致死率的医院获得性肺炎中。对于呼吸功能障碍的重症患者,口服和静脉给药无法实现有效的肺部渗透,吸入制剂使用受限,面临药物在下呼吸道沉积受损的问题。因此,亟需能够针对感染发生区域起效的药物输送系统。
随着纳米医学的发展,细胞膜囊泡因其良好的生物相容性、腔内载药能力和流变性能,被广泛用于纳米颗粒的表面改性。在此基础上,基因工程技术能够以更复杂的方式进一步扩展这些仿生功能,从而实现定向表达。环丙沙星作为广泛使用的喹诺酮类抗生素,通过进入MRSA内部来抑制DNA促旋酶发挥作用,但这一过程往往受到细菌外基质的阻碍,导致较差的抗菌效果。因此,迫切需要提高喹诺酮类药物的胞内渗透性,从而提高其治疗效果。
该研究基于刘刚教授团队提出的细胞膜定向表达展示技术(Nat Nanotechnol 2022, Adv Mater 2019, PNAS 2015, et al.),建立了表达MRSA特异性PBP2a抗体的工程细胞,并采用纳米技术获得了基于细胞膜囊泡的药物递送载体。这一工程化囊泡具有优异且快速的MRSA靶向结合能力和长效的体内循环能力,促进了其在感染部位的有效积累。以绿色温和的方式对环丙沙星纳米化后,诱导其产生了类似AESA的机制,超声激活后产生的大量ROS,显著提高了其抗菌活性。细胞膜囊泡与纳米环丙沙星共组装后的纳米药物不仅保留了其固有抗菌机制,同时整合了细菌靶向结合、超声响应的膜破坏与ROS生成,对MRSA引起的肺部感染具有强有力的保护作用。该研究凸显了将靶向给药与自发产生的声动力效应相结合以克服复杂生理障碍的潜力,为治疗肺部感染,特别是呼吸功能障碍患者提供了极有前景的治疗策略。
厦门大学丁林玉、梁小流、马家新为该论文的共同第一作者。厦门大学刘刚与浙江中医药大学药学院蒋莱为该论文的共同通讯作者。该研究工作得到了国家自然科学基金杰青项目、国家重点研发计划重点专项、中央高校基本科研业务费专项资金等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Sono-Triggered Biomimetically Nanoantibiotics Mediate Precise Sequential Therapy of MRSA-Induced Lung Infection
Linyu Ding, Xiaoliu Liang, Jiaxin Ma, Xue Liu, Yang Zhang, Qiuyue Long, Zihao Wen, Zihao Teng, Lai Jiang, Gang Liu
Adv. Mater., 2024, DOI: 10.1002/adma.202403612
导师介绍
刘刚
https://www.x-mol.com/university/faculty/39458
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号