ACS Cent. Sci. 康奈尔大学林合宁教授团队 | 白喉酰胺缺失通过调节RRM1翻译增加哺乳动物细胞中的DNA复制压力
英文原题:Loss of Diphthamide Increases DNA Replication Stress in Mammalian Cells by Modulating the Translation of RRM1

通讯作者:Hening Lin
作者:Jiaqi Zhao, Byunghyun Ahn
背景介绍
白喉酰胺(diphthamide)是一种独特的蛋白翻译后修饰,其合成过程涉及四个步骤和至少七个相关基因(DPH1-7)。白喉酰胺仅存在于真核延伸因子2(eEF2)中,并在大多数真核生物中高度保守。它能够防止翻译过程中的-1移码现象(即核糖体在合成多肽时向后移动一个核苷酸),从而确保翻译的准确性。同时,其生物合成基因的缺失与人类的发育缺陷和癌症密切相关。然而,白喉酰胺在细胞中的具体功能机制尚未完全阐明,对其在哺乳动物细胞中的研究也相对局限。
DNA复制压力被认为与多种生理和病理状态息息相关。核糖核苷酸还原酶1(RRM1)在dNTPs合成的限速步骤中起关键作用,其表达或活性失调与DNA复制压力及基因组不稳定性密切相关。此外,RRM1的异常与多种人类癌症相关,因此被视为潜在的癌症治疗靶点。深入研究RRM1与DNA复制压力之间的关系将有助于更好地理解癌症的机制。
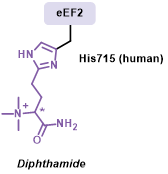
图1. 白喉酰胺结构。
文章亮点
作者开发了一种结合计算分析与定量蛋白组学的策略,成功识别了哺乳动物细胞中受白喉酰胺影响的蛋白候选物,并验证了特定蛋白受到白喉酰胺调节的机制。这为进一步研究白喉酰胺的生物功能及翻译过程中的-1移码提供了有力工具。此外,本研究揭示了白喉酰胺在哺乳动物细胞DNA复制压力中的作用,发现白喉酰胺缺失通过调节RRM1的翻译加剧了DNA复制压力,为解释白喉酰胺缺乏与癌症之间的关联提供了新的见解。
图文解读
作者在培养HEK293T野生型和白喉酰胺缺失细胞的过程中,观察到缺失细胞的生长速度较慢。由于DNA复制对细胞正常生长至关重要,作者猜想白喉酰胺缺失可能会引起DNA复制压力的累积。通过检测RPA32蛋白T21位点的磷酸化,他们发现缺失细胞中存在更高的DNA复制压力,并导致停滞复制叉的累积(图2)。
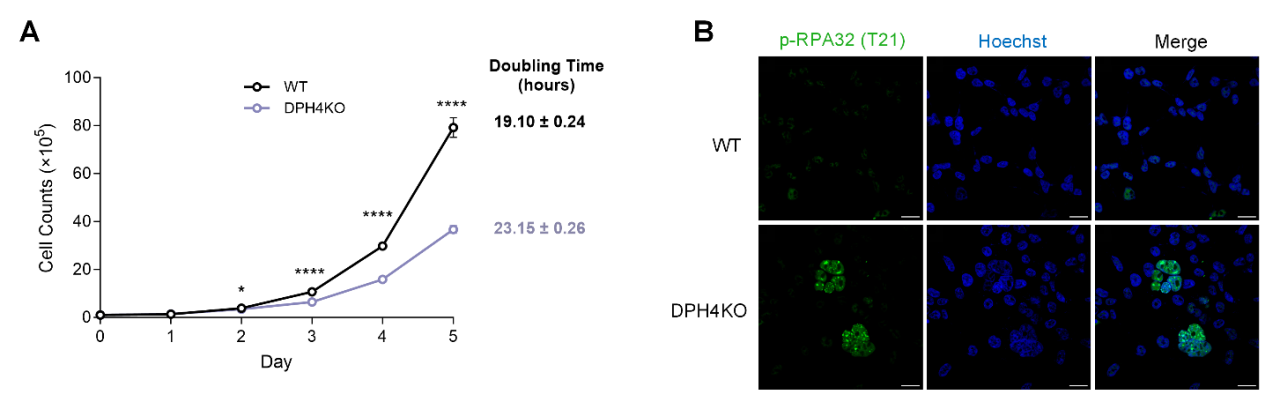
图2. 白喉酰胺导致哺乳动物细胞生长缺陷及DNA复制压力累积。
作者随后试图寻找导致此现象的分子机制。他们推测,白喉酰胺缺乏会增加-1移码率,导致移码蛋白(特别是截断蛋白)增多,从而表现为蛋白质水平的差异。基于此,他们开发了一种两步策略来识别受白喉酰胺影响的候选蛋白:首先,通过计算预测,在人类转录组中搜索易发生-1移码的序列;然后,利用定量蛋白组学技术分析在缺乏白喉酰胺的细胞中总量发生变化的蛋白。通过整合这两种方法,作者旨在找出哪些基因的蛋白质水平差异更可能受到-1移码的调节,即更易被白喉酰胺的影响(图3)。
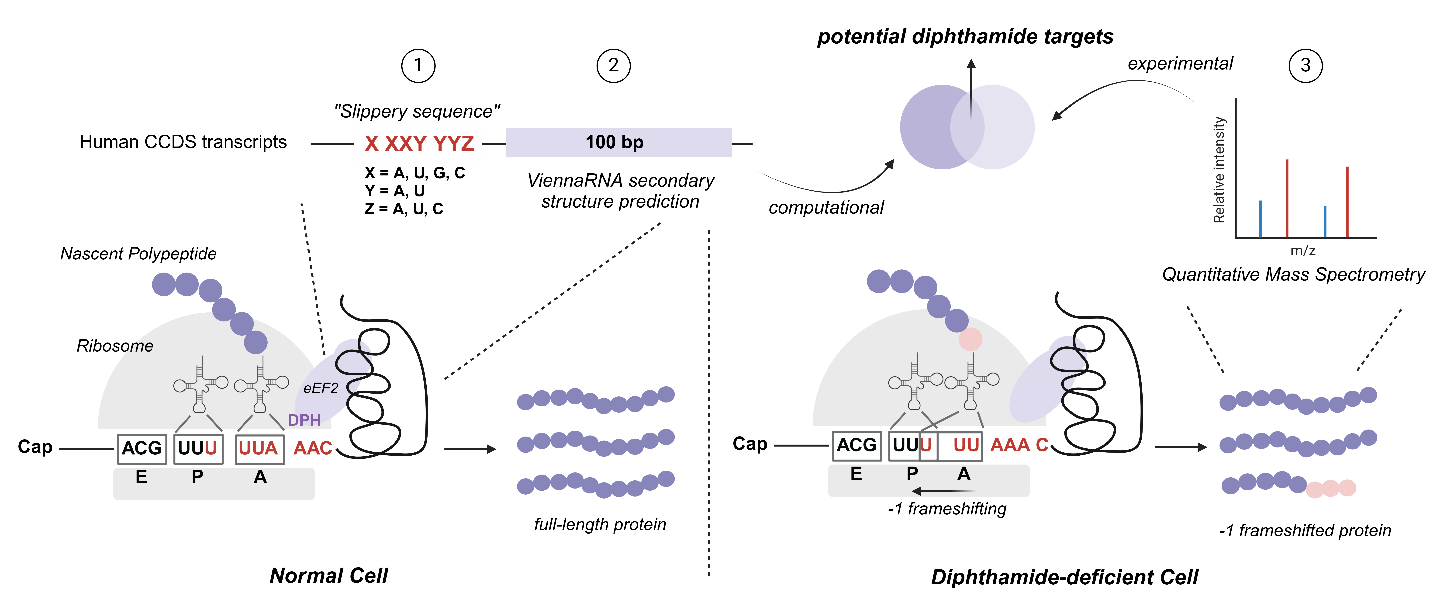
图3. 结合计算预测与定量蛋白质组学研究受白喉酰胺影响的候选蛋白的策略。
作者首先在人类转录组中搜索具有X XXY YYZ特征的“滑动序列”(slippery sequence),对含有此特征序列的mRNA,他们选取“滑动序列”后100bp的序列,预测其是否能形成稳定的二级结构。结果显示,人类转录组中约40%的序列可能含有潜在的-1移码信号。随后,作者采用细胞培养稳定核素标记(SILAC)定量蛋白质组学技术比较正常细胞与白喉酰胺缺失细胞的蛋白质组:他们首先分析SILAC数据中的heavy-to-light ratio (H/L ratio),识别出在缺失细胞中水平下降的蛋白;其次,根据上文预测的-1移码信号,他们构建了“-1移码蛋白序列库”,并对SILAC数据进行分析,确认了与猜想一致的-1移码蛋白质肽段。最终,结合这两种SILAC分析和计算预测的结果,确定了164个可能受白喉酰胺影响的候选蛋白。
基于观察到的DNA复制压力表型,作者选择研究蛋白RRM1(核糖核苷酸还原酶M1)。RRM1在DNA复制原料dNTP的生物合成中发挥关键作用,因此其蛋白水平对维持正常DNA复制至关重要。作者通过免疫印记实验确认RRM1在白喉酰胺缺失细胞中的水平下调,并发现此区别并不通过转录或蛋白质降解影响。他们随后设计了一个双荧光素酶报告体系来检验RRM1是否通过-1移码调节。将RRM1预测的-1移码序列插入报告体系后,结果表明RRM1在白喉酰胺缺失细胞中的-1移码水平上调。最后,作者通过敲除与回补实验验证RRM1蛋白水平降低是白喉酰胺缺失导致DNA复制压力升高的重要因素(图4)。
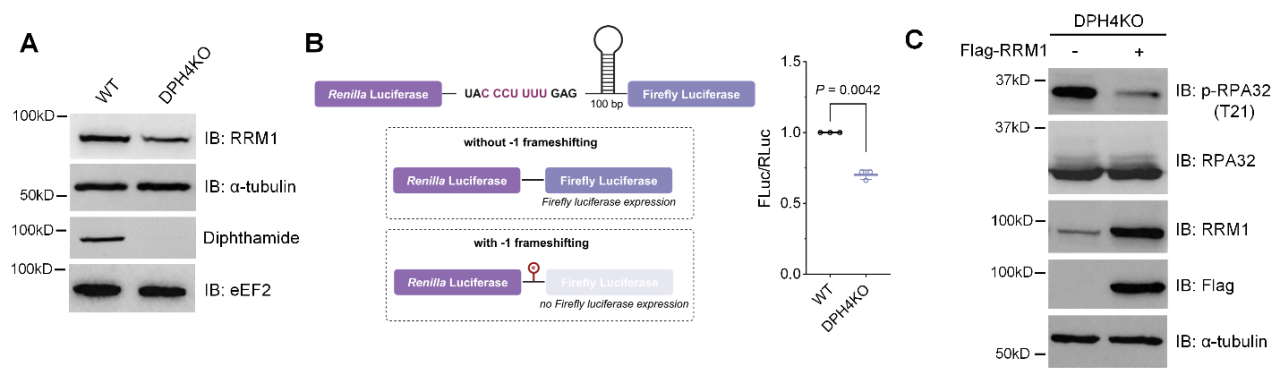
图4. 白喉酰胺缺失通过影响RRM1的-1移码增加细胞DNA复制压力。
总结与展望
作者通过计算与实验相结合的方法,验证了蛋白RRM1的翻译过程受到白喉酰胺通过-1移码的调节,从而影响细胞内的DNA 复制压力,为白喉酰胺与癌症的关系提供了新的视角。这一发现也为进一步研究-1移码是否为一种普遍存在于人体细胞中的调节机制提出了可能性。因此,研究并开发更准确的-1移码信号预测方法和实验验证手段,将帮助进一步深入理解这一过程及其潜在的生理和病理学意义。
通讯作者信息
林合宁 博士
林合宁博士于 1998 年获得清华大学化学学士学位,2003 年获得纽约哥伦比亚大学生物有机化学博士学位。在哈佛医学院完成博士后研究后,他于 2006 年成为康奈尔大学化学与化学生物学系的教员,并于 2024 年调至芝加哥大学。他的实验室研究酶的化学、生物学和治疗靶向性,特别是控制蛋白质翻译后修饰的酶。他获得的奖项包括 Jane Coffin Childs 奖学金、Camille 和 Henry Dreyfus 新教师奖及美国化学学会辉瑞酶化学奖。他自 2015 年起担任霍华德休斯医学研究所研究员。他曾担任 eLIFE 的评论编辑,现担任 ACS Chemical Biology 的副主编。他是 Sedec Therapeutics 的创始人和顾问。
扫描二维码免费下载全文,或点此查看原文

ACS Cent. Sci. 2024, ASAP
Publication Date: September 6, 2024
https://doi.org/10.1021/acscentsci.4c00967
© 2024 The Authors. Published by American Chemical Society


Editor-in-Chief
Carolyn R. Bertozzi
Stanford University

Deputy Editor
Kirk S. Schanze
University of Texas at San Antonio College of Sciences
ACS Central Science 出版有关化学及其相关领域最引人注目的研究成果,其中化学方法起到关键作用。同时, ACS Central Science是美国化学会出版的第一本完全开放获取期刊,旨在探讨化学基础领域的重要进展,以及应用和跨学科研究,重点介绍化学在其他众多科学学科中的重要作用。
2-Year Impact Factor
CiteScore
Time to First Peer Review Decision
12.7
25.5
41.6


如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号