“酯基活化”——上海交大吴华课题组JACS:烯胺酰化实现丙二酸酯的去对称化
不对称烯胺烷基化是立体选择性构建碳-碳键的重要工具,相比之下,发展对映选择性烯胺酰基化反应却十分困难。近日,上海交通大学吴华课题组报道了原位生成的烯胺中间体在手性酸催化下能够进行立体选择性的α-碳酰化反应,高效构建含四取代立体中心的吡咯啉酮和吲哚啉酮衍生物。通过去对称化策略和双功能有机催化剂的有效结合,利用简单易得的氨基丙二酸酯和环状酮化合物首次实现了对映选择性烯胺酰化反应。该工作使用低亲电性的普通酯基作为酰化试剂,替代了活性高、不易兼容且对湿度敏感的酰氯,并通过氢键活化作用实现了高立体选择性控制。该反应被成功应用于手性生物分子探针(+)-LipidGreen I和II的简洁合成,并通过控制实验和DFT理论计算对反应机理和立体选择性控制过程进行了深入研究。该研究成果近日发表于J. Am. Chem. Soc.。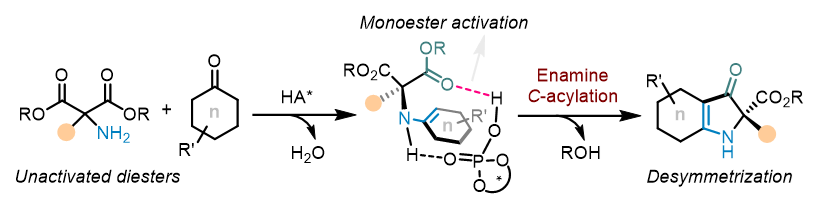
烯胺已被广泛应用于不对称催化中,通过活化α-碳作为亲核试剂,可以与一系列亲电试剂进行1,2-加成、Michael加成或取代反应。在此背景下,各种高亲电性的醛、酮和亚胺类化合物经常被用作底物或活性中间体,与预先构建的或原位形成的亲核性烯胺进行对映选择性Aldol或Mannich反应。相反,作为一种潜在的亲电试剂,易官能化的酯基在烯胺的不对称催化领域则未见报道(图1A)。事实上,未活化的酯一般具有较弱的亲电性,通常只与强亲核试剂反应,如胺、醇盐、氢化物、烯醇负离子和有机金属试剂等。尽管手性路易斯酸和布朗斯特酸能够通过降低LUMO能量来激活酯基,但增强的亲电性不足以确保Csp2-H对酯基部分直接进行1,2-加成。此外,由于N-和C-酰化产物都可能产生,导致烯胺酰化的区域选择性控制也是一个潜在难题。最后,在亚胺-烯胺互变异构过程中,C-酰化途径上生成的新立体中心很容易消旋化或消失(图1A)。理想情况下,不对称去对称化策略可以解决这个问题,然而在烯胺化学中,构建远程立体中心比目前已经得到充分研究的α-立体中心形成更具挑战性。
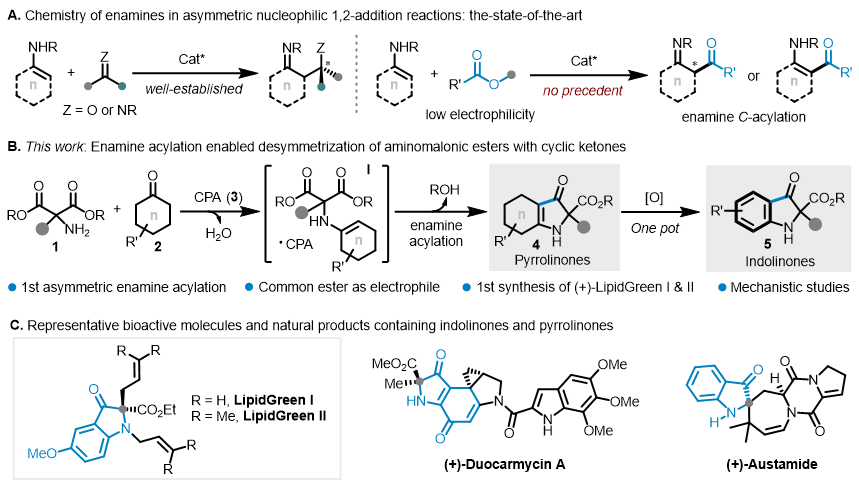
图1. 烯胺化学的研究现状及设计思路
上海交通大学吴华课题组专注于杂环合成及杂环编辑研究,近期开发了催化不对称环化重排(CACR)策略,并基于此,实现了一系列含氮季碳立体中心杂环骨架的高效构建 (Angew. Chem. Int. Ed., 2023, 62, e202217954; Angew. Chem. Int. Ed., 2023, 62, e202313797; Angew. Chem. Int. Ed. 2024, 63, e20231718; Adv. Sci. 2024, 11, 2402532),这些研究均涉及少见的酯基迁移过程。近日,该小组在普通酯基的活化方面取得了进展,基于去对称化策略和有机催化模式,首次实现了烯胺的不对称α-碳酰化反应,构建了一系列手性含氮季碳中心。该转化使用低亲电性的普通烷基酯作为酰化试剂替代易潮解、高活性、兼容性差的酰氯试剂,通过手性酸的双氢键作用实现了高立体选择性控制。基于此方法,高效构建了一系列具有四取代立体中心的吡咯啉酮和吲哚啉酮衍生物,并实际应用于手性生物荧光探针(+)-LipidGreen I & II的简捷合成(见图1)。
作者以4,4-二甲基环己酮和苄基取代的胺基丙二酸酯为起始原料,通过筛选温度、手性磷酸催化剂、溶剂和添加剂等一系列条件,最终以91% yield,94% ee的最优结果获得四取代吡咯啉酮产物。接下来作者首先对胺基丙二酸酯底物的普适性进行了考察(图2)。结果表明,苄基苯环上不同电性和不同位置的取代基,都能以优异的结果得到目标产物。除此之外,直链烷烃、大位阻烷烃、烯丙基、炔丙基、苯炔丙基都能很好的兼容,以优异的收率和对映选择性得到相应的吡咯啉酮产物。值得注意的是,通过更换手性酸,除了烷基取代基,苯基也能以83% ee得到相应产物。另外,其他不同类型的烷基酯都能够很好的参与反应。接下来,作者对环酮底物进行了考察(图3)。结果发现,环己酮作为底物时,能得到优异的收率和对映选择性。当环己酮对位上有其他取代基,如氟、酯基时,该反应也能够顺利发生。值得注意的是,含硫环状酮也能很好的参与反应。当环庚酮作为反应底物时,产物的对映选择性稍有下降。
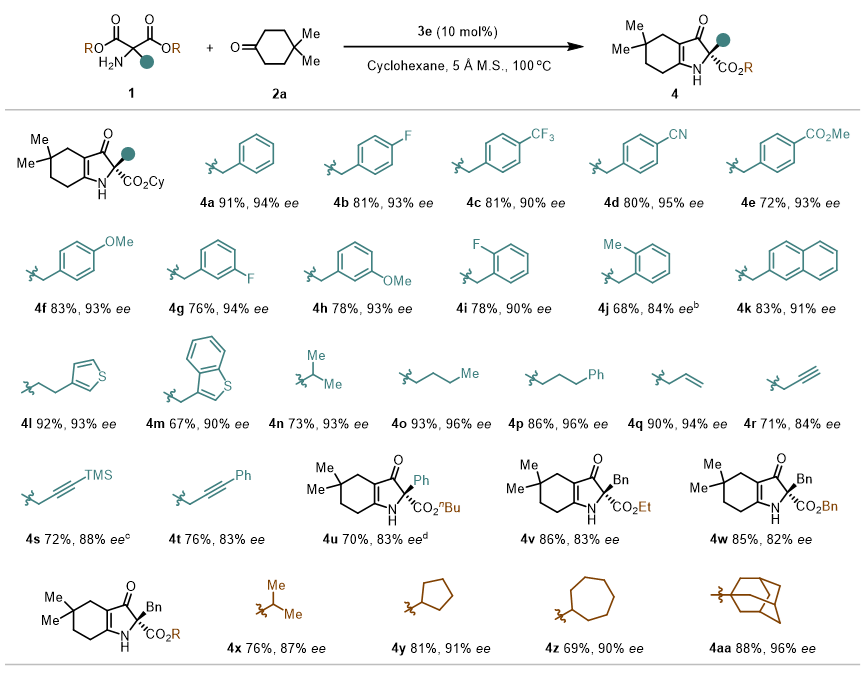
图2. 底物拓展
手性2,2-双取代吲哚酮是一类重要的杂环骨架,广泛出现在天然产物和生物活性分子中,然而此类骨架的不对称从头构建方法却仍然少见。作者发现,将形成的吡咯啉酮进行一锅原位氧化可以高效构建各种手性吲哚酮衍生物。随后,作者对一系列市售的对位单取代环己酮底物进行了考察发现,无论是强吸电子取代基(如三氟甲基、酯)、还是富电子取代基(甲氧基)以及对位芳基/烷基取代的环己酮都可以以良好的总收率和高对映选择性得到相应的吲哚啉酮产物。值得注意的是,在氧化芳构化至吲哚啉酮之前,相应的吡咯啉酮产物也可以以高产率、中等非对映选择性和高对映选择性(89% yield,2:1 dr,93% ee/88% ee)分离出来。作者通过X射线单晶衍射确定了产物的绝对构型。
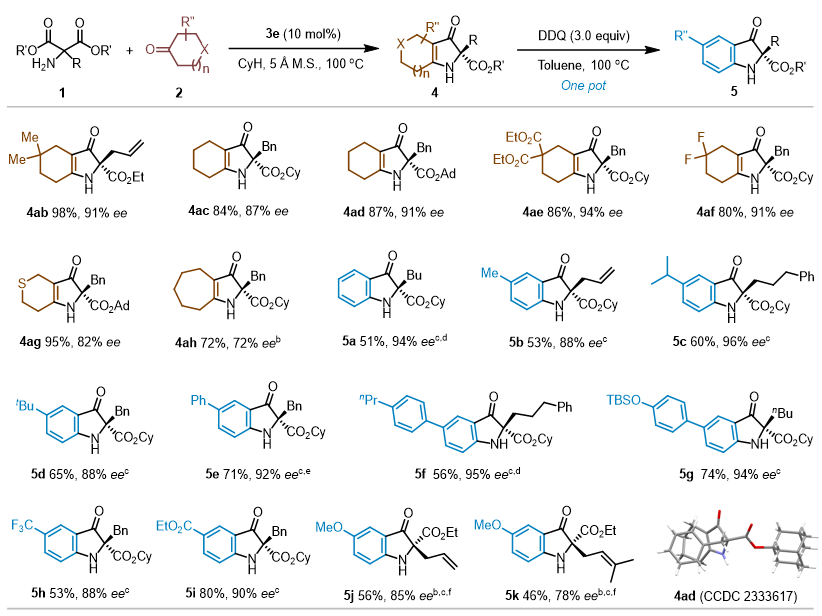
图3. 底物拓展
接下来,作者对反应的应用性进行探索(图4)。首先,克级规模实验几乎得到了相当的收率和对映选择性。LipidGreen I & II是一类非常重要的生物荧光探针分子,以往的合成方法一般需要七步之多,且只能实现消旋体的合成,而作者利用新开发的去对称化策略,仅通过三步反应便简捷、高效地实现了手性荧光探针(+)-LipidGreen I & II的首次不对称催化合成,不仅大大缩短了合成步骤,而且为新型手性荧光探针分子开发提供助力。
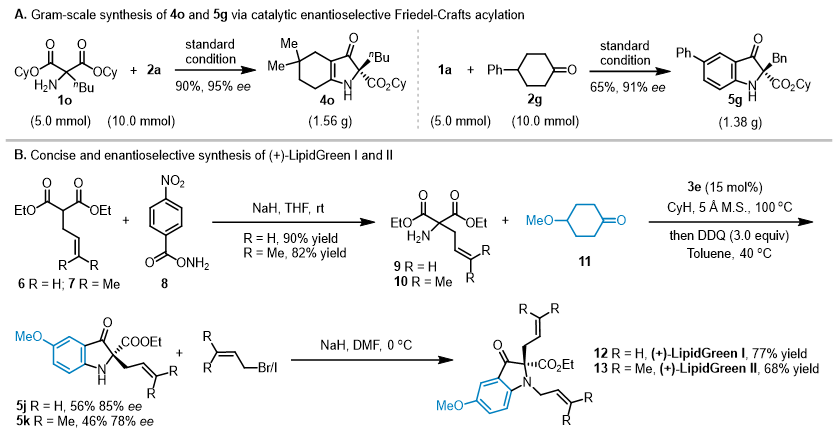
图4. 克级反应及衍生化
随后,作者进行了一系列控制实验的研究(图5)。作者首先合成了N-苄基取代的底物14,在模板反应条件下,没有目标产物生成,这表明原位形成的烯胺和双官能催化剂之间的氢键对于反应的转化有着非常重要的促进作用。此外非线性效应揭示了产物和催化剂的对映体纯度之间存在线性关系,表明单个催化剂参与了对映选择性决定步骤。值得注意的是,作者发现在某些特定情况下,形成的亚胺中间体会直接发生Pictet-Spengler反应,以高收率得到相应的螺环产物。
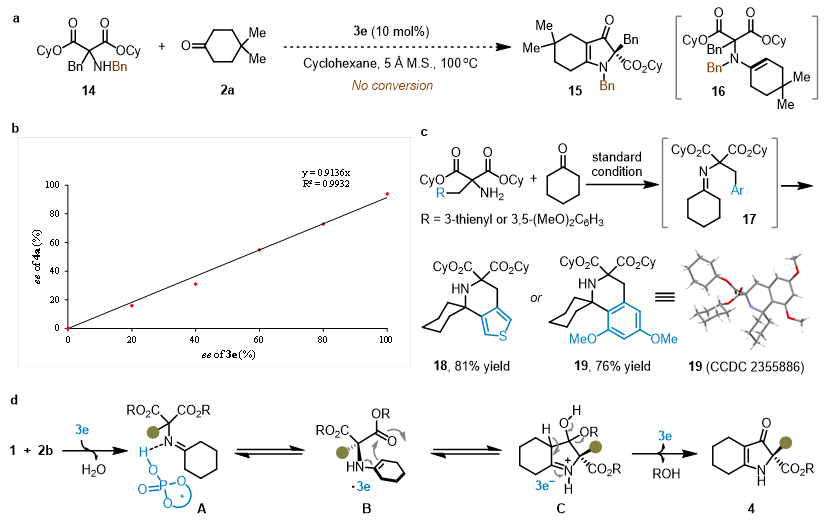
图5. 控制实验及机理研究
为了进一步理解该类反应机理,作者对反应历程进行了密度泛函理论(DFT)计算。作者选择了模板底物1a和2a,最优催化剂3e进行计算研究。如图6所示,由3e和INT-1形成独特的氢键复合物INT-2,净释放自由能(5.9 kcal/mol),表明手性酸3e可以显著稳定这种烯胺化合物。值得注意的是,由于空间位阻效应,INT-2中只有一个酯基能进入催化剂3e的特定手性口袋,因此手性磷酸通过氢键只活化其中的一个酯基。随后,烯胺通过过渡态TS对丙二酸酯的亲核攻击会产生四种非对映异构体,包括INT-RSR、INT-SRS、INT-RSS和INT-RRR。通过理论计算表明,亚胺中间体INT-RSR的自由能势垒为17.5 kcal/mol,为最优路径,而 INT-SRS、INT-RSS、INT-RRR则比INT-RSR分别高5.8 kcal/mol、19.5 kcal/mol和24.4 kcal/mol。
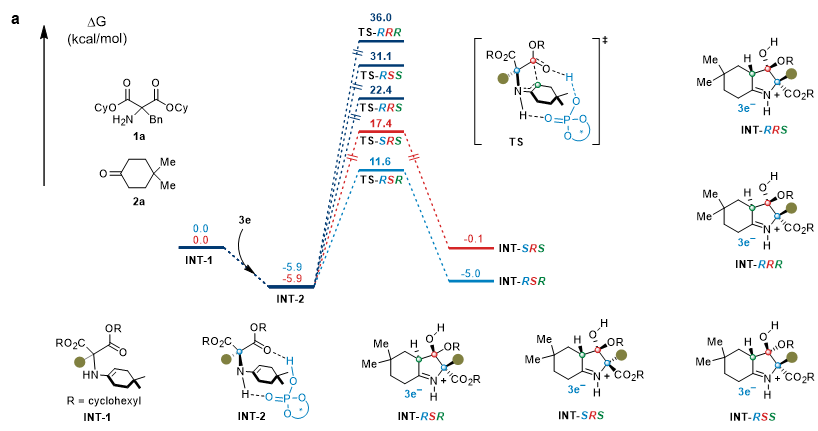
图6. DFT计算研究
综上所述,吴华课题组基于不对称去对称化策略和有机双功能催化剂有效结合的方式,实现了首例对映选择性烯胺C-酰化反应。该方法从简单易得的氨基丙二酸酯和环状酮出发,为含有四取代立体中心的手性N-杂环的合成提供了一种高效途径。手性酸通过与原位生成的烯胺中间体的双氢键作用实现了优异的立体选择性控制。同时,克级反应以及生物探针分子(+)-LipidGreen I和II的首次不对称、简捷合成也体现了该反应的实际应用价值。这种方法不仅有效拓展了传统烯胺化学的适用范围,而且为涉及酯基的有机催化反应的发展开辟了新路径。这一成果近期发表在J. Am. Chem. Soc.,上海交通大学药学院为第一通讯单位。该工作得到了国家自然科学基金委、国家相关人才计划、上海交通大学启动资金和药学院的大力支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enamine Acylation Enabled Desymmetrization of Malonic Esters
Yu-Ping He, Zhuo-Chen Li, Zi-Qi Wang, Wen-Ya Zheng, Hua Wu*
J. Am. Chem. Soc., 2024, 146, 26387–26396, DOI: 10.1021/jacs.4c09276
研究团队简介

吴华,课题组长,博士生导师,长聘教轨副教授,入选国家高层次青年人才计划、上海市高层次青年人才计划。博士毕业于中国科学技术大学(导师:龚流柱教授);瑞士洛桑联邦理工学院从事博士后研究(导师:Jieping Zhu教授);2021年5月全职加入上海交通大学药学院。主要研究兴趣包括:重排化学、杂环化学、高效催化剂及新催化体系开发;近两年以通讯作者身份在JACS(1篇),Angewandte(3篇),Advanced Sciences(1篇)等国际权威刊物上发表独立研究工作论文7篇。获2024年度“Thieme Chemistry Journal Award”、校青教赛二等奖、中科院院长奖、兴业责任奖等,主持基金委面上项目、青年项目等,担任《Chinese Chemical Letters》青年编委等。
热忱欢迎对课题组研究方向感兴趣的优秀本科生、硕士生、博士生、博士后及研究助理加入课题组。
联系方式:
hua.wu@sjtu.edu.cn
课题组主页:
https://www.x-mol.com/groups/wu_hua
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号