双环丁烷与亚胺不对称(3+2)环加成反应合成手性生物电子等排体
注:文末有研究团队简介及本文作者科研思路分析
早在上世纪90年代,药物化学研究表明使用双环[1.1.1]戊烷对苯环进行等排置换不仅可以改善药物的水溶性、脂溶性和代谢稳定性等药代性能,而且可以突破专利壁垒创制新药。2009年,Frank. Lovering提出“逃离平面”的药物设计理念,在这一理念的启发下,最近利用三维刚性结构的双环[n.1.1]烷烃衍等排置换二维平面的芳烃的研究又慢慢的复兴起来。在张力环系统中,双环[1.1.0]丁烷(BCB)是最小的双环碳环,也是已知张力最大的碳环之一(63.9 kcal/mol)。尽管 BCB 的合成和研究已有 50 多年的历史,但它们长期以来一直被视为实验室的新奇事物。在Blanchard、Glorius、Wipf、David C. Leitch、李鹏飞(西安交通大学)、陆平(复旦大学)、邓力&倪冬顺团队(西湖大学)、邓卫平(浙师大药物创新研究所)、王洪根(中山大学)、周岭(西北大学)、郑军(华东理工)、石磊(大连理工)、彭士勇(五邑大学)等国内外学者的创新性研究下BCB的环加成反应已经成为构建双环[n.1.1]烷烃的重要手段(图1B)。但是上述合成的双环[n.1.1]烷烃主要为非手性分子或者外消旋体。这显然难以满足新药研发对手性生物电子等排体的需求(图1A)。
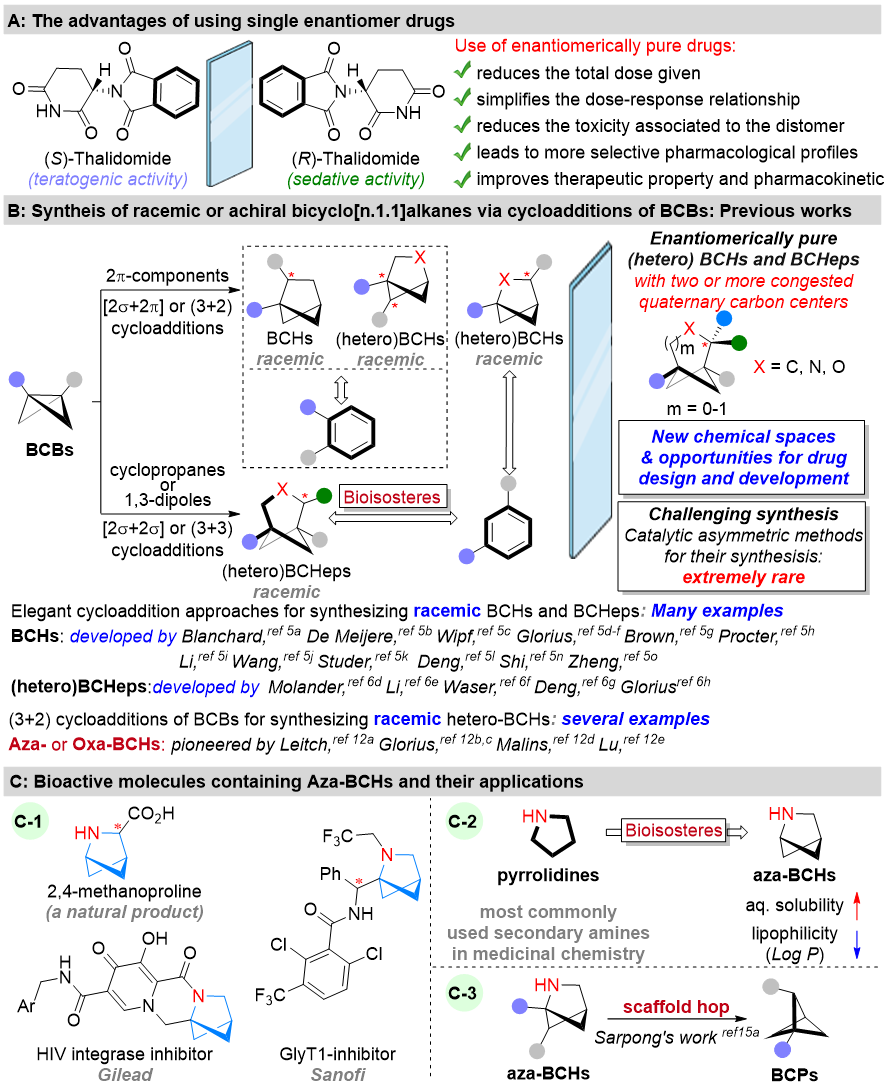
图1. BCB环加成反应研究背景
刚性的氮杂-双环[2.1.1]己烷(Aza-BCHs)不仅作为四氢吡咯的生物电子等排体且在活性药物中普遍存在,另外可以作为合成子,通过骨架编辑来制备多取代的双环[1.1.1]戊烷(BCPs 此分子可作为苯的生物电子等排体)。但是缺乏相应的不对称催化合成方法阻碍了其在新药以及手性药物的研发(图1C)。
湖南大学冯见君教授课题组聚焦双环丁烷(BCB)的开环和环化反应以及桥环生物电子等排体的设计合成研究。2023年10月该课题组博士研究生吴峰和博士后武文彪率先实现了锌路易斯酸催化BCB与亚胺的不对称(3+2)环加成反应构建手性的Aza-BCHs分子。在作者文章的同行评审过程中,德国著名化学家Thorsten. Bach报道了光诱导的首例单取代BCB酮与2(1H)-喹诺酮(或喹诺啉酮)的对映选择性环加成,但是却需要化学计量的手性模板(图2A)。河南师范大学江智勇课题组创制了光催化与手性磷酸催化体系诱导BCB与乙烯基氮杂芳烃的不对称(3+2)环加成反应(图2B)。另外,湖南大学冯见君课题组(J. Am. Chem. Soc. 2024, 146, 19621)和山东大学李孝训课题组分别报道了钯和铜催化双环丁烷不对称(3+3)环加成反应。但是迄今通过路易斯酸活化BCB来引入手性环境进而实现不对称诱导的环加成策略只有一例报道(Angew. Chem. Int. Ed. 2024, e202408578)。这类路易斯酸催化BCB的不对称环加成反应的挑战主要有:(1)只含有单拉单子取代基的BCB底物难于形成具有稳定螯合配位的手性环境;(2)在强的外消背景反应条件下难以高选择性构建2个季碳,且需同时实现手性三级碳中心的合成。为此,冯见君教授课题组设计合成了一系列含酰基咪唑基团的BCB底物,设想利用双齿螯合基团与手性路易斯酸螯合配位从而实现不对称诱导环化(图2)。

图2. BCB的不对称(3+2)环加成反应
基于上述设想,作者以含酰基咪唑基团的BCB和炔基亚胺为模版底物,通过大量的条件筛选获得了最优条件:Zn(OTf)2/Ph-BOPA为手性催化体系,在乙酸乙酯中室温下反应24小时。在温和条件下,一系列亚胺便可与BCB底物顺利进行不对称(3+2)环加成反应,产率高达94%,对映选择性可达96.5:3.5 er。在获得最佳反应条件后,首先对亚胺底物的兼容性进行考察,亚胺上氮的取代基不仅可以为带有吸电子(如:酯基、氰基、卤素等)的芳基,而且N-苄基炔基亚胺底物也能很好进行兼容,并以82%产率和90% ee得到aza-BCH产物3cj。该底物普适性突破了2022年由David C. Leitch发展的Ga(OTf)3催化的N-苄基亚胺的外消反应的底物范围。此外,作者还对炔基上的取代基团进行了考察,例如芳基、杂芳基、链烷基、环烷基以及硅基取代的炔基亚胺均能以高的产率和优秀的对映选择性得到aza-BCH产物(3ck-3cq)。值得一提的是:尽管苯基亚胺底物(3ar)在反应条件下的ee值高达91%,但是产率却有待提高(图3)。
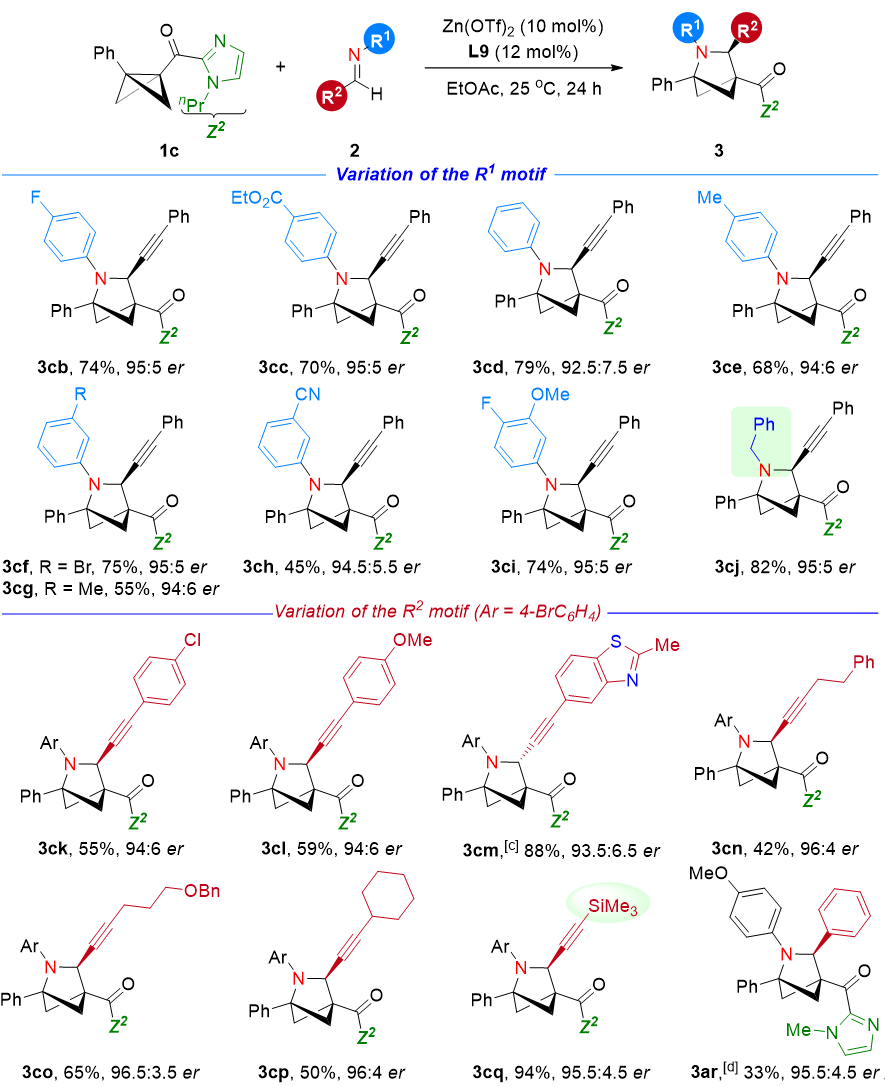
图3. 不对称(3+2)环加成反应亚胺的普适性考察
接下来作者对于BCB的普适性进行了考察,对于BCB桥头苯环上的邻、间、对位有卤素、烷基、OCF3和CF3基团时,该(3+2)环加成反应都能以良好的产率以及优秀的ee值得到目标产物。与大多数不对称催化反应一样,邻位有取代基时,会导致ee值下降。同时该反应不仅兼容芳基取代的BCB底物,当桥头取代基为甲基时,也可以56%的产率和83:17 er值得到目标产物3pa。在不对称催化体系下,对于不含双齿螯合基团的BCB酯和酮时,得到的均为外消旋产物(3qa,3ra);由Frank. Glorius发展的含有双齿螯合吡唑取代的BCB底物也观察到了6% ee的产物。这一结果进一步佐证了冯见君教授课题组提出的关于利用双齿螯合基团稳定手性诱导环境,从而实现路易斯酸催化BCB不对称环加成反应的设想。
值得注意的是:不同于之前David C. Leitch和Frank. Glorius关于路易斯酸催化BCB开环产生碳正离子中间体后在与亚胺以及醛的外消环加成反应机理,其中当该不对称催化反应中,苯环上取代基的电子效应对反应的产率影响不大(3na versus 3oa),这表明该反应可能经历了一个不同的反应机制(图4)。
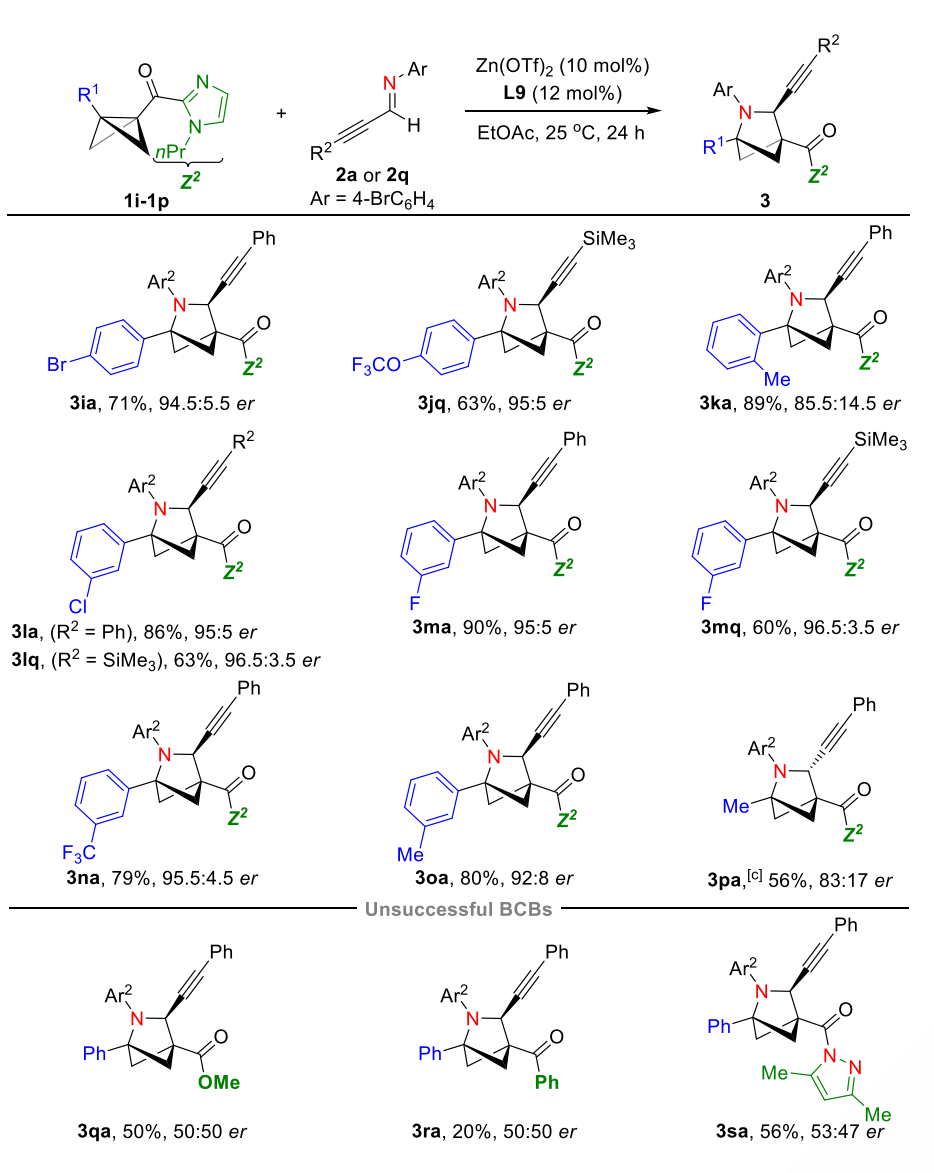
图4. 不对称(3+2)环加成反应BCB的普适性考察
此外,为了深入研究该反应的机理,在南京大学王国强教授DFT计算研究的帮助下,作者提出了如图5所示的反应可能机理,以及该过程手性控制的关键因素。通过计算表明:在路易斯酸活化下,该不对称(3+2)环加成反应中,BCB桥联C-C键的断裂经历了一个亲核协同开环的路径,而非之前David C. Leitch和Frank Glorius提出的涉及苄基碳正离子的分步开环过程。
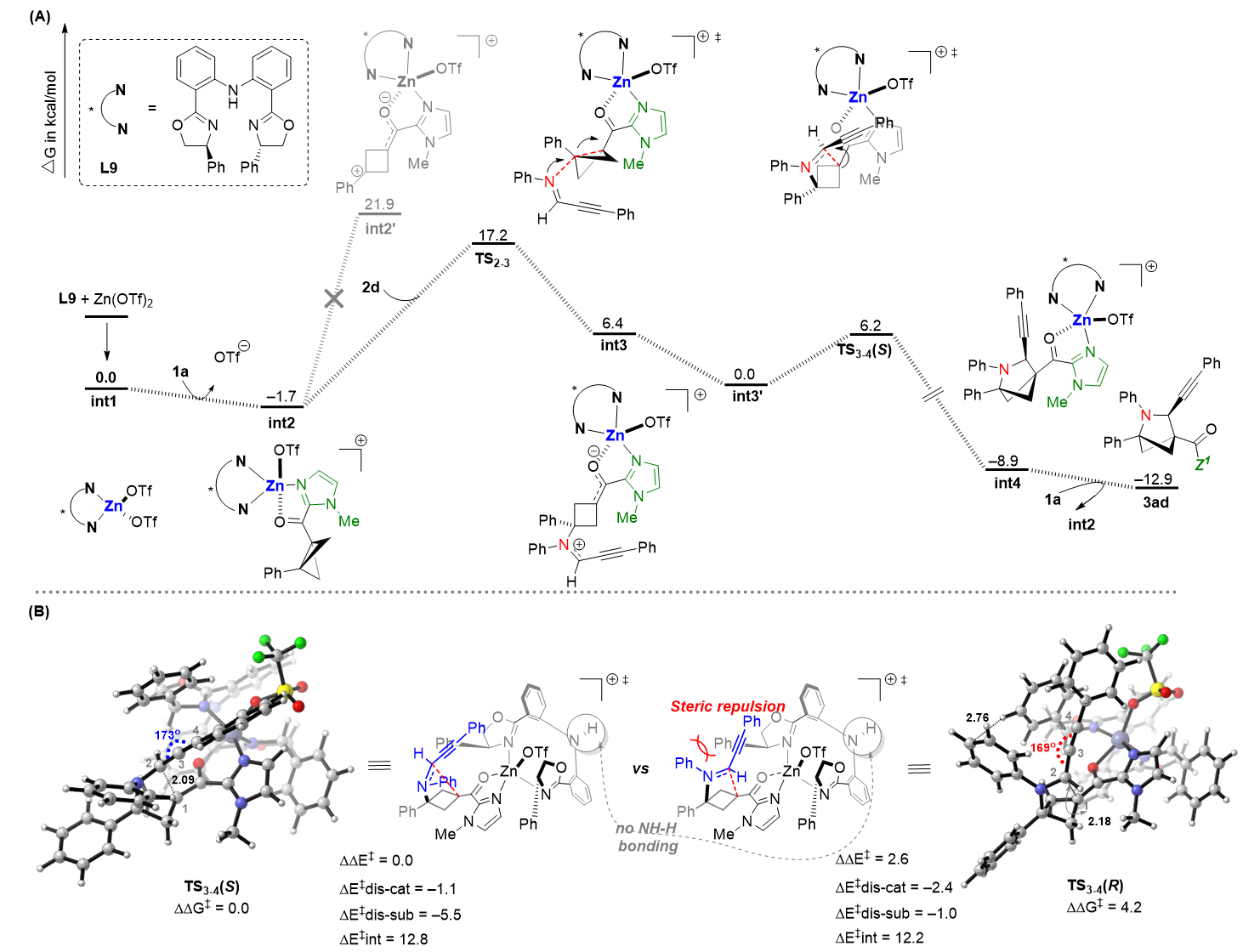
图5. 反应机理
为了考察该方法学的实用性,作者又进行了1.0 mmol的放大实验,仍然可以83%的良好产率以及90% ee值得到环加成目标产物3cq。环加成产物中的炔基、羰基等官能团的引入,可以方便的为后续官能团化转化提供便利,从而合成一系列手性的aza-BCH衍生物。此外,利用炔基与叠氮发生的click反应,作者将aza-BCH单元顺利地引入到治疗皮肤病的药物分子阿达帕林(adapalene)、以及抗生素和抗原虫剂甲硝唑(metronidazol)的分子骨架中,进一步展示了该方法学潜在的应用价值(图6)。
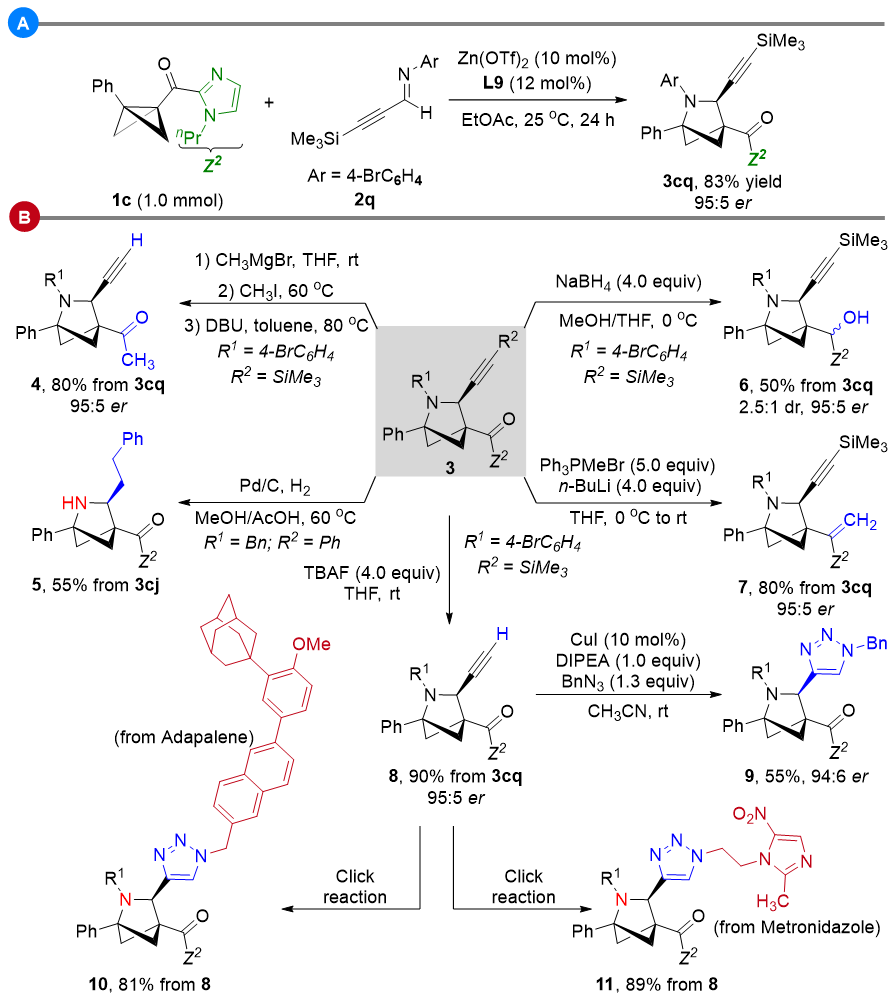
图6. 放大实验与合成转化
综上所述,冯见君教授课题组开发双齿螯合BCB底物来稳定手性诱导环境的策略,发展了Zn/Ph-BOPA手性路易斯酸不对称催化体系,实现了BCB与亚胺的不对称(3+2)环加成反应,并通过实验与理论计算揭示了该反应的历程和不对称诱导机制,为药物研发中具有重要应用价值的氮杂-双环[2.1.1]己烷(Aza-BCHs)分子的高对映选择性(up to 96.5:3.5 er)合成提供了高效且原子经济性的合成方法。并让该方法学的发展成为后续路易斯酸催化BCB的不对称环加成反应提供了范式以及理论依据,还为后续相关手性生物电子等排体的合成及其在手性药物中的应用铺平了道路。这一成果近期发表在Angewandte Chemie International Edition 上,冯见君教授和南京大学王国强教授为本文共同通讯作者。湖南大学为第一完成单位。湖南大学博士研究生吴峰和博士后武文彪为文章的共同第一作者。上述研究工作得到了中央高校基本科研业务费和国家高层次人才青年项目和国家自然科学基金项目的经费支持。同时感谢评审专家提出的宝贵意见以及大力支持!
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Zinc-Catalyzed Enantioselective Formal (3+2) Cycloadditions of Bicyclobutanes with Imines: Catalytic Asymmetric Synthesis of Azabicyclo[2.1.1]hexanes
Feng Wu, Wen-Biao Wu, Yuanjiu Xiao, Zhenxing Li, Lei Tang, Heng-Xian He, Xue-Chun Yang, Ji-Jie Wang, Yuanlin Cai, Tong-Tong Xu, Jia-Hao Tao, Guoqiang Wang, Jian-Jun Feng
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202406548
冯见君教授简介

冯见君,湖南大学化学化工学院教授,博士生导师,德国洪堡学者,中国化学会高级会员。2007-2010年在华东理工大学学习(硕士学位导师:施敏研究员);2008-2010期间在中科院上海有机化学研究所联合培养(指导老师:段伟良研究员);2013年博士毕业于华东师范大学(师从张俊良教授);2013-2014年于上海药明康德新药开发有限公司担任有机合成高级研究员;2014-2017年获聘华东师范大学讲师、晨晖学者;2017-2020年获德国“亚历山大・冯・洪堡基金会(Alexander von Humboldt-Stiftung)”资助在柏林工业大学与Martin Oestreich教授合作开展有机硅合成研究;2021年入选国家高层次人才青年项目,主持国家级和省部级项目4项。现以通讯作者和第一作者在 J. Am. Chem. Soc.,Angew. Chem. Int. Ed.,ACS Catal.,Chem. Sci. 等期刊发表高水平论文40多篇。担任Nature Chemistry, J. Am. Chem. Soc.,Nature Communications, Angewandte Chemie, ACS catalysis, Organic letters等国际著名期刊审稿人。目前课题组在双环丁烷等张力环化学领域取得良好积累和多项成果。课题组长期招聘博士后、研究助理和访问学生。热忱欢迎热爱化学、努力工作、用心生活的同学加入本课题组共同奋斗和成长。同时期待与药物化学家们和制药企业开展生物电子等排置换的新药研发合作。
联系方式:
jianjunfeng@hnu.edu.cn
课题组主页:
https://grzy.hnu.edu.cn/site/index/fengjianjun
https://www.x-mol.com/university/faculty/26777
王国强教授简介

王国强,南京大学副教授。2016年在南京大学化学化工学院获博士学位,导师黎书华教授。2016-2020年在南京大学物理学院从事博士后研究,合作导师黎书华教授。2019-2020年赴德国柏林工业大学从事博士后研究,合作导师Martin Oestreich教授。2021年起任南京大学副教授。主要从事理论计算与数据驱动反应设计、人工智能辅助的化学合成等方面的研究。构建了自动化学反应设计、自动化学反应合成等技术与平台。主持国家自然科学基金委项目2项,以(共同)通讯作者、(共同)第一作者及在J. Am. Chem. Soc., Angew. Chem. Int. Ed., Nat. Commum., Chem. Sci., ACS Catal.等国际有重要影响力的学术期刊发表研究论文30余篇。
联系方式:
wangguoqiang710@nju.edu.cn
课题组主页:
https://www.x-mol.com/groups/wang_guoqiang/publications
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:自从20世纪60年代发生“反应停”事件以来,药物手性的研究在新药研发领域引起了极大关注。手性药物的研究已成为国际新药研究的主要方向之一。另一方面双环丁烷的环加成产物—双环[n.1.1]烷烃是芳烃和杂芳烃的有效生物电子等排体。但是将富含C(sp3)的双环[n.1.1]烷烃用于药物设计时将不可避免地引入手性碳。因此,如何合成手性的双环[n.1.1]烷烃作为芳烃和杂芳烃的手性生物电子等排体成为双环丁烷的环加成化学发展道路上的“拦路虎”。
我们课题组的一个方向就是拓展路易斯酸催化的BCB的偶极环加成反应类型并发展其不对称催化版本。考虑到酰基BCB的特殊结构不能像供体-受体环丙烷那样通过螯合效应形成稳定的手性诱导环境,我们设计合成了一系列含酰基咪唑基团的BCB底物,设想通过引入双齿螯合基团与手性路易斯酸配位进而实现不对称诱导。
Q:研究过程中遇到哪些挑战?
A:(1)不同于供体-受体环丙烷具有偕二羰基与手性路易斯酸螯合配位形成有效的手性诱导环境,含单拉单子基团的BCB底物难于形成稳定的手性环境;
(2)该反应背景反应较强,能否找到合适的手性配体来实现对映选择性控制是我们面临的另一个挑战;
(3)我们起初选用芳基亚胺为模版底物。尽管该底物ee值较高,但是产率很低。如何兼顾产率和选择性是我们在底物扩展中的遇到的挑战。庆幸的是我们发现使用活性相对较高的炔基亚胺时,则可实现产率和选择性的统一。并且炔基的引入利于环加成产物的后续衍生化。
(4)同时构建两个密集的季碳中心和一个手性氮杂三取代碳中心在合成化学中仍然是一个很大的挑战。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:我们在这份工作中展示了通过双齿螯合型BCB稳定手性诱导环境进而实现BCB不对称环加成反应的可行性。这一研究成果将为后续路易斯酸催化BCB的不对称环加成反应提供范式以及理论依据,为后续相关手性生物电子等排体的合成及其在手性药物中的应用铺平了道路。我们期待与药物化学家们和制药企业开展生物电子等排置换的新药研发合作。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号