基于同核双硒族元素构建X射线响应性纳米药物用于增强肿瘤放疗
临床批准的前药通常需要肿瘤微环境的化学刺激来激活。然而,这种内源性化学激活方法可能会导致较差的反应活性和脱靶毒性。设计对外部刺激做出反应的前药有望解决这一瓶颈。放射治疗的普遍性、高组织穿透性使X射线成为控制药物释放的最佳外部刺激源,从而最大限度地提高局部疗效,克服传统药物的耐药性并降低全身毒性。
硒族元素(S、Se和Te)由于其增强的辐射而被探索作为肿瘤治疗中的氧化还原反应试剂。当前,基于硒族元素的X射线响应药物平台的研究不断涌现出来。因此,揭示硒族元素键对X射线辐射响应的敏感性差异和反应规律有助于指导药物设计原则,这对于开发临床应用的新型外部刺激的前药至关重要。
近日,暨南大学陈填烽教授(点击查看介绍)团队基于同核双硒族元素构建纳米递送体系,探索了其对X 射线响应性用于肿瘤治疗。在该研究中,三种同核单键即S-S、Se-Se和 Te-Te键被桥接到介孔二氧化硅中,分别构建出有机无机杂化的纳米前药DSMSN、DSeMSNs和DTeMSNs,并系统研究了三种纳米前药对X射线的响应性差异。基于它们的电负性、原子半径和键能(S-S,约 240 kJ/mol;Se-Se,约 172 kJ/mol;Te-Te,约126 kJ/mol)的差异,结果显示出对X射线不同的氧化敏感性和反应性(DTeMSNs > DSeMSNs > DSMSNs)。 经过X射线辐照后,DSMSNs 的形态几乎未发生变化, DSeMSNs出现部分裂解,DTeMSNs形貌则发生显著变化,且经过生化级联反应产生的TeO32- 能够进一步发挥化疗作用。
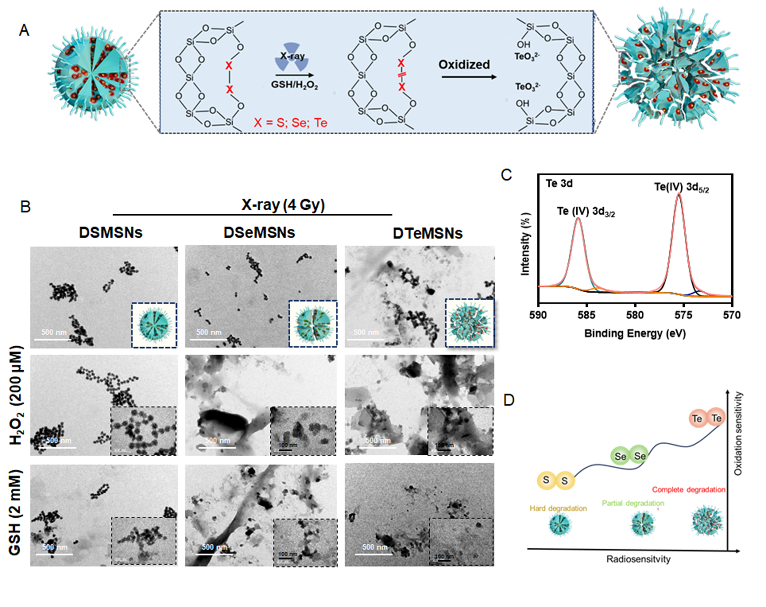
图1. DSMSN、DSeMSNs和DTeMSNs响应X射线断裂。
此外,作者将其作为药物载体负载二价锰离子(Mn2+,一种天然的干扰素基因(Sting)通路肿瘤免疫激活剂),构建出Mn-DSMSNs、Mn-DSeMSNs 和Mn-DTeMSNs,探索三种纳米载药体系中经过X射线辐照后释放Mn2+并激活Sting通路的差异的异同,探索其在肿瘤放化疗协同免疫治疗方面的潜力。
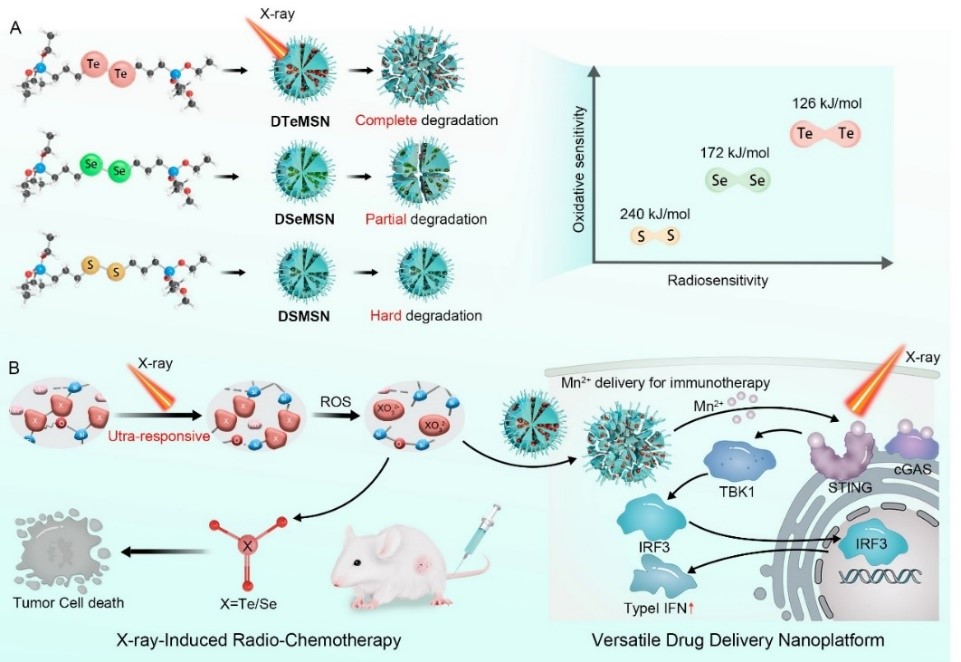
图2. X射线超响应同核硫基纳米前药促进肿瘤治疗。
该项研究加深了我们对硒族元素键对放射治疗的响应特性的理解,为开发新型基于外部刺激的纳米前药的设计提供理论参考。
这一成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是暨南大学尤媛媛博士和常兖州博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cleavage of Homonuclear Chalcogen-Chalcogen Bonds in a Hybrid Platform in Response to X-ray Radiation Potentiates Tumor Radiochemotherapy
Yuanyuan You†, Yanzhou Chang†, Shuya Pan, Qingyue Bu, Jiabao Ling, Weiling He*, Tianfeng Chen*
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202412922
陈填烽教授简介

陈填烽,暨南大学教授,国家杰出青年基金获得者、万人计划专家、国家863青年科学家、教育部新世纪优秀人才。陈填烽教授一直致力于以临床问题为导向的化学创新药物设计与诊疗应用研究,聚焦于人体必需微量元素,在肿瘤靶向化学创新药物、硒纳米医学、肿瘤多模态精准诊疗等方面进行了开创性的工作。在Nat Comm、Signal Transduction and Targeted Therapy、Matter、Sci Adv、J Am Chem Soc、Angew Chem Int Ed、Adv Mater等本领域IF>10期刊发表论文100篇,封面论文40篇,h-index 83,连续四年入选“中国高被引学者”榜单、全球顶尖10万科学家榜单。申报中国专利92项,授权国家发明专利42项,实现技术成果转化13项,并开展多中心临床研究。以第一完成人获得2020年高等学校科学研究优秀成果奖技术发明二等奖、2020年中国抗癌协会科技二等奖、2018年中华医学科技奖青年科技奖、2018广东省自然科学二等奖等科技奖励。
https://www.x-mol.com/university/faculty/26825
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号