Nat. Chem.:砜交叉偶联 vs 质子转移
副标题:环烷基砜的对映特异性交叉偶联反应
在过去的几十年里,交叉偶联反应已成为复杂分子合成和制药行业中最有效且应用最广泛的方法之一,例如:制药行业中62%的C-C键形成反应是通过交叉偶联实现的。就交叉偶联反应中的亲电组分而言,其潜在的底物范围仍然很广,包括:卤化物(Cl、Br 和 I)、三氟甲磺酸酯、甲苯磺酸酯、铵盐、醚和重氮取代基等(图1a)。另一方面,有机砜是交叉偶联反应中的一类新型亲电试剂,与硼烷类偶联试剂具有相似的优良性质,并且砜耐存储、易获得、具有高稳定性和高模块性。迄今为止,不少课题组报道了砜的交叉偶联反应,例如:1)Moran和Yorimitsu课题组分别利用芳基三氟甲基砜参与的Suzuki-Miyaura交叉偶联反应来制备不对称联芳烃;2)钮大文课题组发展了镍催化α-氧代乙烯基砜与芳基硼酸的交叉偶联反应,并化学选择性地生成芳基乙烯基醚;3)Baran、Koh和胡金波课题组分别证明了杂芳基取代的烷基砜可用于自由基交叉偶联反应。然而,自1979年化学家首次使用砜试剂以来,还尚未将其应用于对映选择性、对映特异性或对映汇聚式交叉偶联方面。
2014年,加拿大女王大学的Cathleen M. Crudden教授研究团队证明砜在金属催化的交叉偶联反应中既可以作为导向基团又可以作为亲电试剂,而且还能与芳基硼酸进行Pd催化的脱磺酰化偶联反应以及Ni催化叔砜的Suzuki-Miyaura交叉偶联反应(图1b)。在此基础上,近日,Cathleen M. Crudden教授与日本名古屋大学的Masakazu Nambo教授研究团队合作,利用Ni催化的Kumada-Tamao-Corriu偶联策略,成功地实现了手性环烷基砜与格氏试剂的对映特异性交叉偶联反应(图1c),并且实现高达99%的手性转移。原位监测表明,交叉偶联与竞争性去质子化在动力学上竞争占优,进而带来高对映选择性转化。相关成果于近日发表在Nature Chemistry 上。
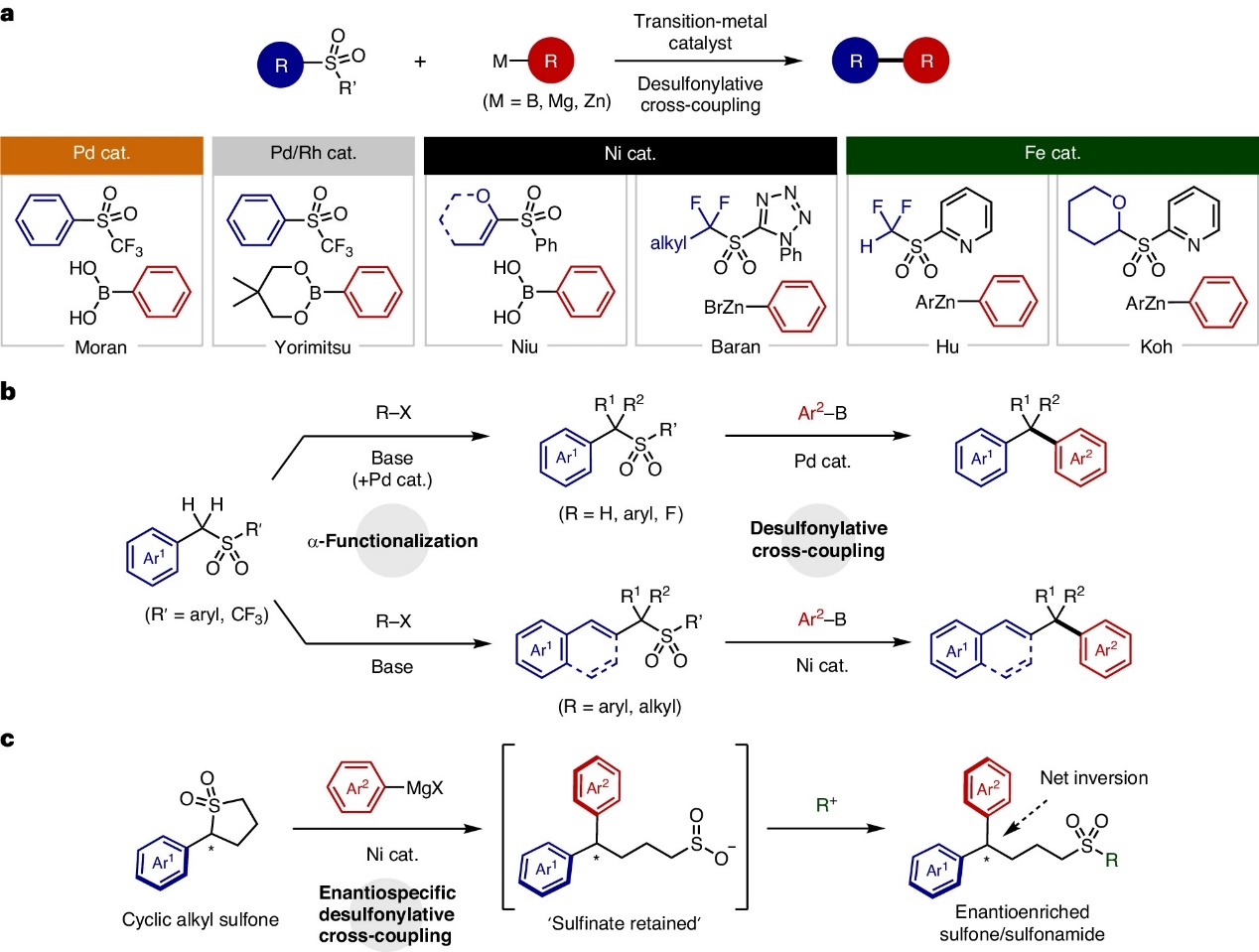
图1. 背景介绍。图片来源:Nat. Chem.
首先,作者选择萘基取代的砜rac-1a为模板底物对反应条件进行优化并用MeI捕获亚磺酸盐以获得无环砜3aa(图2),结果显示硼酸酯和锌酸盐进行反应时3aa产率较低,同时还得到了β-H消除的副产物4a;而PhMgBr(2a)能以中等的产率获得3aa且副产物4a最少。进一步筛选发现四甲基乙二胺(TMEDA)和2,2'-联吡啶(bpy)配体均能促进该反应,为此作者制备了混合配体N,N-二甲基-2-吡啶甲胺(DMPMA),能以77%的产率获得产物3aa。若用预形成的Ni(II)配位络合物[NiBr2(DMPMA)]2进行反应时能以83%的分离产率获得产物3aa。另外,对照实验表明镍预催化剂和配体至关重要,缺一不可。

图2. 反应发展。图片来源:Nat. Chem.
在最优条件下,作者对格氏试剂的兼容性进行了探索(图3,左),结果显示中性基团(如:苯基(3aa)、对甲苯基(3ab)、2-萘基(3ac)、对氟苯基(3ah)、3,5-二甲苯基(3ai))、大位阻基团(如:1-萘基(3ad)、邻甲苯基(3ae))以及供电子基团(如:p-甲氧苯基(3af)、m-甲氧苯基(3ag))取代的有机镁亲核试剂均能进行交叉偶联反应,以中等至良好的产率获得相应产物。然而,非芳基格氏试剂(如:PhCH2MgBr、allylMgBr、MeMgBr和OctMgBr)却由于自身碱性有利于去质子化而非交叉偶联,并且强吸电子基团(p-CF3)或体积非常大(Mes)基团取代的格氏试剂也不参与反应。其次,作者考察了砜的底物范围(图3,右),结果显示甲氧基(3ba)取代的五元环砜以及四元和六元环砜(3ia-3ja)均能实现这一转化,但是杂环体系或大位阻基团取代的底物(3ca-3ha)却效果不佳。最后,作者研究了亚磺酸盐捕获试剂的底物适用性(图3,底部),具体而言:1)一锅法以1 g级规模制备了萘基亚硫酸盐类似物5aa;2)交叉偶联产物与其它亲电试剂(如:烷基溴、烯丙基溴)进行反应时能以良好的产率生成二烷基砜产物6aa和7aa;3)与缺电子溴吡啶发生SNAr反应,以32%的产率得到杂芳基砜8aa;4)与SO2Cl2反应原位生成磺酰氯衍生物,随后用吗啉处理便可以47%的产率获得磺酰胺9aa。
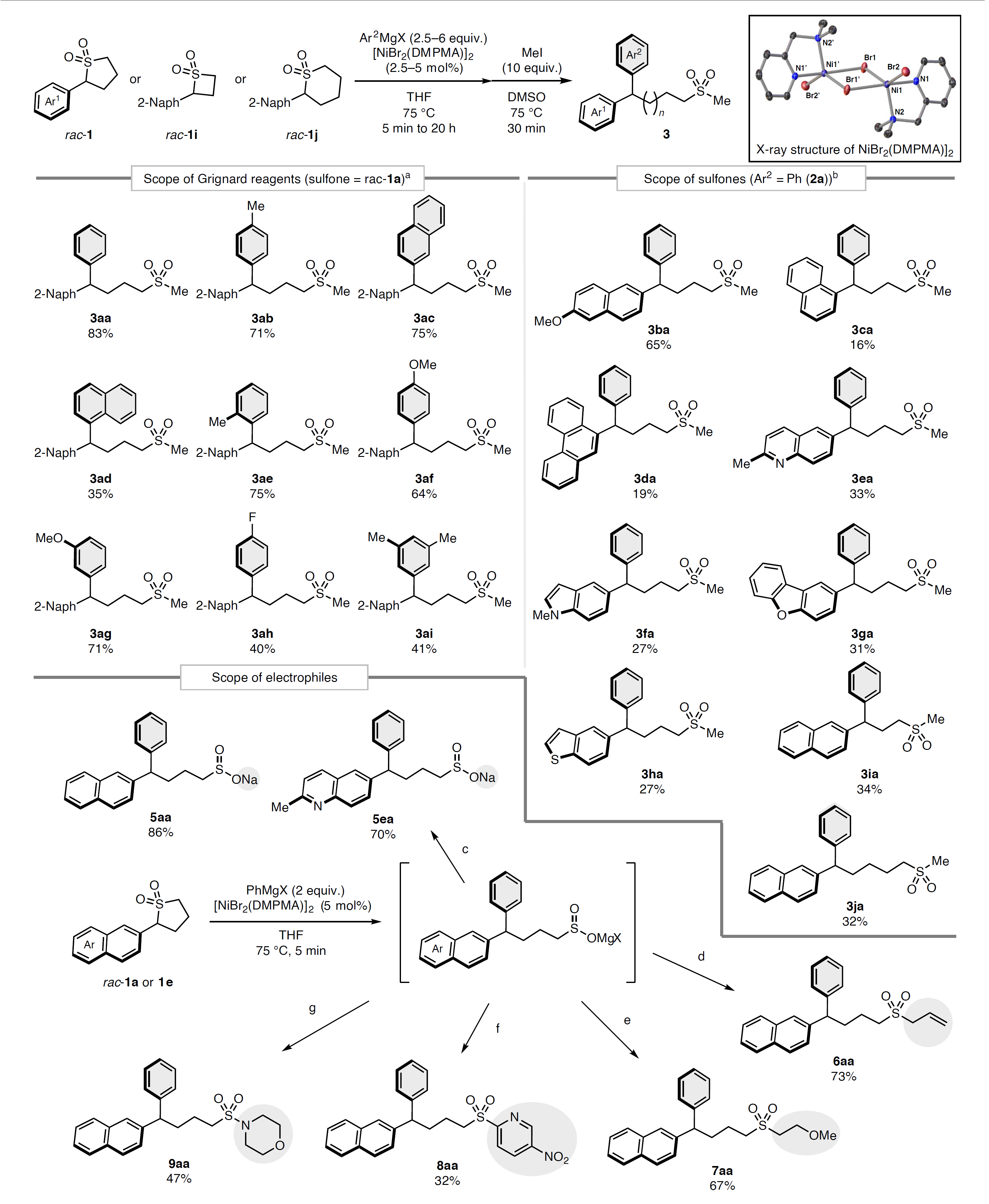
图3. 底物拓展和衍生化。图片来源:Nat. Chem.
接下来,作者试图实现手性底物的对映特异性交叉偶联反应,即通过Corey-Bakshi-Shibata还原制备二醇11,再经甲磺酰化、Na2S处理以及氧化三步便可获得对映体富集的砜 (S)-1a(87% e.e.,X-射线衍射分析确定构型),其与2a的开环芳基化反应能以≥99%的对映体特异性(e.s.)进行并获得相应产物 (S)-3aa(图4a)。此外,作者还通过独立路线制备 (R)-3aa来确定产物的绝对构型(图4b),具体而言:肉桂醛与萘基锌经[RhCl((R)-BINAP)]2催化的对映选择性芳基化反应、还原两步转化获得醛 (R)-16,再经卤化和Me2SO2同系化反应便可得到 (R)-3aa,其中产物的绝对构型通过中间体 (R)-17的XRD分析得以确认,e.e.值为>99%。通过比较两种方法制备的产物,作者发现Ni催化体系将 (S)-1a转化为 (S)-3aa时发生了构型翻转,这一结果与其它交叉偶联反应的报道相一致。如图4c所示,不同的有机镁试剂(2b和2f-2h)也能以良好至优异的对映体特异性获得相应产物,并且使用1a的(R)-或(S)-对映体时获得了相似结果。类似地,对映体富集的二取代环砜14也能以高对映特异性(>99% e.s.)和非对映特异性(>20:1 d.r.)转化为相应产物ent-15。
为了进一步探究反应机理,作者监测了(S)-1a和(R)-1a在类似条件下(反应温度降至30 °C)分别与2a或m-MeOC6H4MgBr(2g)的反应情况,并利用1H NMR和手性SFC分析研究了反应速率以及起始原料和产物的对映体纯度随时间的变化,结果显示在反应前5 min内,>90%的(S)-1a转化为(S)-3a且立体化学保留率>99%(图4d);而(R)-3ag则需要>45 min才能达到类似阶段且对映体特异性较低(79%,图4e)。值得一提的是,在75 ℃制备(R)-3ag要比30 ℃具有更高的对映体特异性(91% vs 79%)。进一步研究发现格氏试剂会促进底物的外消旋化,(S)-1a会在12 min内外消旋化,而且交叉偶联的速率与外消旋化相互竞争,进而解释了不同反应温度下对映体特异性存在差异的原因。
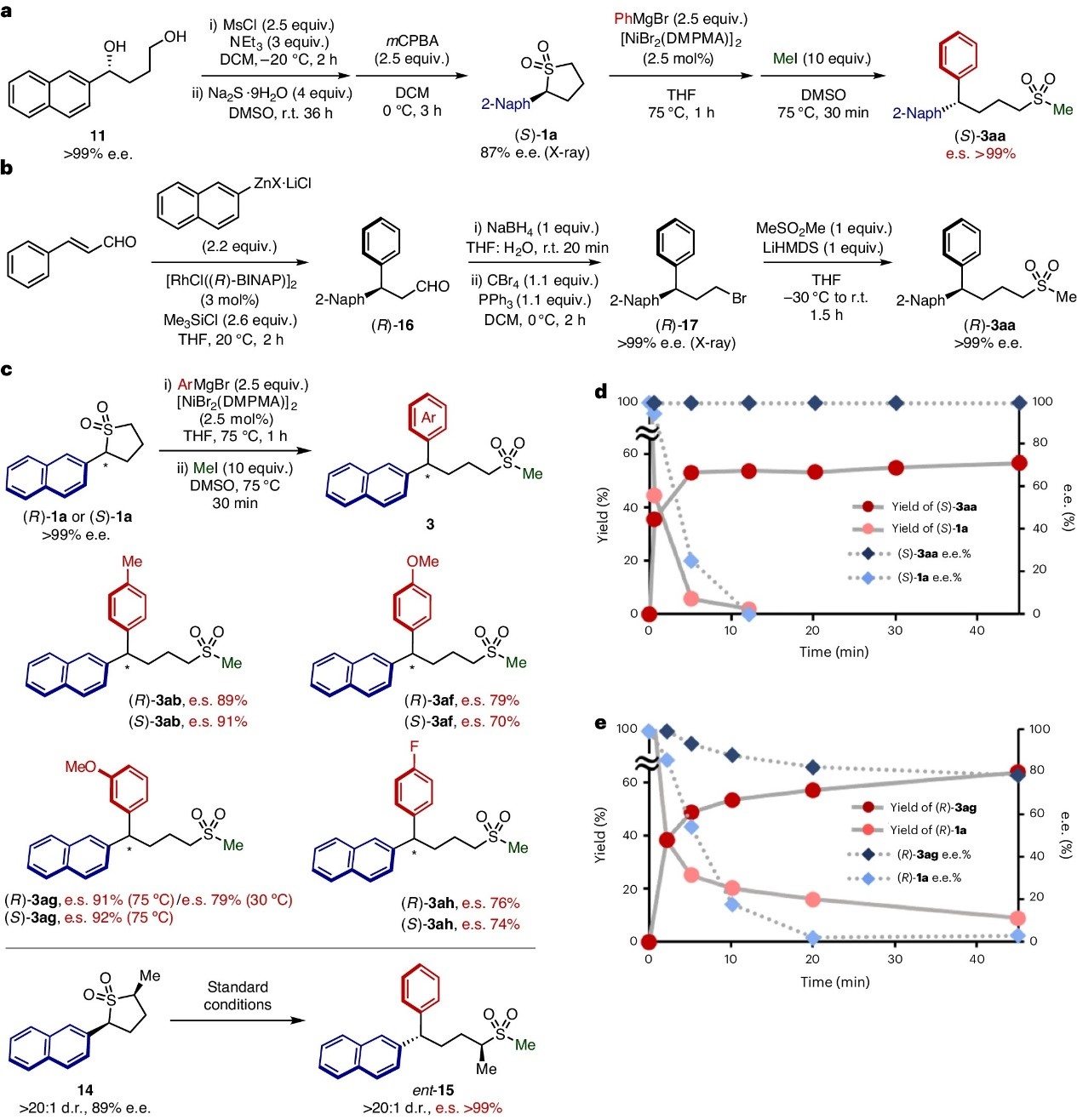
图4. 镍催化对映特异性的交叉偶联。图片来源:Nat. Chem.
在此基础上,作者提出了可能的反应机理(图5a):首先,镍预催化剂[NiBr2(DMPMA)]2与两当量格氏试剂进行反应,在消除同源偶联产物(联芳基) 后产生了具有催化活性的Ni0(DMPMA)物种。随后,α-萘基取代的环状砜(S)-1a在最具反应性的C(sp3)-SO2键处与Ni0(DMPMA)物种进行氧化加成并得到中间体I。由于转金属化和还原消除过程通常是在构型保留的情况下进行,因此反应的立体特异性可能是由氧化加成控制的。接着,氧化加成产物I/II与格氏试剂进行转金属化和还原消除并得到中间体IV,同时再生活性Ni0物种。最后,IV与MeI反应便可获得芳基化产物(S)-3aa。或者,中间体I/II可以进行β-H消除并在甲基化后产生4a。如图5b所示,作者还利用密度泛函理论(DFT)和耦合簇CCSD计算研究了该反应的对映选择性,结果显示溶剂化物种Ni0(DMPMA)(THF) 18与砜(S)-1a的萘基单元经π-络合作用形成 η2-络合物,其中syn-构象(19-syn)比anti-构象(19-anti)稍微稳定些,尽管这两种构象可通过键旋转相互转化。随后,这两种中间体的C-SO2键断裂并形成π-苄基镍环络合物20(经过渡态TSretention形成,ΔG0⧧=+18.2 kcal mol-1)或21(经过渡态TSinversion形成,ΔG0⧧=+14.9 kcal mol-1)。另外,Ni中心与过渡态TSinversion中磺酰基的反式共平面取向有望促进C-SO2键断裂,这与作者观察到的立体翻转相一致。
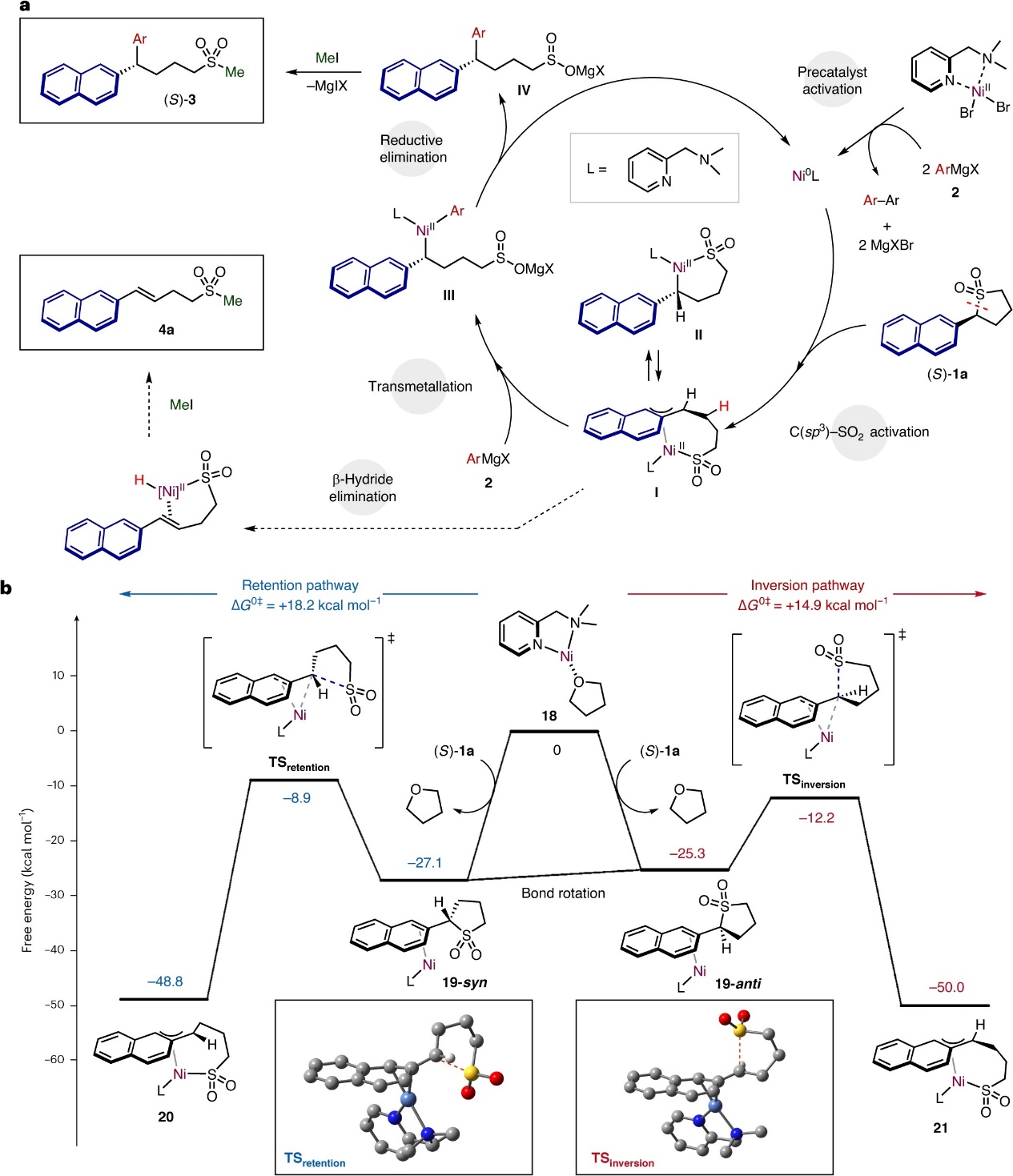
图5. 机理研究。图片来源:Nat. Chem.
总结
本文采用Ni 催化 Kumada-Tamao-Corriu 偶联策略,成功地实现了环烷基砜与格氏试剂的对映特异性交叉偶联反应,并且产物中可保留磺酰基,同时还在转化过程中实现高达99%的手性转移。原位监测表明交叉偶联与竞争性去质子化在动力学上竞争占优,进而带来高对映选择性转化。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantiospecific cross-coupling of cyclic alkyl sulfones
Roberto Nolla-Saltiel, Zachary T . Ariki, Stefanie Schiele, Jana Alpin, Yasuyo Tahara, Daisuke Yokogawa, Masakazu Nambo, Cathleen M. Crudden
Nat. Chem., 2024, 16, 1445–1452, DOI: 10.1038/s41557-024-01594-x
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号