氨基酸合成多肽,不上保护基也行?
近半个世纪以来,多肽在生物技术、医药、材料等领域的应用取得了令人瞩目的发展。以制药业为例,人们对多肽作为中分子药物的兴趣日益浓厚。目前市面上有80多种肽类药物,还有超过150种分子目前处于临床试验阶段,另有400种分子处于临床前开发阶段。尽管多肽的价值为世人公认,但其合成方法多年来却并未有太多的突破,目前多肽合成多采用历史悠长的经典策略——N端受保护的氨基酸与C端受保护的氨基酸缩合,接着去保护基团并进行随后的肽链延伸。为抑制如自缩合、过反应、环化等不希望的副反应,在肽键形成过程中使用保护基团必不可少。正因如此,合成多肽就要使用含保护基团的氨基酸这一概念已深入人心。近年来,随着绿色化学和可持续发展的理念成为共识,人们开始不断地尝试改进经典的使用保护基团的多肽合成策略,以提高多肽工业合成的生产效率。具体来说,保护基团的反复添加和去除在多肽合成中存在以下主要缺点:1)增加步骤,导致总产率下降;2)某些氨基酸保护和去保护的过程比较复杂;3)保护及去保护过程会产生大量难处理的废弃物;4)保护氨基酸价格相对较高。
日本中部大学的Tomohiro Hattori与Hisashi Yamamoto团队近年来关注使用无保护氨基酸可控形成肽键的研究。他们曾使用无保护氨基酸与硅(Si)试剂(J. Am. Chem. Soc. 2022, 144, 1758)或铝(Al)试剂(Chem. Sci. 2023, 14, 5795)形成五元环,再与氨基酸叔丁酯反应以合成肽。尽管取得了部分成功,但仍然受困于自缩合、顺序逆转、环化等副反应(图1C)。不过,这些研究中构建的硅环二肽(图1D)为无保护多肽合成带来了启发。硅环二肽稳定易得,可在C端和N端都轻松进行延伸。基于此,他们最近又在JACS 发表论文,报道了一种利用硅试剂在无保护氨基酸之间形成肽键的交叉缩合反应(图1D),产物的选择性、收率和纯度均令人满意。此外,他们还证明了这些化合物可进一步延伸,并在不使用偶联试剂的情况下实现了肽-肽延伸的汇聚式合成。
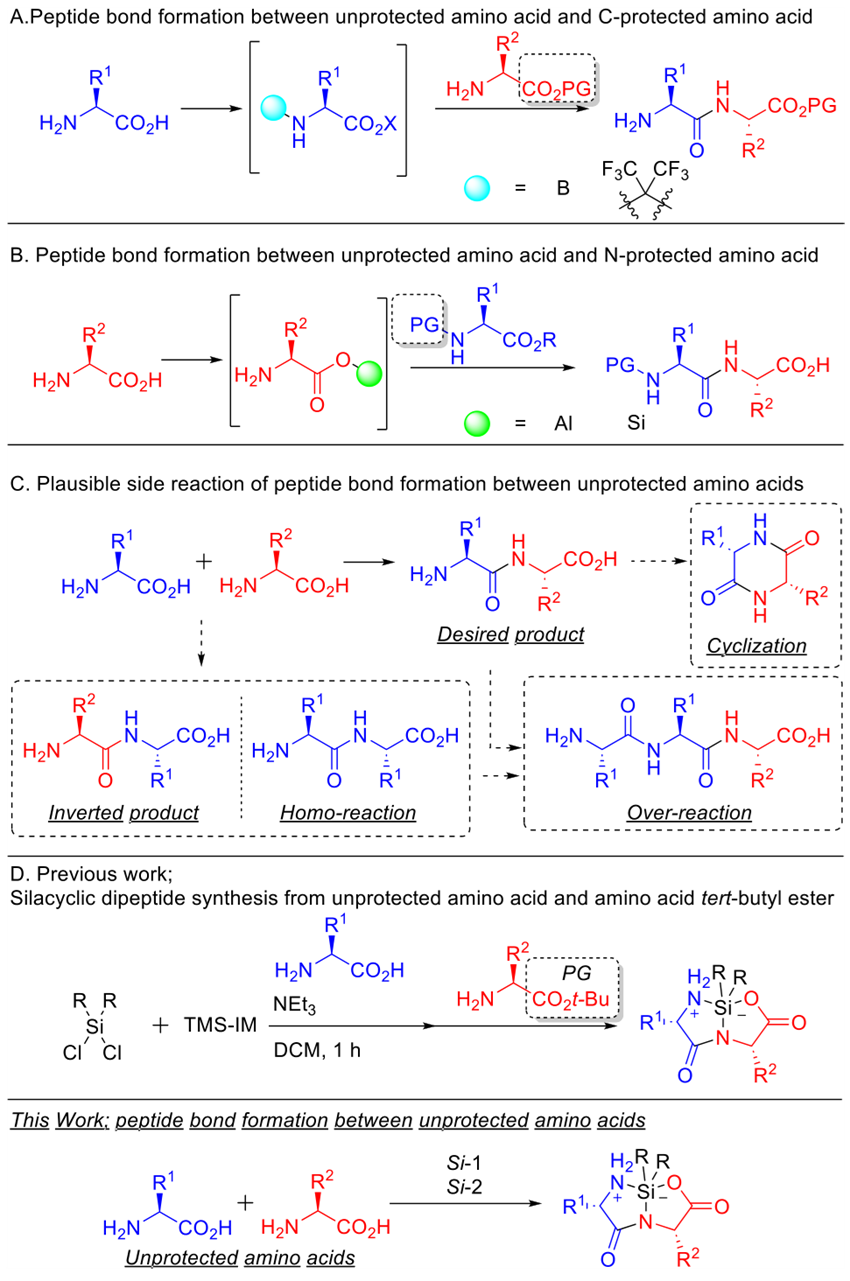
图1. 研究背景及无保护氨基酸多肽合成策略。图片来源:JACS
作者设想,带有两个离去基团的Si试剂与一个无保护氨基酸(N端氨基酸)反应时,会形成五元环中间体,此中间体可作为后续酰胺化反应中的亲电试剂。另一个无保护氨基酸(C端氨基酸),其羧基可与另一种Si试剂反应并生成相应氨基酸硅酯,这个硅酯则作为酰胺化反应中的亲核试剂。如此看来,找到合适的Si试剂是重中之重。作者使用苯丙氨酸(Phe,1)与双(1-咪唑基)二甲基硅烷在DCM中室温下反应1小时,然后加入各种Si试剂和丙氨酸(Ala,2)在50 °C下进一步剧烈搅拌24小时,然后通过硅胶柱色谱法分离产物(3),并比较了产物中硅环二肽的分离收率,以及反向序列(3′)和自缩合(3″)杂质形成(图2)。结果显示,尽管烷氧基硅烷在该反应中不适用(反应6-8),但有几种Si试剂起到了效果(反应1、2、4、5、9、10)。特别是N-三甲基硅基咪唑(TMS-IM)和N,O-双(三甲基硅基)三氟乙酰胺(BSTFA),都获得了优良的选择性和高产率。值得注意的是,当使用TMS-IM和BSTFA的混合物作为Si试剂时,反应几乎全部完成(反应11)。可见,使用这两种Si试剂的组合显著提高了氨基酸-TMS酯的形成效率。作者认为,BSTFA在无保护氨基酸的硅化反应中发挥了作用,而TMS-IM具有双重作用,能够与无保护氨基酸配位,增强其在DCM中的溶解度,并帮助氨基酸的硅化。一些反应在没有TMS-IM的情况下也可以进行(反应9和10),这可能是因为与Phe反应的双(1-咪唑基)二甲基硅烷将Ala转化为相应的硅酯。提高反应温度和加入金属催化剂似乎促进了硅化氨基酸的分解,导致产率和选择性降低(反应13 vs 14; 15 vs 16; 1 vs 17和18)。
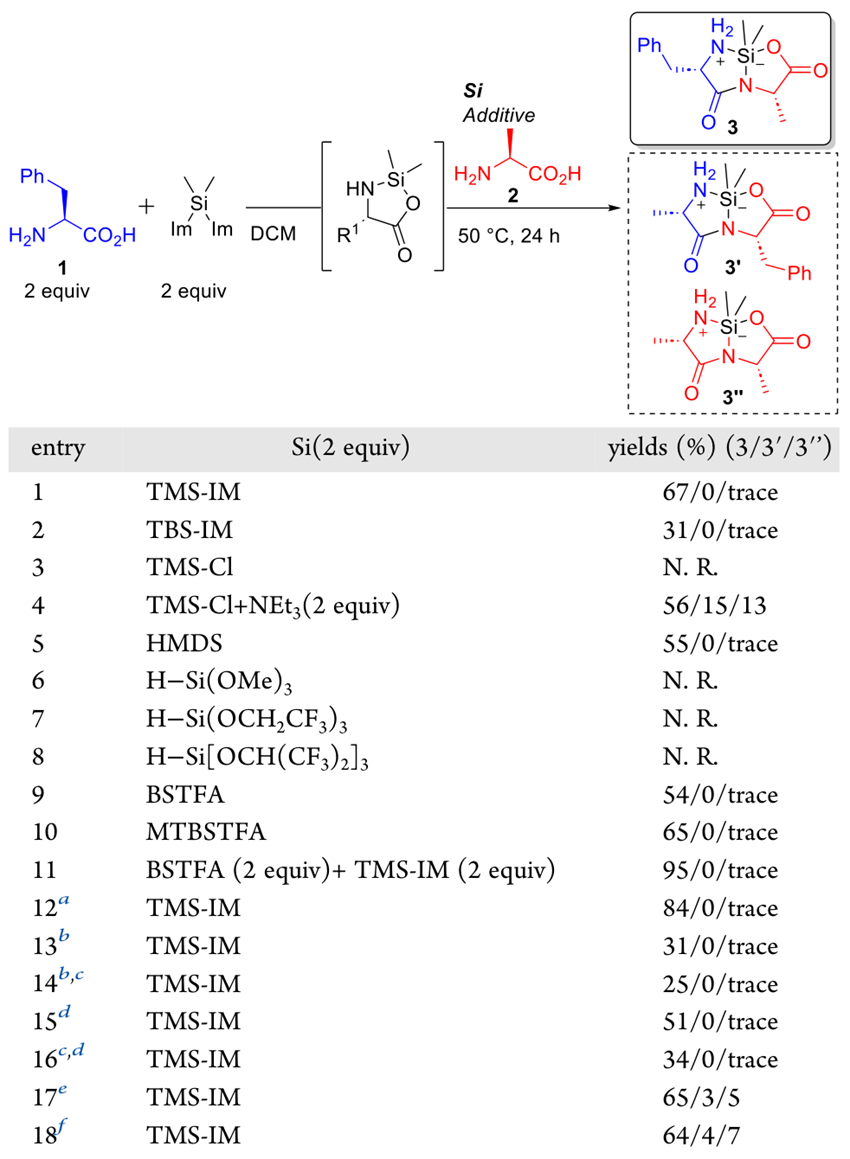
图2. 无保护氨基酸缩合反应及Si试剂效果。图片来源:JACS
接下来,研究者测试了该反应对于底物的选择性(图3)。硅环二肽的合成证实了氨基酸底物高度的兼容性,没有发现消旋化副反应。即便使用空间位阻较大的氨基酸(3b–3h 和 3aq–3av),也能保持很好的选择性。具有不同电子性质的Phe及其衍生物可作为亲核试剂和亲电试剂(3k−3r和3aw−3ba)。值得注意的是,吸电子和拉电子的Phe衍生物之间的反应都能到很好的选择性和收率(3bz 和 3ca),而且侧链保护的氨基酸在这个反应中也没有发现严重的保护基团裂解现象。更重要的是,某些活性氨基酸也可以在侧链不保护的情况下参与这个反应。在某些反应中,发现无保护的侧链基团在反应过程中原位形成TMS硅化产物(3m 和 3bd)。当使用Trp、Ser和Thr时,增加TMS-IM的当量使得侧链上的TMS保护基团完全形成(3ac、3be、3bk 和 3bm)。虽然已知苯基甘氨酸(Phg)非常容易发生异构化/消旋化,但通过使用稳定的无保护氨基酸作为底物,可以保持>99%的ee(3s 和 3bb)。这些硅环二肽在大气条件下稳定,但当加入MeOH中时,会顺利转化为无保护的目标二肽(4)(图4)。
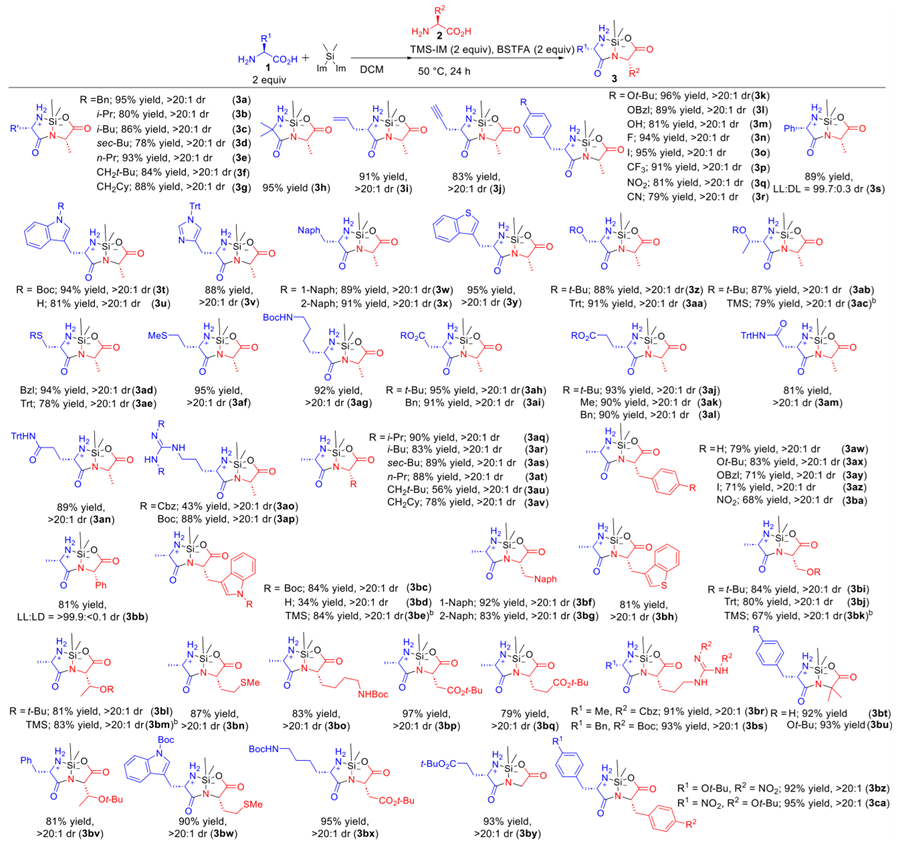
图3. 底物兼容性测试结果。图片来源:JACS
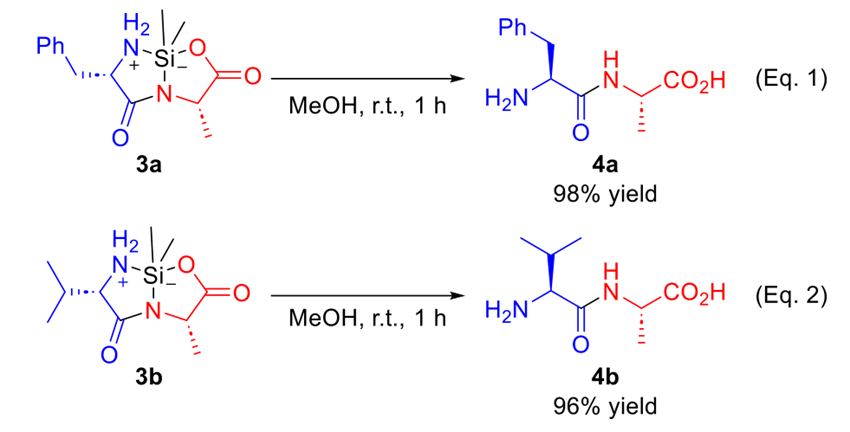
图4. 硅环二肽去保护过程。图片来源:JACS
总体来看,这个反应的化学选择性很高,几乎没有生成均二聚物和序列颠倒的杂质。为了研究这种化学选择性的起源,作者使用苄胺作为亲核试剂进行了对比试验。在预先搅拌Phe(1)和双(1-咪唑基)二甲基硅烷形成五元环中间体后,苄胺在碱性反应条件下加入,生成缩合产物(3′),产率为97%(图5, Eq. 1)。作为对比试验,使用BSTFA和TMS-IM处理苄胺,这个过程没有产生目标产物,因为作为亲电试剂的Phe没有形成相应的五元环中间产物(图5, Eq. 2)。也就是说,Phe必须被双(1-咪唑基)二甲基硅烷转化为相应的五元环中间体,才能与亲核的苄胺反应形成新的酰胺键。
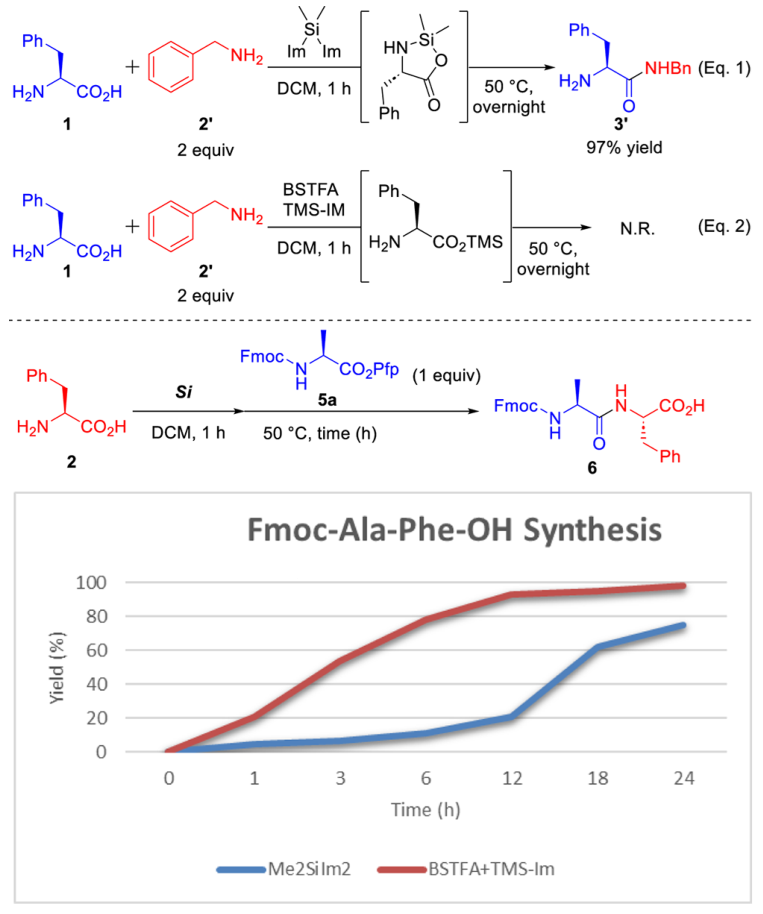
图5. Phe与苄胺反应的条件对比。图片来源:JACS
最后,作者尝试了使用这种策略合成较长肽链(图6)。多肽合成是按照N→C的方向延长肽链的,可以在TMS-IM的作用下顺利进行。此外,硅环三肽在使用TBAF开环后可以与氨基酸-Pfp酯反应。在两个末端的延长也得以实现,成功获得了胸腺五肽片段(10a 和 10b)。另外,五肽胃素衍生物也被合成出来(10c)。硅环三肽之间的缩合也得以实现。有趣的是,硅环三肽的Si原子与C末端苄酯相互作用,从而诱导弱活性状态。当硅环甲酯使用TBAF开环后,加入硅环苄酯到反应溶液中,通过Ta催化成功以较高产率生成了六肽(11)。结合这些结果,作者还成功合成了七肽。整个过程没有使用缩合试剂。
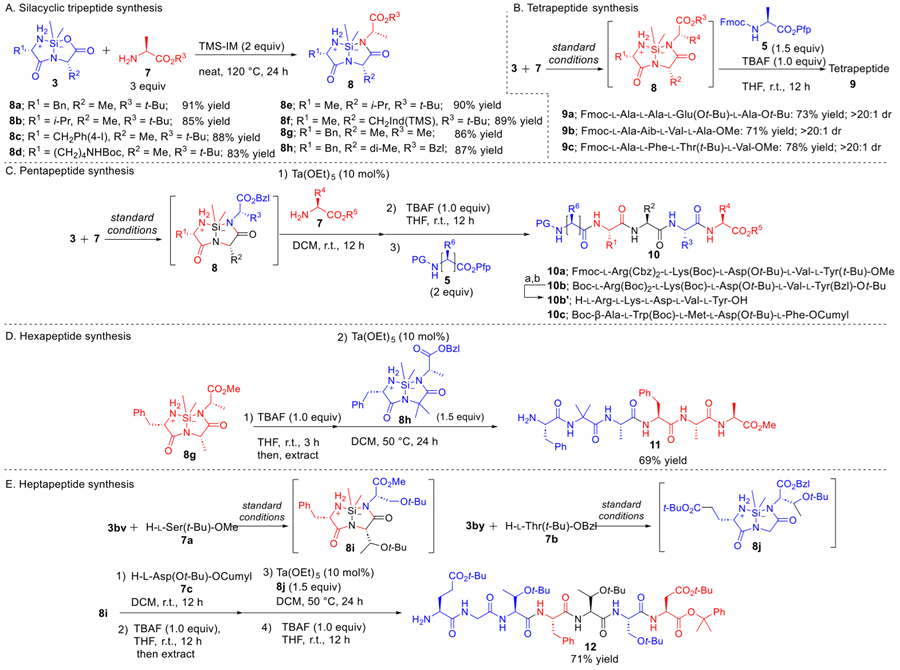
图6. 合成较长肽段。图片来源:JACS
总结
本文作者在氨基酸无保护的情况下以令人满意的化学选择性形成肽键,产物的选择性、收率和纯度均令人满意。此外,他们还在不使用偶联试剂的情况下实现了肽-肽延伸的汇聚式合成。毫无疑问,这种方法为高效、绿色多肽合成带来了新的启发。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Peptide Bond Formation Between Unprotected Amino Acids: Convergent Synthesis of Oligopeptides
Tomohiro Hattori*, Hisashi Yamamoto*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c08049
(本文由北纬55°供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号