南京大学应佚伦课题组JACS:纳米孔道单分子电化学实时追踪配体-受体多价相互作用
在过去几年中,由SARS-CoV-2病毒引起的新冠病毒肺炎席卷全球。该病毒表面的刺突蛋白(配体)与宿主细胞表面血管紧张素转换酶2(ACE2,受体)之间的相互作用,是病毒入侵细胞的关键步骤。南京大学应佚伦课题组在单亚基水平无标记、实时原位追踪并解析了刺突蛋白与ACE2间的多价相互作用,揭示了不同突变体在感染能力上存在差异的机制。
刺突蛋白以三聚体形式存在,可与多个ACE2受体进行多价相互作用,赋予新冠病毒强大的感染能力和免疫逃逸特性。病毒表面每个刺突蛋白-受体结合事件具有异质性,配体与受体的取向变化显著影响结合动力学。因此,实时追踪并无标记测量配体与受体的多价相互作用,有助于揭示病毒感染机制,开发靶向治疗策略。然而,病毒表面每个刺突蛋白-受体结合作用具有异质性,且多价相互作用具有瞬时性和路径复杂性,使得在单分子水平实时监测其动态过程极具挑战。
南京大学团队基于配体-受体结合诱导的体积增大效应,构建了一种配体-受体锚定的限域纳米孔道单分子电化学分析方法,模拟配体在生物界面上的空间取向,从而保持其结构的灵活性和最优的结合取向。该团队利用纳米孔道尖端电荷放大效应,将配体和受体解离和结合的动态过程转化为可测量的高时间分辨离子流电信号(图1),实时追踪了SARS-CoV-2奥密克戎变体(Omicron S)、原始毒株(WT S)和德尔塔毒株(Delta S)刺突蛋白与可溶性血管紧张素转换酶2(sACE2)受体间多价相互作用。
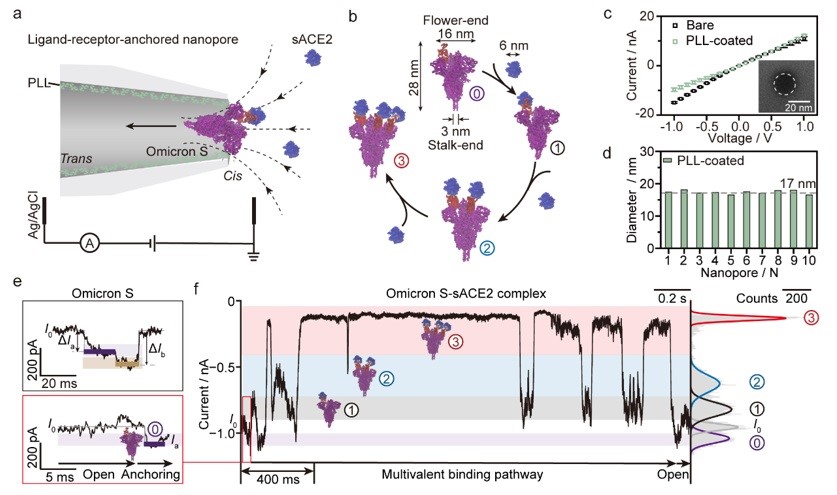
图1. 配体-受体锚定纳米孔道单分子电化学分析实时追踪多价相互作用
研究解析了刺突蛋白每一个亚基与sACE2的结合和解离速率,从而在单亚基水平揭示了SARS-CoV-2变体刺突蛋白与受体浓度依赖的结合路径差异(图2)。
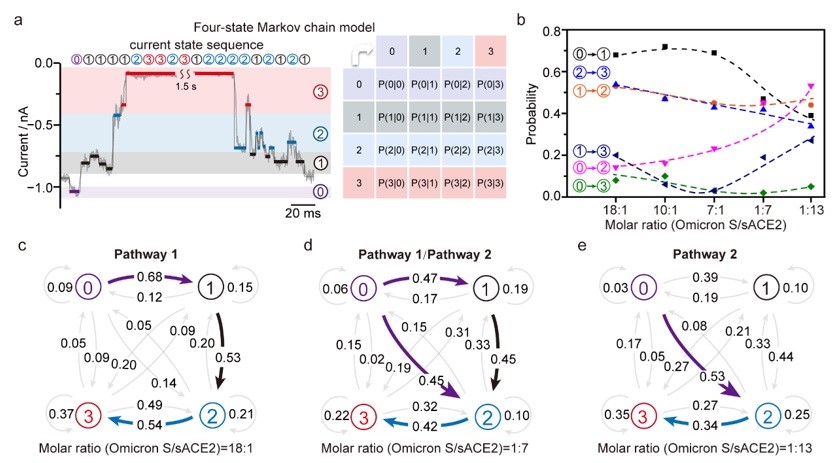
图2. 单分子水平解析Omicron S随sACE2受体浓度依赖的结合路径
值得注意的是,Omicron S的三个亚基均展现出对sACE2受体同等且极大的亲和能力,倾向于同时与三个受体结合,而WT S和Delta S则分别倾向于仅与一个或两个受体结合,且在与第一个sACE2结合后,其第二个亚基的结合能力显著下降(图3)。研究提供了一种在单分子水平追踪复杂蛋白-蛋白复杂动态相互作用网络的新方法,为理解病新冠毒感染的分子机制,以及靶向药物设计和治疗策略提供了重要参考。
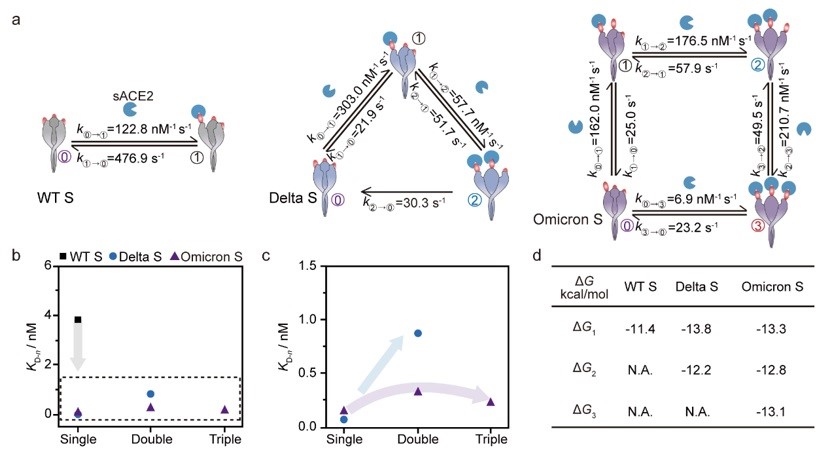
图3. 纳米孔道单分子电化学技术测量同源刺突蛋白和sACE2的结合及解离动力学行为
这一成果近期发表在Journal of the American Chemical Society 上,南京大学化学化工学院马慧副研究员与应佚伦教授为论文共同通讯作者,马慧副研究员与王勇勇(2021级硕士)为论文的共同第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Label-Free Mapping of Multivalent Binding Pathways with Ligand-Receptor-Anchored Nanopores
Hui Ma, Yongyong Wang, Ya-Xue Li, Bao-Kang Xie, Zheng-Li Hu, Ru-Jia Yu, Yi-Tao Long, Yi-Lun Ying
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c04934
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号