“硅”去来“烯”——构建桥环新方法
近日,南方科技大学李闯创教授(点击查看介绍)课题组报道了硅基联烯与缺电子烯烃的首例Type II [3+2] 环化反应,开发了具有挑战性的桥环体系的合成新策略。该方法具有广泛的底物适应性和高度的立体特异性,以该反应为关键策略,实现了活性天然产物strepsesquitriol的首次全合成。这一成果在线发表在国际顶级期刊JACS 上。
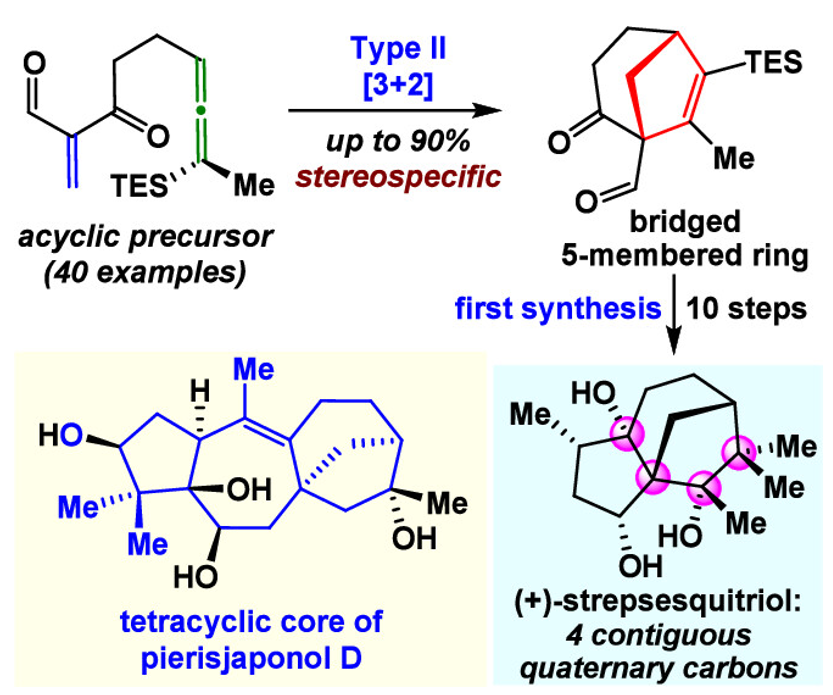
桥环体系(图1)广泛存在于具有重要生物活性的天然产物中,这其中包括含有六元桥环体系的紫杉醇(重要抗癌药)和含有五元桥环体系的樟脑、长叶烯、对映贝壳杉烯和阿义马林等(图1A)。虽然Type II分子内环加成反应是合成桥环体系的有效策略,例如,Shea的Type II分子内D-A环加成反应可以有效生成六元桥环体系(图1B)。然而,无论Shea的Type II环加成反应或其他Type II环加成策略(Wender的[4 + 4]、Davies的[4 + 3]、Li的[5 + 2]、Xu的[4 + 4])均未能被应用到五元桥环体系的合成中,原因在于通过上述环加成反应生成的五元桥环体系具有高张力桥头双键结构(图1B),不符合Bredt规则。并且,目前鲜有从非环前体出发单步合成桥五元环体系的研究报道。因此,开发直接有效的新策略,来构建这些广泛存在于天然产物中的五元桥环体系,仍具有重要意义。
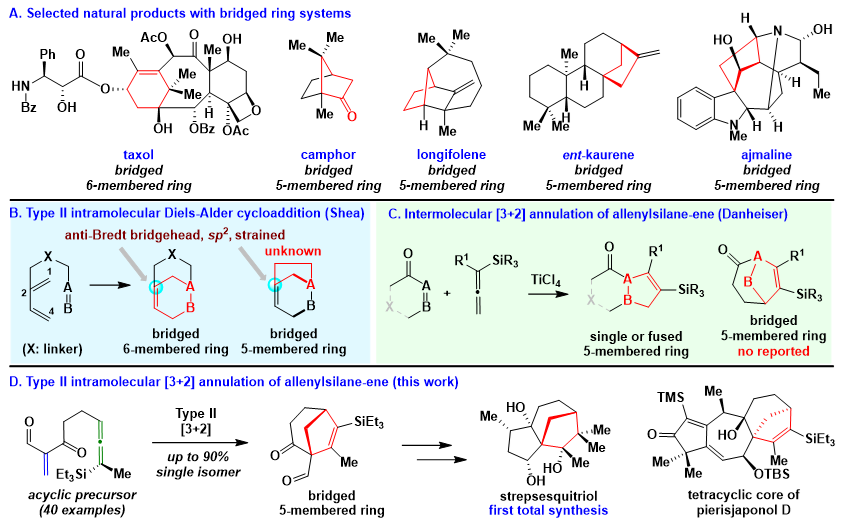
图1. 五元桥环体系(双环[3.2.1])的高效合成。图片来源:JACS
源于对具有桥环体系天然产物合成的持久兴趣,受Danheiser工作的启发(图1C),并基于此前关于硅基联烯和烯烃的首次分子内[3+2]反应的研究,李闯创教授课题组提出了硅基联烯和烯烃的首例Type II分子内[3+2]环化反应,并实现了五元桥环体系(双环[3.2.1])的高效合成(图1D)。根据作者提出的反应机理,在Lewis酸作用下,化合物1的硅基联烯先对缺电子烯烃进行分子内共轭加成,形成第一个五元环中间体A,随后发生1,2-硅基迁移生成中间体B,最后烯醇对烯基碳正离子进行分子内SN2亲核进攻,得到具有五元桥环体系的化合物2。然而,由于最终产物五元桥环分子的张力以及中间体A或B的脱硅副反应,立体选择性生成最终产物2具有较大的挑战性。
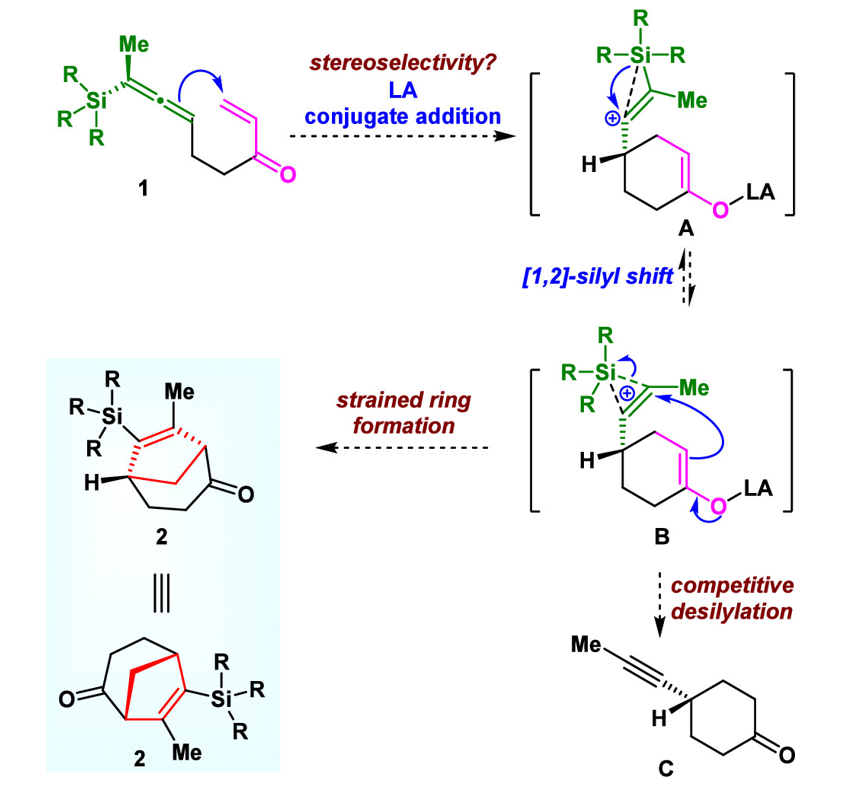
图2. Type II分子内[3+2]环化反应的机理。图片来源:JACS
作者在确定最佳反应条件后,对底物进行了拓展,高效合成了一系列[3.2.1]双环产物。值得注意的是,产物中引入的环内或环外羰基,为后续官能团化、进一步合成复杂天然产物提供便利。同时,作者通过手性前体 (-)-1j、(+)-1ii以及(-)-1ii的环化反应分别得到了单一手性产物 (-)-2j、(+)-2ii以及(-)-2ii,产物的绝对构型均通过对应的衍生物单晶衍射得以确证,表明了该Type II分子内[3+2]环化反应的高度立体特异性(图4)。值得注意的是,作者在文中指出,在电子效应和空间位阻的双重作用下,硅基联烯对缺电子烯烃进行的共轭加成总是发生在碳硅键的反面进行,这是该反应的高度立体特异性的原因。
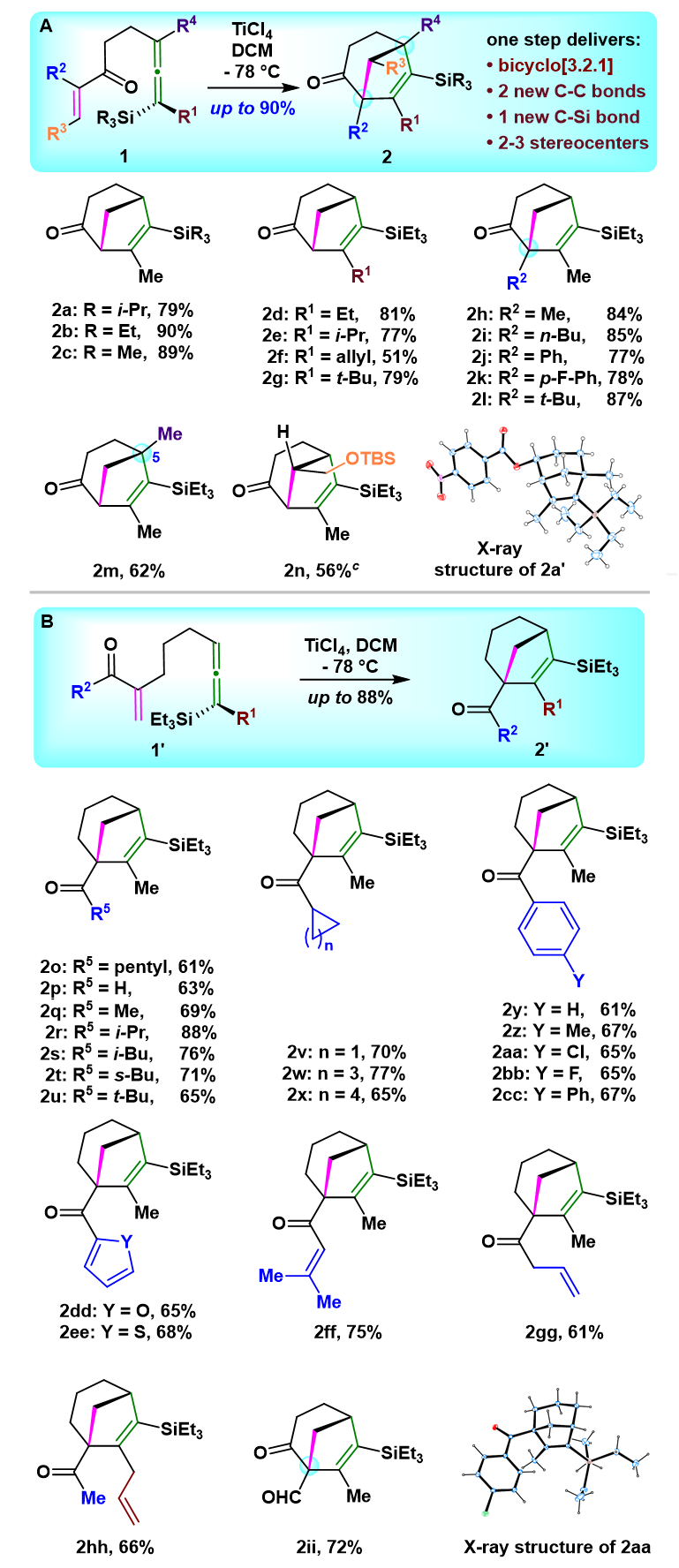
图3. 底物拓展。图片来源:JACS
此外,基于以上策略,作者尝试了化合物3的DMP氧化/[3 + 2]环化的串联反应,并以83%的产率得到了化合物(±)-2ii(图4)。从化合物(±)-2ii出发,经过分别对醛和酮羰基的两步加成、Pauson-Khand反应、羰基α位双甲基化,作者快速构建了pierisjaponol D极具合成挑战性的四环核心骨架,对本策略的应用性进行了探索(图4)。
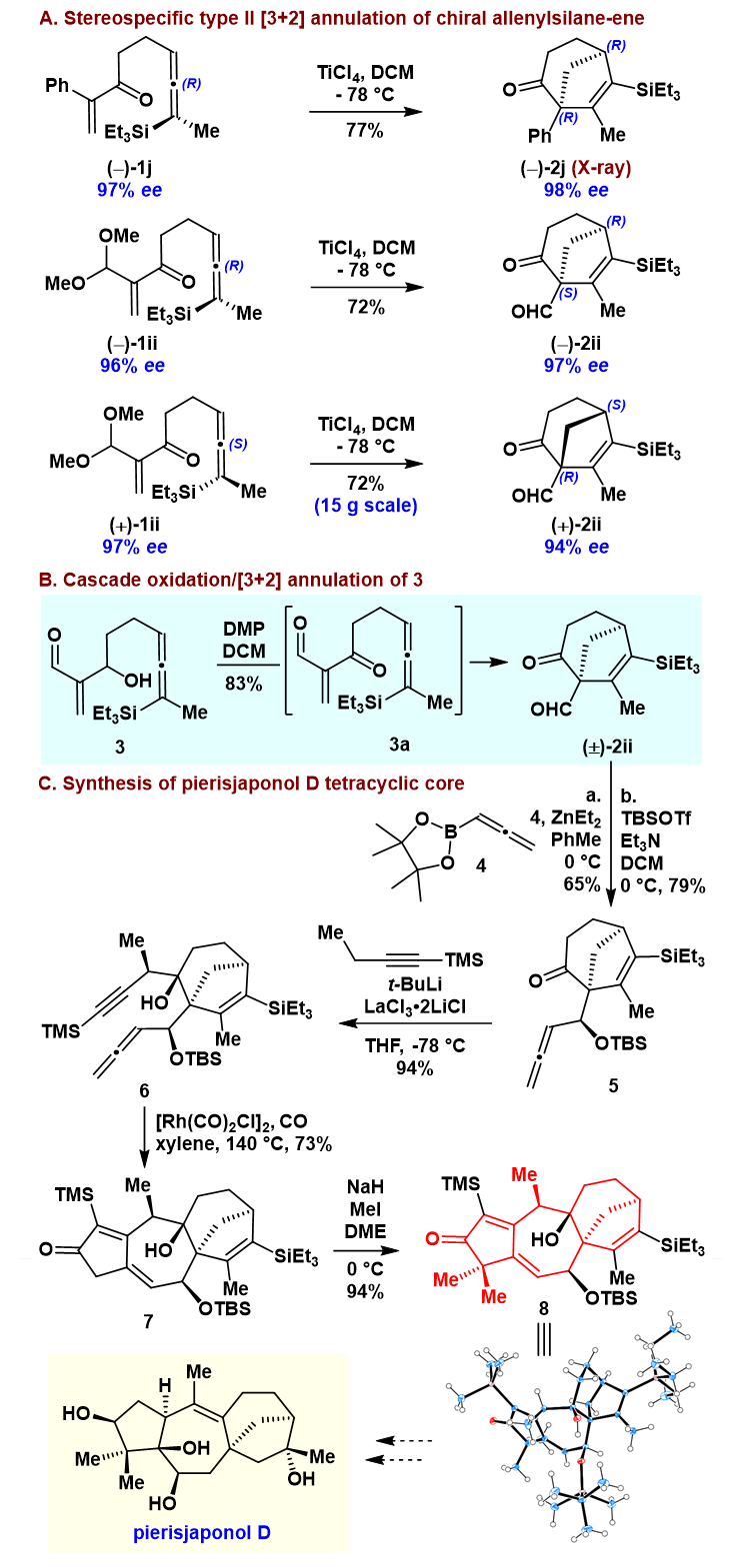
图4. Type II分子内[3+2]环化反应的立体特异性及pierisjaponol D四环核心骨架的构建。图片来源:JACS
同时,作者完成了(+)-和(-)-strepsesquitriol的首次不对称合成。结构上,strepsesquitiol是含有双环[3.2.1]辛烷的三羟基三环[6.2.1.01,5]十一烷,为一种重排的zizaane-type倍半萜。此外,它包含6个手性中心(5个连续),还有4个连续的季碳,包括C1和C9两个全碳的季碳中心,C5和C10两个叔醇(图5)。上述结构给它的全合成带来较大的挑战性,且此前未见全合成报道。作者分别从手性化合物(+)-2ii和(-)-2ii出发,经由10步,分别完成(+)-和(-)-strepsesquitriol的不对称全合成,再次印证了该合成策略的高效性与实用性。
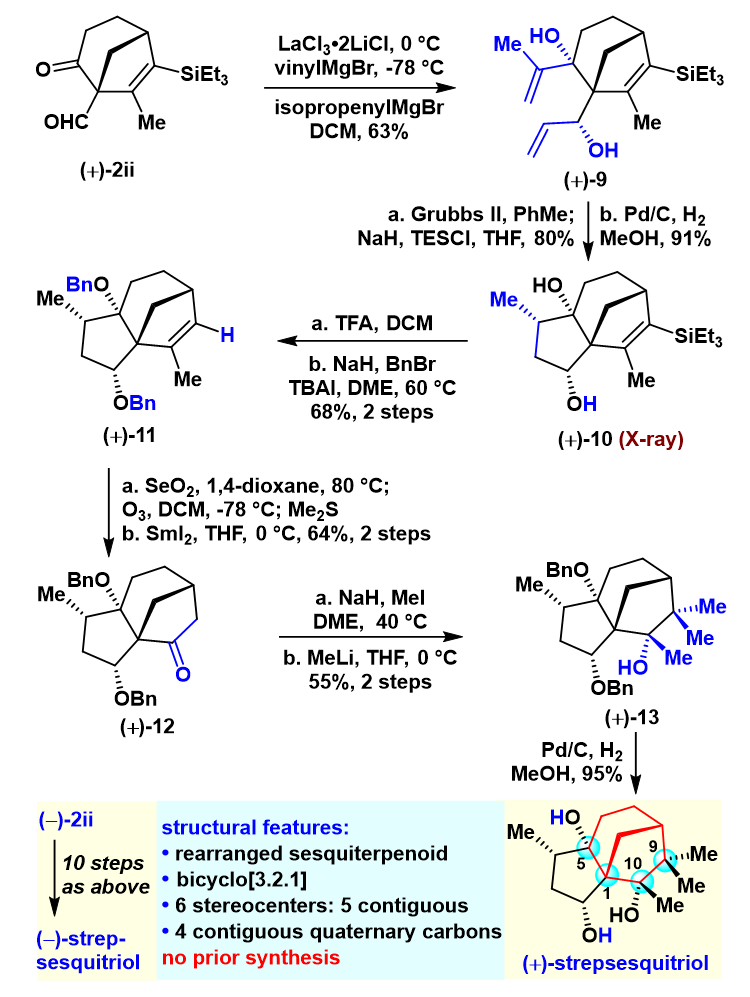
图5. (+)-strepsesquitriol的不对称全合成。图片来源:JACS
小结
南科大李闯创课题组发展了Lewis酸介导的硅基联烯和烯烃的Type II分子内[3+2]环化反应,为高效、立体选择性地构建双环[3.2.1]体系提供了新方法。该方法具有广泛的底物适用性和高度立体特异性,使其在复杂天然产物的全合成领域将拥有强大的应用价值。通过(+)-和(-)-strepsesquitriol的不对称全合成和pierisjaponol D四环骨架的高效构建证明了这一点。值得注意的是,该方法是硅基联烯和烯烃的首次Type II [3+2]环化反应,再次拓展了新型环化反应的种类。该成果为其他含有桥环骨架的活性天然产物的合成提供了一种新方法。
谨以该论文献给我国著名有机化学家戴立信院士!

图6. 戴立信院士

原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of Bridged Five-Membered Ring Systems by Type II [3 + 2] Annulation of Allenylsilane-ene
Ling-Zi Li, Yu-Rou Huang, Zi-Xun Xu, Hong-Sen He, Hong-Wei Ran, Ke-Yu Zhu, Jing-Chun Han*, Chuang-Chuang Li*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c09384
导师介绍
李闯创
https://www.x-mol.com/groups/li-chuangchuang
李闯创团队近期工作报道(点击标题阅读):
南科大李闯创课题组招聘推免研究生多名
1. 课题组负责人简介:
李闯创,讲席教授,博士生导师。北京大学博士(2006,导师:杨震教授),美国加州Scripps研究所博士后(2006-2008,导师:Baran院士),2008年加入北京大学任教,2013年调入南方科技大学。曾获得或入选:国家杰出青年基金、第三批国家万人领军人才、科技部中青年科技创新领军人才、国家基金委优秀青年基金、深圳市自然科学奖一等奖、广东省自然科学奖一等奖、中国化学会“维善”天然产物合成化学奖、药明康德生命化学研究奖等。
李闯创教授课题组在天然产物全合成、合成方法学、药物化学等领域,已取得了一系列颇具特色的学术成果,并在教书育人方面积累了丰富的经验:
(1)发展了新策略,以世界上最短的合成路线,实现了合成历史上最难分子之一紫杉醇(重要抗癌药)的高效全合成。
(2)发展了若干独特的合成方法学,例如,首次建立了独特的[5+2]环加成反应,并使该反应成为高效构建多种桥环的新方法,以该反应为新策略,高效合成了一批具有桥环体系的重要天然产物,包括甾体、萜类、生物碱等,进而推动了新型环加成研究方向的发展。
(3)完成了60余个具有合成挑战性的复杂天然产物全合成(50余个首次),包括了20类不同家族,为后续的药物化学、药理学等研究提供了丰富的物质基础。
(4)研究成果多次得到国家基金委、知名学术媒体杂志的正面评论与亮点报道,如:国家基金委(3),国家科技部,Nature,Nat. Chem.等;紫杉醇的全合成工作,入选了教科书《手性合成》。
(5)已培养10余名毕业优秀博士生(先后到哈佛大学、芝加哥大学等大学进行博士后研究),多名学生已在国内知名大学任教授。
2. 招聘条件:
★ 获得贵校推免研究生的资格。
★ 对前沿合成化学或药物化学研究工作有强烈的职业兴趣。
★ 工作作风积极肯干,有能力在一个学术氛围浓厚,快节奏,全英文的研究组里按时完成研究项目并快速成长。求知欲旺盛,有志进一步在本专业内深造,职业目标是成长为优秀的青年化学家。
3. 学习、工作条件和待遇:
★ 实验室提供先进的实验设备与舒心的科研工作环境。
★ 将在李闯创教授指导下,进行天然产物全合成、合成方法学、药物化学等前沿研究工作。
★ 本实验室对硕士研究生提供最具竞争力的津贴待遇(~5万/年)。
★ 优秀申请者有机会直接攻读博士或者转博;已有多名研究生成功成为南科大博士生。
4. 更多详细信息请参考课题组主页:
https://li.chem.sustech.edu.cn/
我们诚挚邀请所有优秀的申请者在方便的时候到深圳实地访问参观我们实验室,请与我们联系,我方负责所有的交通、住宿和餐饮费用!
联系人:李闯创 教授,E-mail: ccli@sustech.edu.cn
有意向者请将pdf格式的详细简历发至李闯创教授邮箱,邮件标题请注明“姓名+毕业学校+推免研究生”。
来信必复,来者不拒。招聘长期有效。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号