Nature:小分子催化剂,Sɴ2反应新突破
副标题:几何预组织催化SN2反应的研究
双分子亲核取代(SN2)反应是有机化学中非常重要的一类反应,并广泛应用于理论研究、药物合成和材料科学等领域。尽管 SN2 途径在合成中非常重要,但离子型SN2 反应途径在催化控制中却很少见,而且离子双分子型SN2反应途径在极性非质子溶剂中的反应速度要强于质子溶剂,例如:叠氮化物与三甲基锍在丙酮中进行反应时,反应速度比甲醇快~105倍(图1a),经典化学中,与部分带电的SN2过渡态相比质子溶剂分子的氢键相互作用更能稳定离子反应物,进而导致活化能垒较高。目前,少数酶促SN2反应通常采用酸-碱催化剂来活化不带电的亲核试剂或亲电试剂,而亲核卤代酶5'-氟-5'-脱氧腺苷合成酶(FDAS)则是通过另一种机制来促进阳离子S-腺苷甲硫氨酸(SAM)的氟化/氯化反应(图1b),并且固态X-射线结构表征以及立体化学、理论和动力学研究表明卤化物键合活性位点促使酶的催化效率提高了~106倍。在这种酶促反应机制中,过渡态相对于基态的静电稳定作用与加速反应并不相关。相反,酶活性位点经预组织以稳定几何上类似于过渡态的“近攻击”基态构象。这样看来,对基态的预组织也是必要的,这是因为完全带电基态的静电相互作用在热力学上比活化配合物更有利。
近日,美国哈佛大学的Eric N. Jacobsen教授(点击查看介绍)课题组利用精确设计的手性小分子(646 Da)氢键供体(HBD)催化剂,通过重现酶采用的几何预组织原理加速了对映选择性Michaelis-Arbuzov反应的SN2脱烷基化步骤,从而高对映选择性地构建了一系列可进行多种衍生化的H-亚膦酸酯(图1c、图1d)。机理和计算研究表明HBD虽降低了氯化物亲核试剂的反应性,但也可将鏻阳离子和氯化物阴离子重组织为一种预备进入SN2过渡态的几何结构,从而加速脱烷基化决速步。相关成果发表于Nature 上。
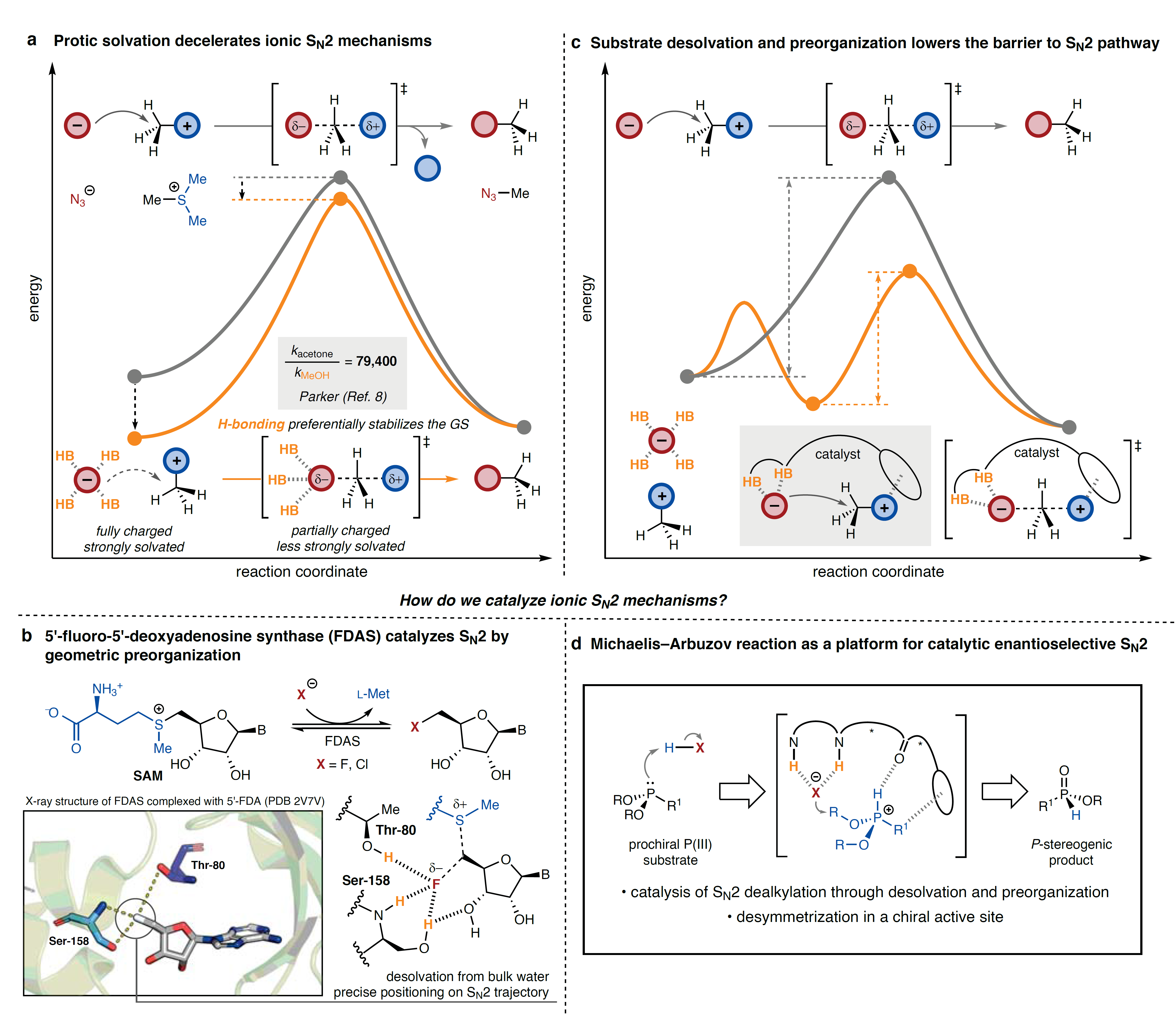
图1. 应用酶的策略实现离子型SN2机制。图片来源:Nature
首先,作者选择二苄基苯基磷酸盐2a和HCl为模板底物对Michaelis-Arbuzov反应的手性HBD催化剂进行了筛选(图2a),结果显示硫脲1c比方酰胺1a或脲1b具有更高的对映选择性。进一步研究发现吡咯烷上α-芳基取代基的大小与对映选择性呈正相关,其中2-菲基取代的硫脲1g能以90% ee值和定量产率获得脱烷基化产物3a。另外,将反应溶剂从甲基叔丁基醚(MTBE)变成甲苯、HCl从2 equiv变成1 equiv并将反应混合物稀释至50 mM后,对映选择性显著提高(95% ee)。其次,鉴于催化剂1g比非催化途径加速2a的反应约30倍,因此作者对反应机理进行了初步研究。如图2b所示,作者通过修饰1g的骨架来将其阴离子键合(“卤化物空穴”)域与假定的阳离子键合t-Leu-芳基吡咯烷域进行分离。当用正辛基替换t-Leu-芳基吡咯烷单元时便可合成简单的阴离子键合变体4,其催化脱烷基化反应速率低于背景反应(图2b,黄色与灰色轨迹),这说明1g中简单硫脲类似物在抑制离子对坍缩的能力上模仿了质子溶剂;而变体5(由硫脲的 S-甲基化合成)则不会引起速率加速(图2b,蓝色),甚至将10 mol%4和5结合起来也不会加速反应速率,这些结果说明两个结构域及其在 1g 中的精确相对空间取向是至关重要的。
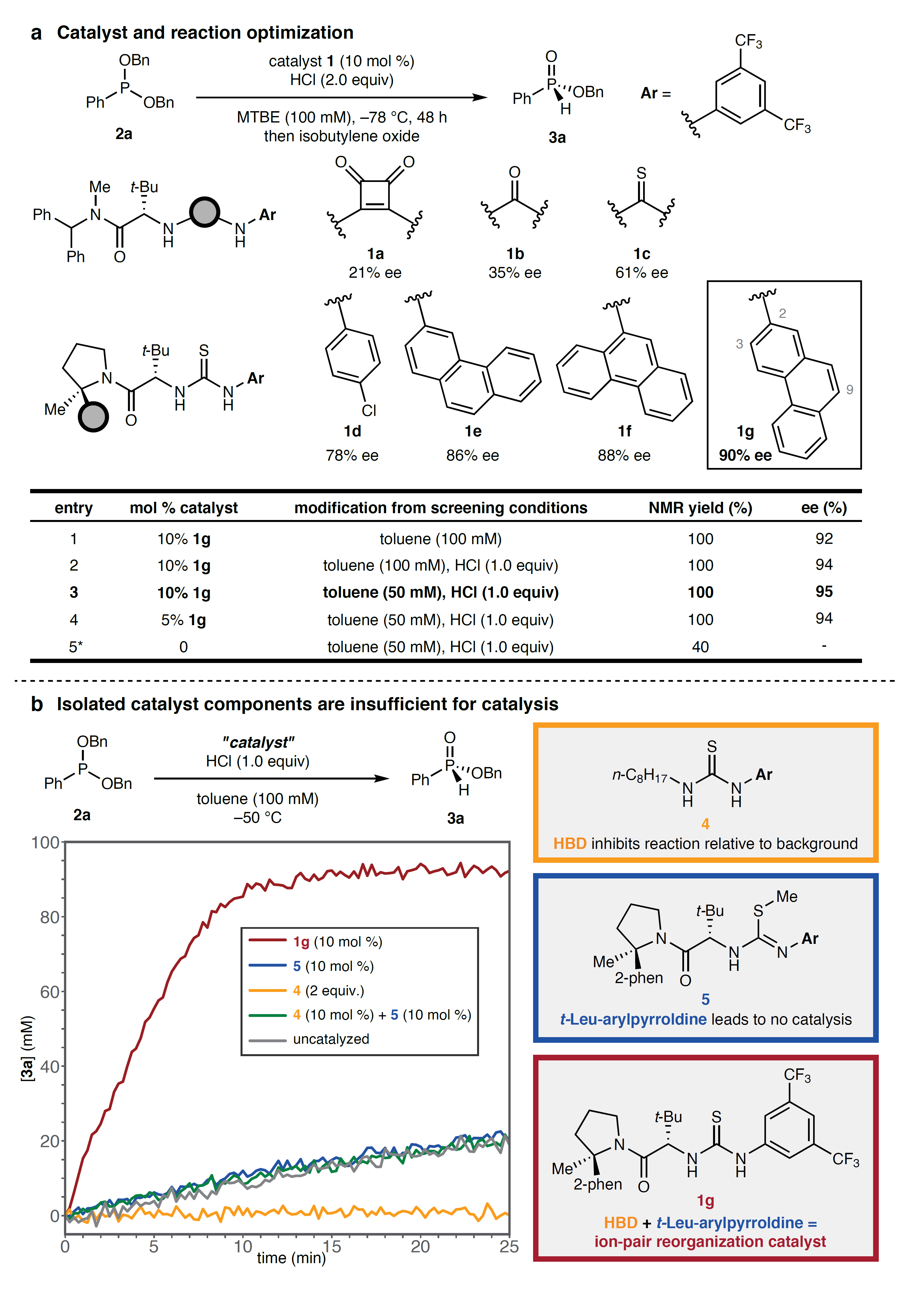
图2. 反应条件优化。图片来源:Nature
为了进一步探究反应机理,作者进行了一系列实验,具体而言:1)通过31P NMR监测硫脲1g催化2a与HCl的反应时(图3a),在反应初始阶段未检测到δ=159 ppm的2a信号,而是在δ=52 ppm(归属于氯化鏻中间体6a)处观察到双峰并且该信号随着产物3a(δ=24 ppm)的生成逐渐减弱,这说明6a在催化体系中具有重要作用并且其在催化条件下是底物的静息态;2)采用扩散有序核磁共振光谱法(DOSY)来研究催化剂1g的扩散常数以探索催化剂1g的静息态,结果显示单独的催化剂1g溶液可获得与单体状态一致的分子量,在反应条件下测得的催化剂静息态分子量与1:1 1g•6a配合物相一致,而反应结束后测得的分子量介于单体1g和1:1 1g•3a配合物之间,这说明催化剂1g与氯化鏻中间体6a形成1:1配合物,催化脱烷基化决速步;3)动力学研究显示反应速率对催化剂[1g]T呈一级相关(图3b),同时氯化鏻物种6a的消耗和产物3a的形成在反应的前80%都遵循零级动力学反应速率(图3c),这与1:1 1g•6a静息态配合物产生的周转限制和对映选择性决定的脱烷基化过渡态相一致。在此基础上,作者提出了可能的反应机理(图3d):首先,底物2a与HCl经质子化形成氯化鏻中间体6a并且质子化平衡有利于6a,与单体催化剂1g键合可形成静息态配合物1g•6a,接着经过渡态TScat进行对映选择性脱烷基化并得到1g•3a配合物,最后经解离便可得到产物3a并再生催化剂1g。
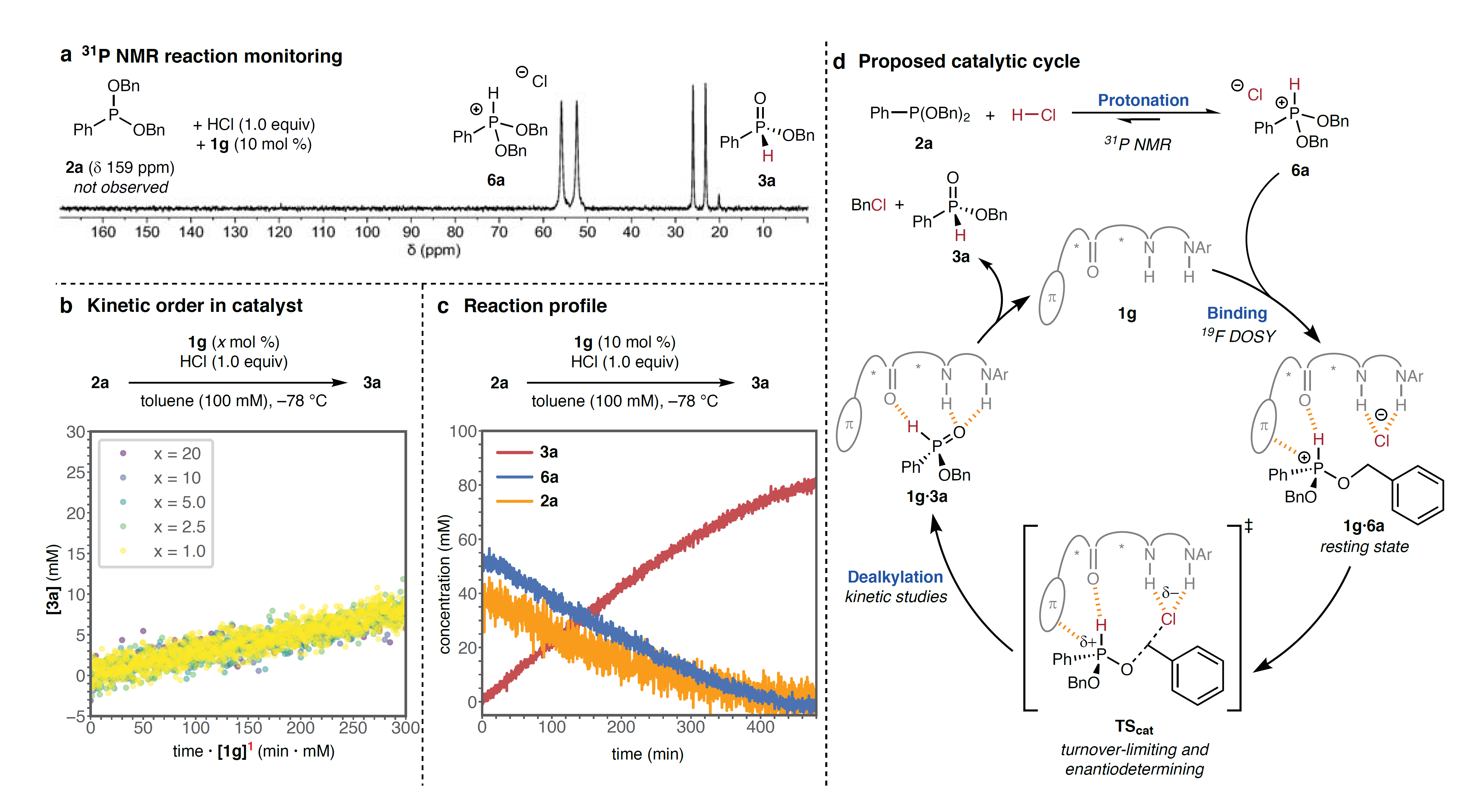
图3. 机理研究。图片来源:Nature
随后,作者通过密度泛函理论(DFT)计算对SN2反应步骤进行了研究(图4a),结果显示无催化剂时氯化鏻6a是一个具有笼状结构的紧密离子对,其中氯离子与阳离子进行多种稳定相互作用并且所有稳定的氢键相互作用和基态中存在的大部分库仑引力必须牺牲,以类似于在卤化酶反应中从水溶液介质去溶剂化的方式来实现SN2机制所要求的线性几何形状。基于这种几何重组,协同脱烷基化途径可以在概念上分为离子对重组和离子对坍塌阶段,而且这两个阶段可以用非稳态6a′来划分,同时整个电子活化势垒的>75%源于氯离子重组(6a→6a′),而与共价键断裂和形成事件对应的离子对坍塌对整个势垒的贡献<25%(~4 kcal/mol)。在催化循环过程中,作者发现亲核取代分两步进行,并且氯化鏻静息态配合物1g•6a'的几何特征与6a'非常相似,即氯化物通过氢键定位在接近最佳预过渡态的几何位置以进入过渡态TScat,R(图4b),因此催化剂1g可以视为一种极具吸引力的非共价相互作用网络以获得一个相对稳定的基态配合物1g•6a',为脱烷基化反应做好准备。与非催化途径相比,催化剂缔合提高了离子对坍塌的能垒(7.5 vs 4.0 kcal/mol),这与氢键对氯化物亲核性的预期衰减作用一致。然而,由于催化剂减轻了氯化鏻离子对所需几何预组织的能垒(1.9 vs 13 kcal/mol),大大抵消了离子对坍塌的抑制作用,导致反应速率相比于背景反应有所提高。其次,研究表明3a的主要异构体为(R)-构型、次要异构体为(S)-构型,这是因为TScat,S将膦P-Ph基团定位在催化剂的2-菲基下方,同时展开其苄基;而能量较低的TScat,R将P-Ph基团置于溶剂中并堆叠两个苄氧基,其中一个位于催化剂的2-菲基下方。虽然TScat,S和TScat,R都具有几个共同的非共价吸引相互作用,但是TScat,S在苄基C-H键和酰胺氧之间具有一个额外的氢键相互作用,而TScat,R包含两个苄基C-H-π相互作用,因此失去一个苄基C-H氢键相互作用并获得两个苄基C-H-π相互作用的净能量效益在决定对映体诱导方面发挥了关键作用。

图4. 手性起源。图片来源:Nature
最后,作者考察了该反应的底物适用性,结果显示对位(3a-3j)和间位(3k-3m)带有不同基团的芳基亚膦酸酯、邻位稠合的多环芳基亚膦酸酯(3p、3q)、萘基亚膦酸酯(3r)、杂芳基亚膦酸酯(3s-3v)甚至非芳基取代基的亚膦酸酯(3w、3x)均可兼容该反应,以良好至优异的产率和对映选择性获得水氧稳定的手性H-亚膦酸酯(图5a),尽管邻位取代的芳基膦酸酯(3n、3o)对映选择性较差。值得一提的是,2a的对映选择性脱烷基化反应还能以克级规模进行制备,仅需3 mol%催化剂1g便能以优异的对映选择性(93% ee)和产率(98%)获得相应产物,并且催化剂回收率高达95%。另一方面,作者以(R)-苄基苯基亚膦酸酯3a为原料对脱烷基化反应正交双官能团化进行了研究(图5b),具体而言:1)基于亚膦酸酯的磷化Mannich反应性,(R)-苄基苯基亚膦酸酯3a与Eschenmoser盐在苯酚锂的作用下发生Pudovik加成并获得α-氨基亚膦酸酯7a,其苄氧基在甲基锂的存在下被亲核取代并得到8a,同时膦立体中心的对映选择性没有任何损失;2)将亲核性P-H片段转化为亲电性P-Cl,然后被杂原子型亲核试剂(如:苄胺和酪氨酸)捕获便可以高产率和对映特异性获得膦酸酯9b和膦酰胺9a;3)利用前人报道的H-亚膦酸酯和苯醌之间的1,6-偶联反应条件,以优异的立体特异性实现了3a与苯醌的氧化偶联并获得O-磷酰基对苯二酚衍生物10a,这表明在无手性控制元素的情况下,3a衍生的磷酰基自由基具有足够的构型稳定性来参与立体特异性反应;4)3a经硫化-甲基化序列以优异的对映体特异性获得硫代膦酸酯11a。
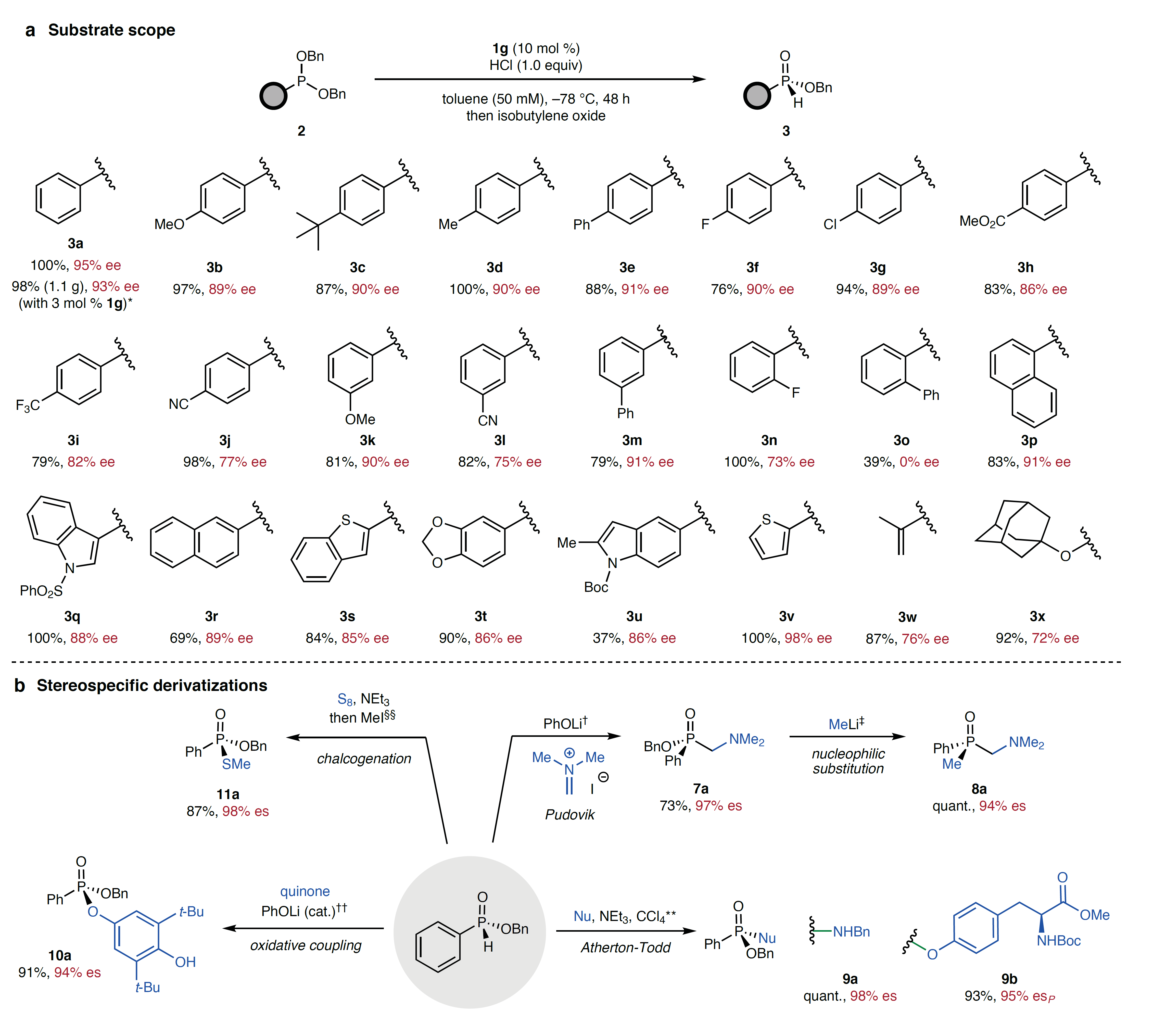
图5. 底物拓展及其衍生化。图片来源:Nature
总结
Jacobsen教授课题组精心设计了手性小分子氢键供体催化剂,通过重现酶采用的几何预组织原理加速了对映选择性Michaelis-Arbuzov反应的SN2脱烷基化步骤,高对映选择性地构建了一系列H-亚膦酸酯,这类化合物可进行多种衍生化。该工作不仅首次展示了对鏻鎓脱烷基化步骤的催化对映控制,还为 P-立体中心化合物的合成建立了一个新平台。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalysis of an SN2 pathway by geometric preorganization
Gabriel J. Lovinger, Marcus H. Sak, Eric N. Jacobsen
Nature, 2024, 632, 1052–1059, DOI: 10.1038/s41586-024-07811-4
导师介绍
Eric N. Jacobsen
https://www.x-mol.com/university/faculty/26725
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号